
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2021年2月26日
iPS細胞から肥大軟骨細胞への誘導法を確立し、成長板疾患の病態再現に成功
ポイント
- iPS細胞から体節1)、硬節2)を経て増殖軟骨細胞、そして肥大軟骨細胞を誘導する方法を確立しました。
- 成長板3)を病態の場とする疾患の患者さん由来iPS細胞を樹立して、肥大軟骨細胞に分化誘導することで、変異タンパク質が小胞体4)に蓄積し、その結果小胞体ストレスが亢進するという病態の再現に成功しました。一方誘導される小胞体ストレス関連シグナルは変異株によって大きく異なることも判明しました。
- 変異iPS細胞由来硬節細胞を免疫不全マウスに移植し、成長板様組織を作製させ、マウスで報告されているin vivo の病態を部分的に再現しました。
- 治療薬候補である化学シャペロン5)によりin vitro の病態が改善することを示し、確立した分化誘導系が治療薬探索のための基盤として有効であることを確認しました。
Yann Pretemer大学院生(京都大学CiRA増殖分化機構研究部門)、川井俊介特定助教(CiRA同部門)、戸口田淳也教授(CiRA同部門/京都大学ウイルス・再生医科学研究所)らの研究グループは、患者さん由来のiPS細胞を用いて成長板という軟骨組織の病態を再現し、創薬に向けた基盤の確立に成功しました。
研究グループは、既に報告していたiPS細胞から体節を経た分化誘導系を用いて硬節細胞を誘導し、そこから軟骨系譜の細胞を誘導、更にトリヨードサイロニン(T3) 6)を用いることで、肥大軟骨細胞まで誘導する培養法を確立しました。次に成長板の異常により四肢の短縮や変形を生じる疾患である多発性骨端異形成症(Multiple Epiphyseal Dysplasia, MED)7)とシュミット型骨幹端軟骨異形成症(Metaphyseal Chondrodysplasia Schmid type)8)の患者さんからiPS細胞を作製しました(変異細胞)。
また、それぞれのiPS細胞について、疾患の原因遺伝子であるMATN3 遺伝子9)及びCOL10A1遺伝子10)の変異部位をゲノム編集技術により修復した細胞を作製しました(対照細胞)。これらの疾患では変異タンパク質が小胞体に蓄積することで細胞に小胞体ストレス11)を与え、細胞死に至らしめることが重要な病態であると想定されています。それぞれのiPS細胞を確立した分化誘導系により、肥大軟骨細胞まで誘導したところ、変異細胞由来の細胞では変異タンパク質が小胞体に蓄積し、小胞体ストレスが亢進していることが判明しました。一方、トランスクリプトーム解析では、それぞれの変異が細胞に及ぼす影響は大きく異なり、病態の多様性をin vitro で確認できました。また硬節まで誘導した細胞を免疫不全マウスに移植したところ、対照細胞では成長板類似組織が形成されたのに対し、変異細胞由来組織では層状及び柱状構造が乱れており、マウスモデルで報告されている異常の一部が観察されました。最後に治療薬の候補である化学シャペロンを添加した培養実験により、変異タンパク質の小胞体への蓄積が減少し、小胞体ストレスも軽減していることが示され、確立した分化誘導系が成長板疾患の病態解明から創薬のための基盤として有用であることが確認されました。また経時的に増殖細胞から肥大細胞までの軟骨細胞の分化過程を観察できることから、成長板の増殖分化制御機構の理解のための新しいツールとしても意義あるものとなると考えられます。
この研究成果は2021年2月26日(日本時間)に「Stem Cell Reports」で公開されました。
成長板は骨の骨端と骨幹端の間に存在する軟骨組織であり、骨の長軸方向の成長に必須の組織です。成長板における軟骨細胞は、静止軟骨細胞から増殖軟骨細胞、前肥大軟骨細胞、そして肥大軟骨細胞へと分化し、その間に2型コラーゲン等の細胞外基質を産生し、約20倍に肥大することにより長軸方向の成長に寄与しています。この成長板における軟骨細胞の増殖分化機構は、様々な因子の相互作用によって巧妙に制御されており、その異常は成長板の破綻をきたし、結果として骨の成長が阻害され、低身長や四肢の変形などの障害をきたします。遺伝性の骨格系統疾患の中には、成長板の異常を原因とするものが多数存在していますが、有効な治療薬の存在する疾患は皆無であり、治療薬の開発が望まれています。そのためには病態の理解が必須ですが、成長過程にある成長板の組織を採取することで更なる障害をきたす可能性があることから、これまでの研究は主として、遺伝子改変マウスモデルが主体でした。しかしヒトでは対立遺伝子のどちらかに変異があるだけで発症するのに対し、マウスでは変異がホモになり初めて病態が出現する場合があるなど、種間の相違があり、ヒト細胞を用いた研究の重要性が提唱されています。研究グループでは、これまでiPS細胞から未分化間葉系細胞を誘導し、そこから軟骨細胞または骨細胞を誘導し、いくつかの骨軟骨疾患の研究を行ってきましたが、成長板の疾患の解析で重要となる肥大軟骨細胞までの誘導法は確立していませんでした。そこで本研究では、まず肥大軟骨細胞の誘導法の樹立に取組み、その方法を用いて成長板疾患の病態再現から創薬に向けた基盤の構築を目指しました。
1. ヒトiPS細胞からの肥大軟骨細胞の誘導
研究グループでは、本研究の前に体節形成過程のin vitro 再現を目的として、iPS細胞から体節を誘導する誘導法を開発し、更に体節から軟骨分化能を有する硬節の誘導にも成功していました(CiRAニュース 2020年4月2日:Matsuda, et al. Nature 2020)。そこから更に肥大軟骨細胞を誘導するために、これまで肥大軟骨細胞分化作用を有することが報告されているT3を3次元軟骨塊誘導法に追加して、その効果を検討しました (Fig.1A)。
その結果T3を14日目より添加することで誘導28日目に、細胞塊の外周領域に肥大軟骨細胞様の細胞が出現し、56日目には細胞塊全体に細胞外基質に取り囲まれた肥大軟骨細胞様の細胞が存在していました (Fig.1B)。経時的に遺伝子発現を解析した結果では、肥大軟骨細胞特異的遺伝子であるCOL10A1 の発現が42日目より顕著に亢進しており、同時期にMMP13 等、
その他の関連遺伝子も亢進しており、肥大軟骨細胞が誘導されたことを示唆する結果が得られました (Fig.2)。
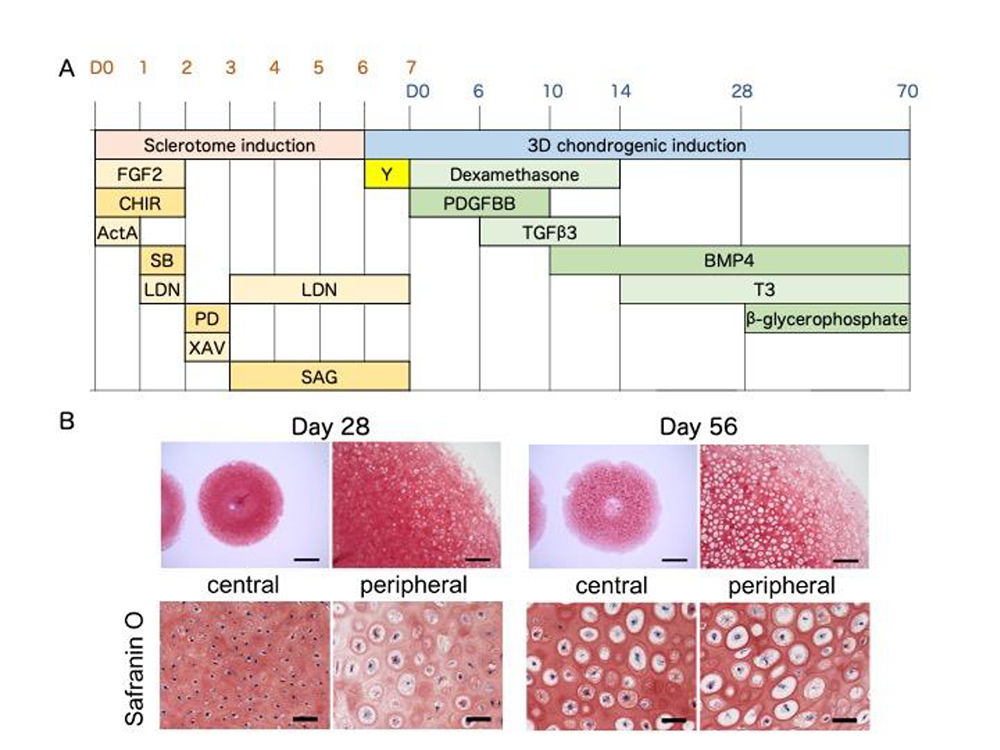
Fig.1. A, 分化誘導プロトコル
B, 軟骨分化誘導後28日目及び56日目の組織のサフラニンO染色像
Fig.1. A, 分化誘導プロトコル
B, 軟骨分化誘導後28日目及び56日目の
組織のサフラニンO染色像
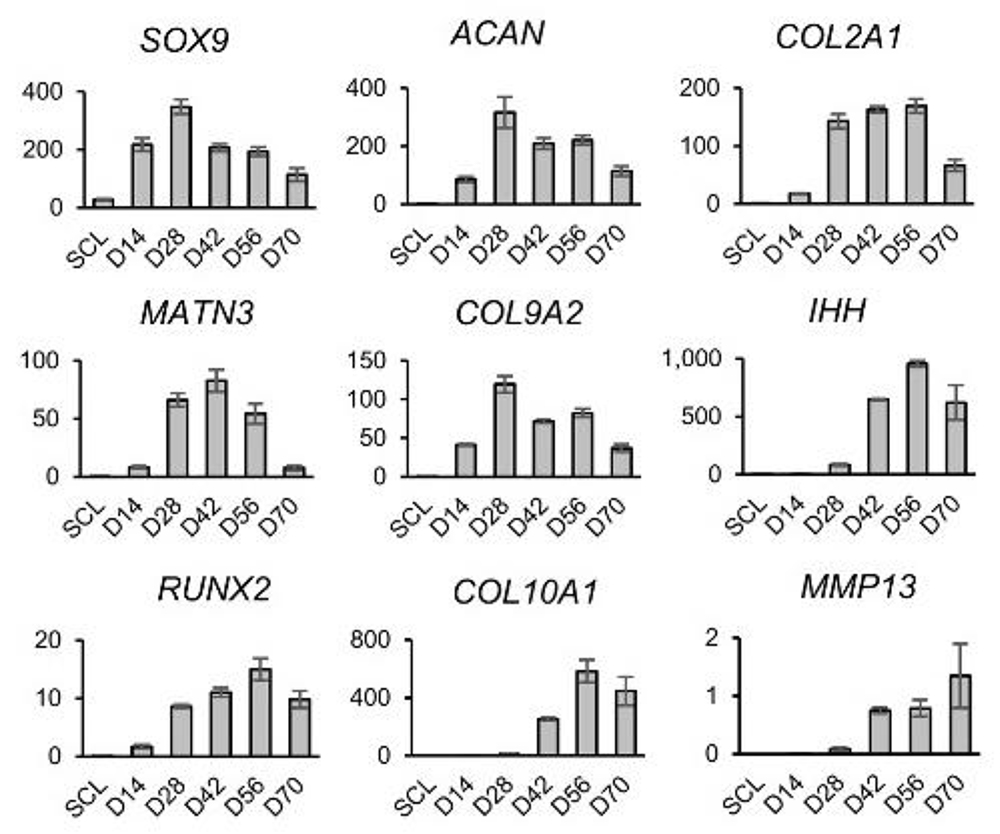
Fig.2. 軟骨分化誘導過程における関連遺伝子の発現遷移
2. 疾患特異的iPS細胞を用いたin vitro 病態再現
次に成長板疾患への応用を検討するために、MEDとMCDSの患者さんからiPS細胞を樹立し、それぞれの原因遺伝子であるMATN3 及びCOL10A1 遺伝子の変異を修復した対照iPS細胞(isogenic control)を作製しました。
更に標準的iPS細胞に既報の変異を導入した人工疾患iPS細胞も作製して分化誘導実験を行いました。その結果、それぞれの疾患において変異遺伝子によって産生された異常タンパク質が小胞体に蓄積して、細胞外への分泌が減少していることが免疫染色で判明しました (Fig.3)。
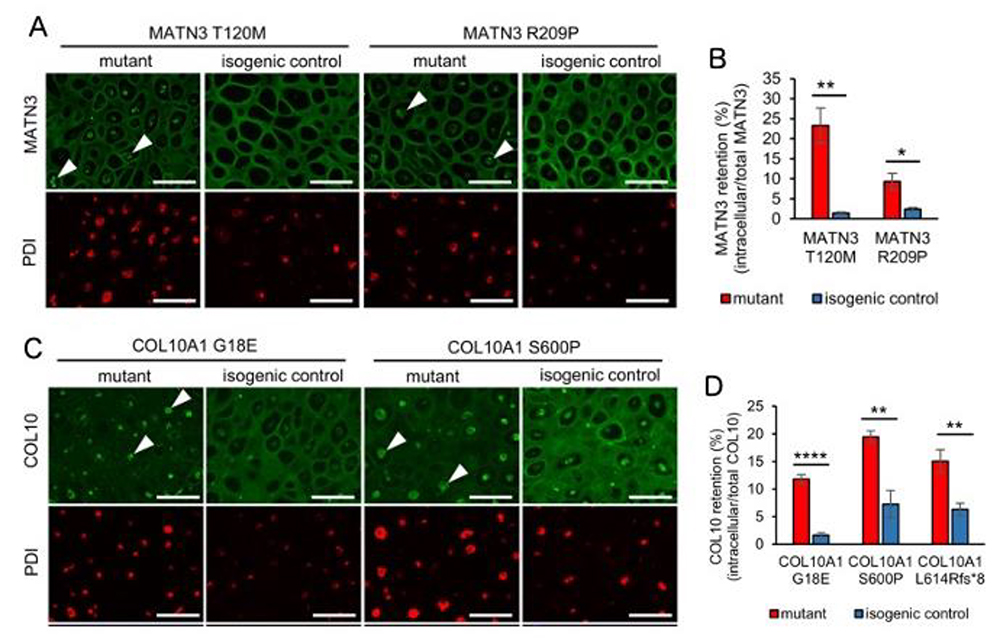
Fig.3. A, MATN3 変異株におけるMATN3の局在
PDIは小胞体の場所を示すマーカー。
B, 細胞内MATN3の割合
C, COL10A1 変異株におけるCOL10の局在
D, 細胞内COL10の割合
また小胞体ストレスに関連したシグナルとその下流の遺伝子の発現を解析したところ、細胞株によって程度は異なりますが亢進しているものがあり (Fig. 4A)、これまでモデルマウスで報告されていた変異タンパク質による小胞体ストレスの発生という病態を、患者さん由来の細胞で再現することができました。しかし網羅的遺伝子発現による解析では、それぞれの原因遺伝子、更に原因遺伝子の変異型によって誘導される小胞体ストレス関連シグナル経路は、大きく異なる結果が得られ、個々の病態の解析が必要であることが示唆されました (Fig. 4B)
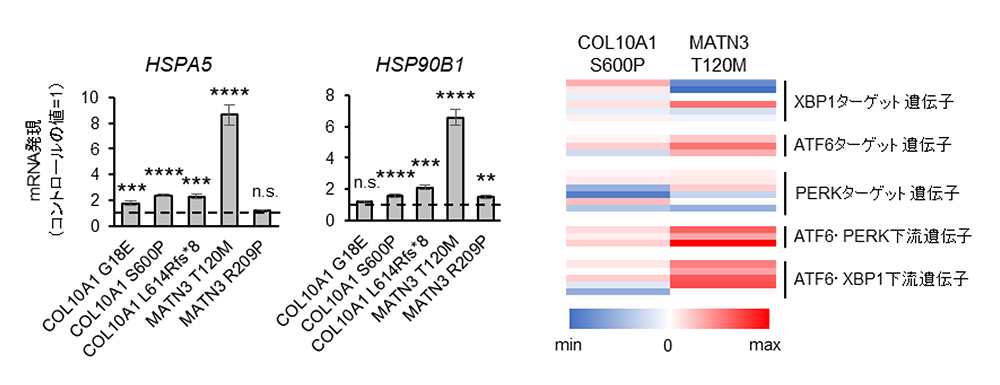
Fig.4. A, 対照細胞での発現と比較した小胞体ストレスマーカーの発現比率
B, 各変異株で誘導された小胞体ストレス関連シグナル経路の発現レベルの比較
Fig.4. A, 対照細胞での発現と比較した小胞体ストレス
マーカーの発現比率
B, 各変異株で誘導された小胞体ストレス関連
シグナル経路の発現レベルの比較
3. 硬節細胞の移植による成長板様組織の形成
硬節まで誘導した細胞を免疫不全マウスの皮下へ移植し56日後に採取した組織を解析しました。対照細胞を移植した組織(isogenic control)では、成長板における層状かつ柱状の構造に類似した組織が形成されていましたが、MATN3 変異細胞を移植したもの(MATN3 T120M mutant)では、そのような構造が乱れており、全体に肥大軟骨細胞が存在していました。
一方、COL10A1変異細胞(COL10A1 G18E mutant)では、同様に層状及び柱状構造が乱れており、肥大軟骨細胞は数が少ない傾向にあり、これらの結果は部分的ではありますが、モデルマウスで観察された異常に類似したものでした (Fig.5)。
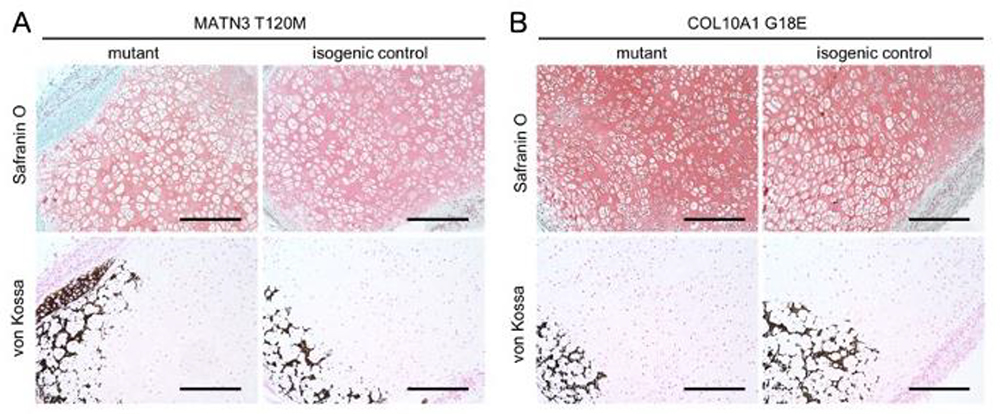
Fig.5. A, MATN3 変異細胞由来組織のサフラニンO及びvon Kossa染色
B, COL10A1変異細胞由来組織のサフラニンO及びvon Kossa染色.
Fig.5. A, MATN3 変異細胞由来組織のサフラニンO
及びvon Kossa染色
B, COL10A1変異細胞由来組織のサフラニンO
及びvon Kossa染色.
4. 治療薬候補を用いたアッセイ系としての検証
確立した分化誘導系が、治療薬探索のための基盤として有用であるかを検証するために、小胞体ストレスを軽減することが知られている、オートファジー誘導剤12)や化学シャペロン等を用いてMATN3 変異株に対する治療実験を行いました。その結果、化学シャペロンであるTMAO13)によって、変異MATN3の小胞体への蓄積が減少し、
小胞体ストレスマーカーの発現も低下することがわかり、分化誘導系の有用性を示唆する結果が得られました (Fig.6)。
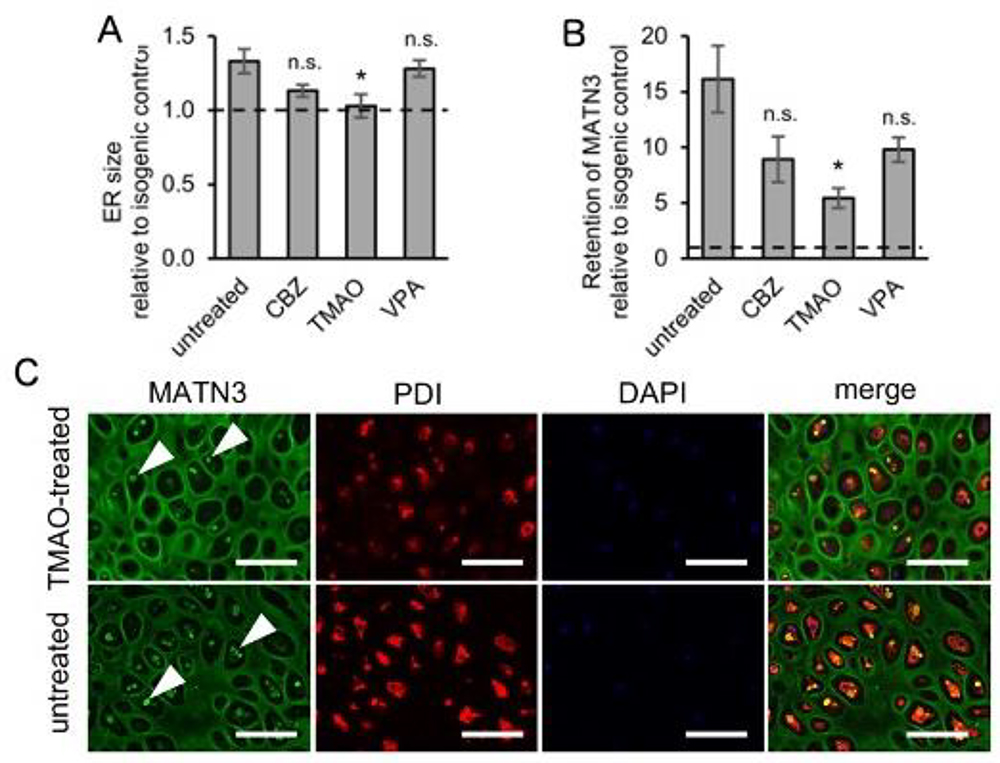
Fig.6. 対照細胞と比較したMATN3 変異株の(A)小胞体のサイズ及び(B)細胞内のMATN3蓄積量
C,TMAO処理及び未処理細胞でのMATN3及び小胞体(PDI)染色.
Fig.6. 対照細胞と比較したMATN3 変異株の(A)
小胞体のサイズ及び(B)細胞内のMATN3蓄積量
C,TMAO処理及び未処理細胞でのMATN3
及び小胞体(PDI)染色.
本研究では、iPS細胞から肥大軟骨細胞までの分化誘導法を確立し、成長板疾患の病態解析及び創薬の基盤として有用な方法であることを示しました。また、増殖細胞から肥大軟骨細胞への分化過程をin vitro で解析することが可能であるため、正常成長板における増殖分化機構の解析のための新たなツールとしても有用であり、今後の応用が期待されます。
- 論文名
Differentiation of hypertrophic chondrocytes from human iPSCs for the in vitro modeling of chondrodysplasias - ジャーナル名
Stem Cell Reports - 著者
Yann Pretemer1*, Shunsuke Kawai1,2,3, Sanae Nagata1, Megumi Nishio2, Makoto Watanabe1,4, Sakura Tamaki2,5, Cantas Alev1,6, Yoshihiro Yamanaka1,6, Jing-Yi Xue7, Zheng Wang7,8, Kenichi Fukiage9,10, Masako Tsukanaka9, Tohru Futami9, Shiro Ikegawa7, Junya Toguchida1,2,3,5**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学ウイルス・再生医科学研究所
- 京都大学大学院医学研究科整形外科
- 島津製作所基盤技術研究所ライフサイエンス研究所
- 京都大学医学部附属病院臨床研究総合センター
- 京都大学高等研究院ヒト生物学高等研究拠点
- 理化学研究所生命医科学研究センター
- Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & Peking Union Medical College
- 滋賀県立小児保健医療センター整形外科
- ホバース記念病院整形外科
本研究は、下記機関より資金的支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
- 「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
- 「疾患・組織別実用化研究拠点 拠点B」
(注1)体節
未分節中胚葉から発生する細胞群であり、硬節(sclerotome)、皮節(dermatome)及び筋節(myotome)に分化する。
(注2)硬節
体節から分化する細胞群であり、椎骨などを生じる。
(注3)成長板
骨端と骨幹端の間にある軟骨組織であり、そこでの軟骨細胞の増殖と分化によって骨が伸長する。
(注4)小胞体
タンパク質合成と輸送を担う細胞小器官。
(注5)化学シャペロン
タンパク質の折り畳みを補助する小分子。
(注6)トリヨードサイロニン(T3)
甲状腺ホルモンの一つであり、軟骨の肥大化を促進することが報告されている。
(注7)多発性骨端異形成症(MED)
MATN3、COMP、COL9A1、COL9A2、COL9A3 の変異によって引き起こされる成長板疾患。少年期以降に診断されることが多く、骨端の異常・外反膝・早期関節炎などが見られる。
(注8)シュミット型骨幹端軟骨異形成症(MCDS)
COL10A1の変異によって引き起こされる成長板疾患。幼少期から発症することが多く、骨幹端の異常・低身長・四肢の短縮・内反膝など特徴的な骨異常が見られる。
(注9)MATN3
増殖軟骨細胞が産生する非コラーゲン性細胞外基質。コラーゲンと細胞との間でのネットワークを形成する。
(注10)COL10A1 及びCOL10
肥大軟骨細胞が産生する短鎖コラーゲンタンパク質。COL10A1 遺伝子から産生されるペプチドが三重鎖を形成しCOL10タンパク質となる。
(注11)小胞体ストレス
異常な折り畳みのタンパク質が小胞体に蓄積する時に起こる細胞ストレス。
(注12)オートファジー
細胞がタンパク質と細胞小器官を分解する機構。
(注13)トリメチルアミン-N-オキシド(TMAO)
化学シャペロンの作用を持つ代謝中間物。






















