
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2022年4月15日
均一な膵島様細胞凝集塊の大規模生産のためのマイクロウェルバッグ培養
ポイント
- 閉鎖系で均一なサイズの細胞凝集塊(クラスター)を大量に作製できる新たな細胞培養容器として、マイクロウェル培養バックとそのホルダーを開発した。
- ヒトiPS細胞から作製した膵島様細胞(iPIC)を用いて、臨床で必要とされている大量(6.5×105個)の均一なサイズのiPICクラスターを、1枚の培養バッグで一度に得られることを示した。
- この培養バッグを用いたクラスター製造方法は、拡張性、無菌性、および操作性が向上しており、臨床および研究用途の両方で役立つと考えられる。
ブリットル型1型糖尿病注1)の治療法としては、膵島移植が有力な選択肢です。患者さん1人への1回の膵島移植には105-106個の膵島(内分泌細胞のクラスター)が必要と考えられています。しかしながら、ドナー不足に加えて膵島サイズやドナー間における品質の不均一性がこの治療法普及の妨げの原因の一つとなっています。均一なサイズのクラスターを作製することは、従来型のマイクロウェルプレートを用いても可能ですが、臨床に向けた製造施設での使用には不向きな点がいくつもありました。
末永亮 主任研究員(東洋製罐グループホールディングス株式会社 綜合研究所)、小長谷周平 研究員(CiRA増殖分化機構研究部門、T-CiRA、現 オリヅルセラピューティクス株式会社)および豊田太郎 講師(CiRA増殖分化機構研究部門、T-CiRA、現 CiRA未来生命科学開拓部門)らの研究グループは、均一な細胞クラスターを大規模(105-106クラスター)に作製するための新しいバッグ培養法の開発を目指しました。下面にマイクロウェルを備えた小スケール培養バッグ(<105クラスター)を作製し、未分化iPS細胞やiPS細胞由来膵島細胞(iPIC)を用いて、取り扱いに適したホルダーや必要な培養要素を決定しました。また、現行の膵島移植に求められている規模にウェル数を増やした大スケール培養バッグを作製し、6.5×105個の均一なiPICクラスターの作製に成功しました。本作製法では細胞播種前の脱気プロセスと培養終了後の回収プロセスを簡素化することができました。本研究で開発した培養バッグを用いた細胞クラスター作製法は、拡張性、無菌性および操作性のいずれの観点からも臨床および研究両方の用途に役立つことが期待されます。
この研究成果は、2022年3月25日(英国時間)に英国科学誌「Scientific Reports」にオンライン公開されました。
膵島移植は、β細胞の破壊とそれに続くインスリン不足によって引き起こされるI型糖尿病、中でも血糖コントロールが困難なブリットル型の治療に有望な方法です。一般に、105-106個の膵島(内分泌細胞の細胞クラスター)が1人の患者の治療に使用されますが、ドナーの不足が問題となっています。また、ドナー間の品質の不均一性や、ドナーから採取された膵島はサイズが不均一であるという課題もあります。最近の研究から、生体から単離された膵島を単一の細胞に分離し、マイクロウェルプレートを使用して再凝集することでサイズを均一にした膵島は、品質管理の観点だけでなく有効性においても再凝集していない膵島より優れていることが分かっています。さらに、多能性幹細胞(ES細胞、iPS細胞)から作製された膵島であっても、細胞クラスターのサイズが有効性に影響を及ぼすことや、再凝集という操作そのものの利点が報告されています。
マイクロウェルプレートは、均一なサイズのクラスターを作製するために開発されました。しかし、一度に生成できるクラスターの数は一般に103-104個であり、膵島移植の臨床用としては不十分です。また、マイクロウェルプレートの取り扱いには細胞培養技術の習熟が必要です。さらに、細胞の播種と採取は開放系注2)で行われるため、細胞製造時の無菌環境の管理が容易ではなく、汚染のリスクが高いと考えられます。
本研究では、閉鎖系注2)で細胞クラスターを大量生産するために、新たな培養バッグとそのホルダーを開発しました。ヒトiPS細胞を用いて、無菌性、再現性、操作性を向上し、臨床利用の要件を満たした上で、均一なサイズのクラスターを多数生成する培養法を検討しました。また、iPS細胞由来の膵島細胞(iPIC)を使用して、閉鎖系で6.5×105個の細胞クラスターを作製するマイクロウェルバッグ培養の実現可能性を検証しました。
1)マイクロウェル培養バッグのデザイン
新しい細胞培養容器として設計したマイクロウェル培養バッグは、上下面2枚のガス透過性フィルムと培養液を出し入れするためのポートから構成されています(図1A)。条件検討用の小スケール培養バッグの下面フィルム50 ㎠の領域に対し1.8×104のマイクロウェルを熱成形しました。また、培養バッグの操作性を向上させるためのホルダーを設計しました(図1B)。ホルダーに備えた押圧板がバッグの上面を押さえることで、培養バッグを持ち運ぶ際の培養液の動きが抑えられ、クラスターが他のウェルへ移動することが抑制されます。一般に、マイクロウェルを含む容器に培地を満たそうとしても、ほとんどのマイクロウェルには空気がトラップされるため培地で満たされません。この空気はウェル径が小さい程、除去に労力が必要でした。一方、新たに開発したマイクロウェル培養バッグでは、培地を入れた後、ホルダーに取り付けた状態で一晩静置するだけでマイクロウェル内の空気を除去することができました(図1C)。また、培養バッグを逆さにするだけで全てのウェルからクラスターを浮き上がらせることができるため、その後にポートを下向きに内部の液を回収するだけで全てのクラスターを回収することができました。

図1 条件検討用の小スケールのマイクロウェル培養バッグとホルダー
(A)小スケールのマイクロウェル培養バッグの外観(左)、平面(右上)および断面(右下)の撮影像。
(B)培養バッグのホルダー。
(C)培養バッグを培地で満たした際に生じるマイクロウェル内部の気泡が、経時的に消失していく様子。
2)マイクロウェル培養バッグを使ったiPICの再凝集
次に、ヒト膵島への本培養バッグの適用性を検討するため、凍結保存したiPICを解凍し、マイクロウェル培養バッグまたはバイオリアクターに播種して4日間培養しました。回収したiPICクラスターの形状を観察すると、培養バッグでは丸く均質だったのに対し、バイオリアクターでは粗いものが多く、またバイオリアクターの撹拌速度が大きくなると巨大クラスターが現れました(図2A)。巨大化したクラスター(直径300 μmをしきい値)を除いてクラスターのサイズの分布を比較したところ、培養バッグの均一性(CV = 7.1)に対し、バイオリアクターでは、撹拌速度が上がるにつれて小さいサイズとなって分布が広がる傾向でした(図2B)。なお、バッグ内で4日間培養した後のiPICは、約96%が膵臓内分泌細胞マーカー陽性、約36%が膵臓β細胞マーカー陽性で、Ki67陽性の増殖細胞はほとんどありませんでした(図2C)。
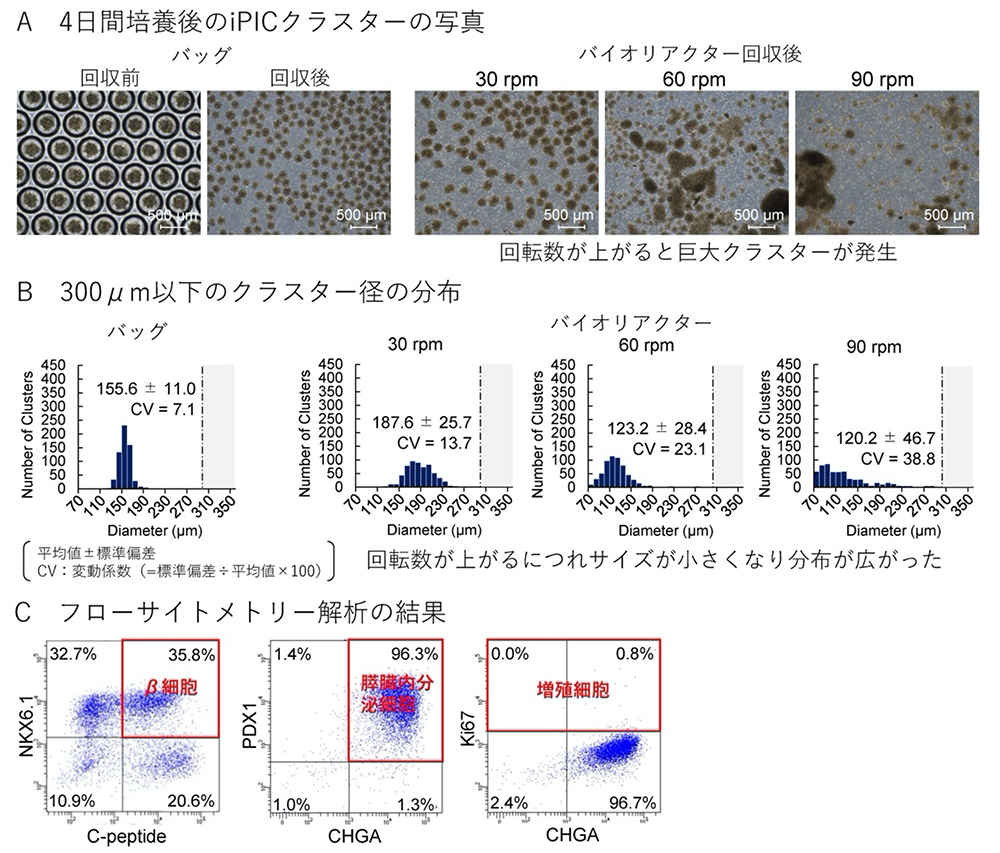
図2 小スケールのマイクロウェル培養バッグによるiPICの再凝集
小スケールのマイクロウェル培養バッグあるいはバイオリアクターによってiPICを再凝集させ4日間培養した。
(A)iPICの外観。
(B)直径300 μm以下のクラスター径の分布。
(C)小スケールのマイクロウェル培養バッグから回収したiPICのフローサイトメトリー解析。膵β細胞(NKX6.1+C-peptide+)、膵内分泌細胞(PDX1+CHGA+)および増殖細胞(Ki67+)のマーカーを発現する細胞の割合を測定した。
3)均一なiPICクラスターの大規模生産
1枚のバッグから膵島移植に必要な105-106個のクラスターを取得するために、1000 ㎠の領域に6.5×105のマイクロウェルを備えた大スケール培養バッグと対応するホルダーを設計しました(図3A)。
これを用いてiPICを4日間培養したところ、小スケール培養バッグで作製した場合と同様に、均一なサイズのiPICクラスターが形成されました(CV = 5.7; 図3B)。また、回収したiPICは小スケール培養バッグの実験と同様の細胞組成を示しました(図3C)。
なお、この大量の細胞塊の回収はバッグを吊り下げて実施しました。注目すべきことに、移植に適さない大きなクラスターと培養バッグ内部に残っているクラスターを除外した上で、1回の回収操作によって培養細胞総数の99%以上を回収することができました(図3D)。
これらの結果は、バッグ培養によって105-106個の細胞クラスターを取り扱うことの実現可能性を示しています。
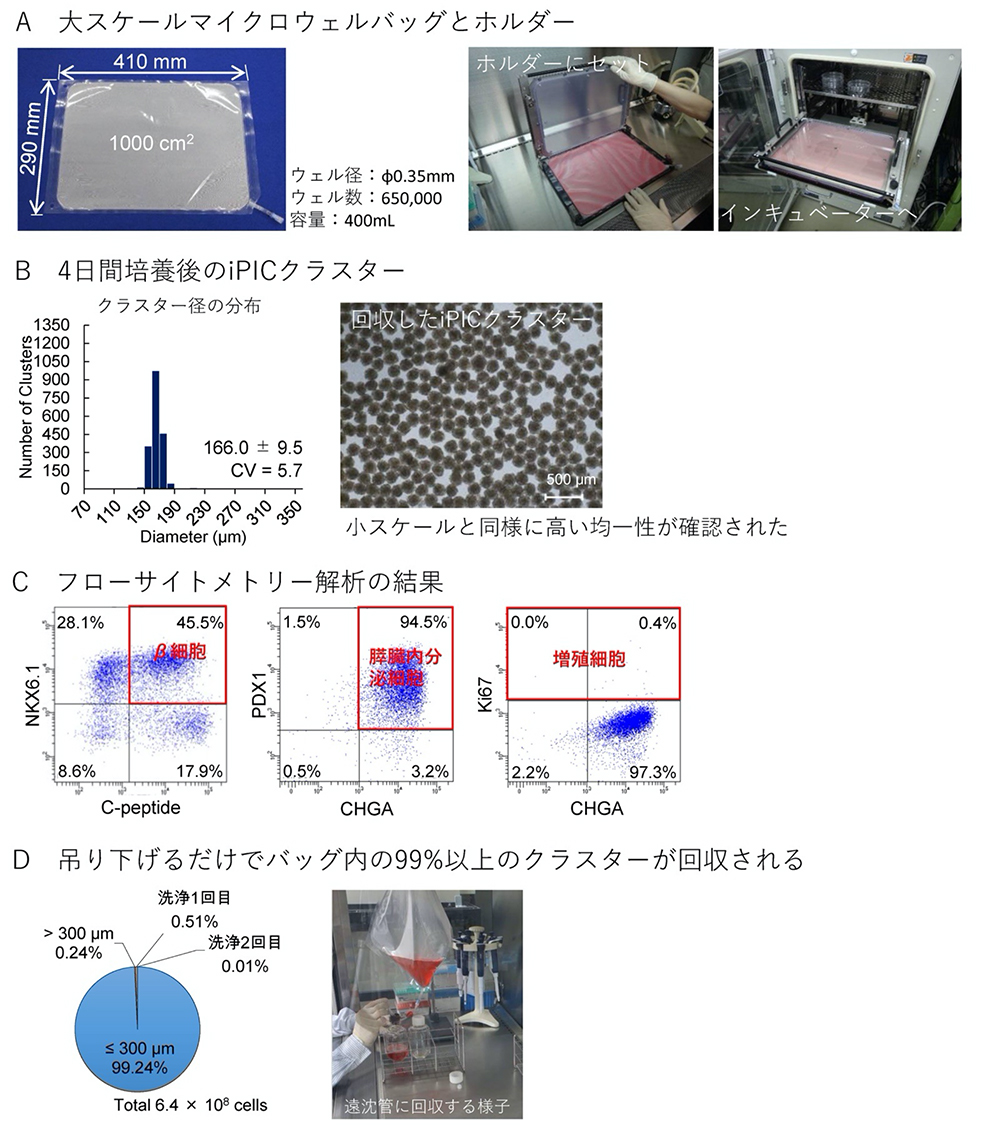
図3 大スケールのマイクロウェル培養バッグによるiPICの再凝集
大スケールのマイクロウェル培養バッグによってiPICを再凝集させ4日間培養した。
(A)大スケールのマイクロウェル培養バッグの外観(左)、専用のホルダーへ(中)およびインキュベーターへ(右)の設置の様子。
(B)回収したiPICクラスター径の分布。
(C)回収したiPICのフローサイトメトリー解析。膵β細胞(NKX6.1+C-peptide+)、膵内分泌細胞(PDX1+CHGA+)および増殖細胞(Ki67+)のマーカーを発現する細胞の割合を測定した。
(D)吊り下げによる1回の回収操作だけで、培養バッグ内の99%以上のクラスターが回収された。2回の洗浄操作によってバッグ内に残留した細胞を回収し、1度目の回収操作と比較した(左)。吊り下げによる回収操作の様子(右)。
本研究では、現行の膵島移植で取り扱う個数をまかなう大規模な細胞凝集塊(クラスター)を、均一に作製することができるマイクロウェルバッグ培養法を開発しました(図4)。そして、iPS細胞由来の膵島細胞(iPIC)を用いて、6.5×105個の細胞クラスターを簡便な操作で作製できることを示しました。この方法は、閉鎖系に対応可能で、取り扱いも簡便であることから、再生医療用の細胞製造や基礎研究で役立つことが期待されます。
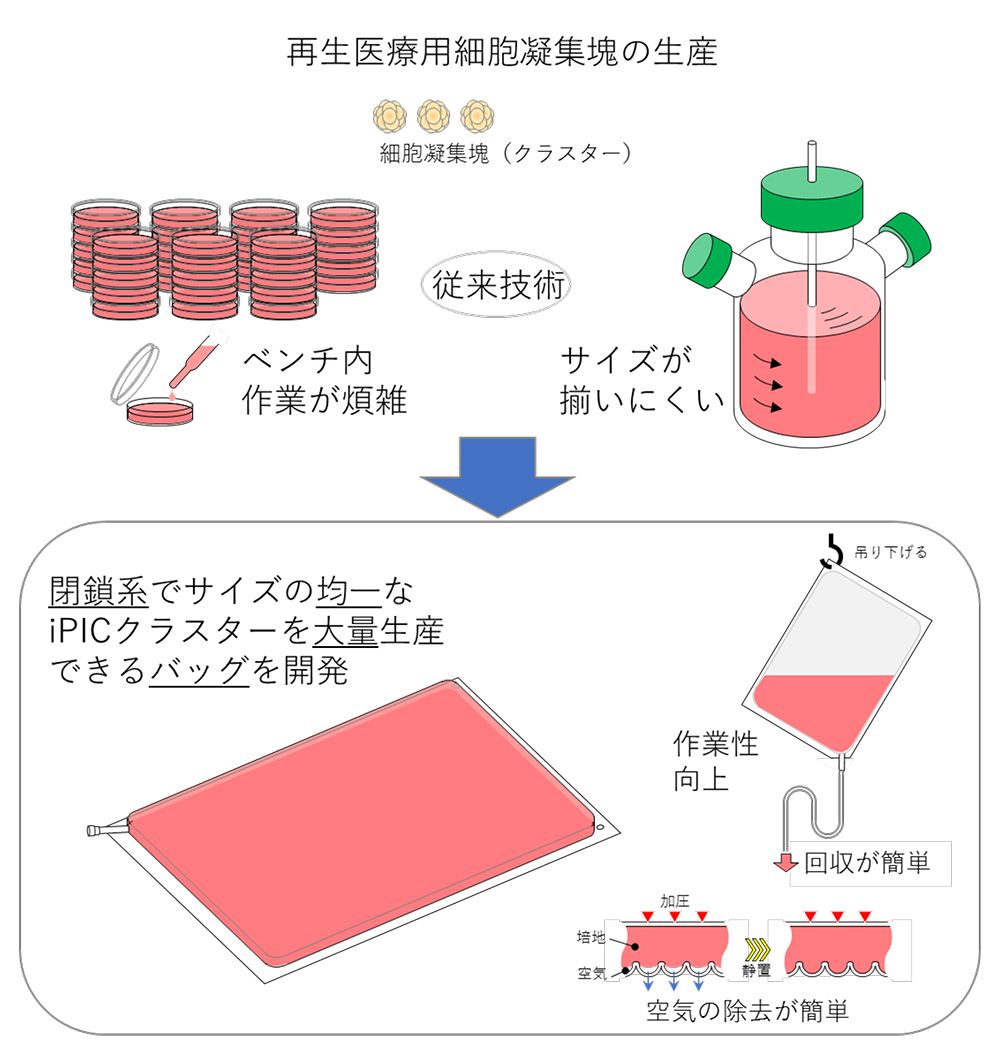
図4 本研究の概要図
- 論文名
Microwell bag culture for large-scale production of homogeneous islet-like clusters - ジャーナル名
Scientific Reports - 著者
Ryo Suenaga1*, Shuhei Konagaya2, Junji Yamaura3,5, Ryo Ito2, Satoshi Tanaka1, Yoichi Ishizaki1,
and Taro Toyoda4,5*
*責任著者 - 著者の所属機関
- 東洋製罐グループホールディングス株式会社
- オリヅルセラピューティクス株式会社
- 武田薬品工業株式会社
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA 共同研究プログラム(T-CiRA)
本研究は、CiRAと武田薬品工業株式会社との共同研究プログラム「T-CiRA」によるものです。
また、下記の支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療シーズ開発加速支援) - iPS細胞研究基金
注1) ブリットル型1型糖尿病
1型糖尿病のなかでも、高血糖と低血糖がくり返しおきるような、血糖が不安定なタイプの1型糖尿病。
注2) 開放系・閉鎖系
細胞を培養している容器内と容器外で、菌や微生物などが行き来する経路を持たないものを閉鎖系といい、そうではないものを開放系という。閉鎖系培養では、開放系培養に比べてコンタミネーション(細胞混入・汚染)のリスクを低減できる。シャーレやフラスコなどの開放系容器の場合、培養操作で蓋の開閉が必要となるため、製造環境及び培養環境を閉鎖系にする必要がある。培養バッグによる培養の場合、培養系への原材料の出入りや細胞加工物の回収を含む一連の培養工程を、無菌的接続手段を介して実施することで容易に閉鎖系にできる。






















