
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2023年1月11日
患者由来iPS細胞を用いた筋強直性ジストロフィー骨格筋病態の再現と薬効評価のための定量的な細胞評価系の確立
ポイント
- 筋強直性ジストロフィー1型(DM1)の患者さん由来のiPS細胞を、2種類の方法(直接的あるいは骨格筋幹細胞を経由)で骨格筋細胞へと分化させ、病態の再現をおこなった。
- MyoD1強制発現注1)により直接的に分化させた方法では、DM1骨格筋の病態のうち、細胞核内のMBNL1タンパク質凝集の増加と代表的な遺伝子のスプライシング注2)異常が再現された。
- 骨格筋幹細胞注3)を経由させた方法では、筋力を発揮するために重要な役割を果たすSERCA1遺伝子のスプライシング異常が再現された。
川田竜 元共同研究員(当時:CiRA臨床応用研究部門、現:大正製薬株式会社Discovery研究所)、櫻井英俊 准教授(CiRA臨床応用研究部門)らの研究グループは、DM1患者さん由来のiPS細胞から作製した骨格筋細胞を用いて、DM1の主要な病態である細胞核内におけるMBNL1タンパク質の凝集および遺伝子スプライシング異常を再現し、定量的な薬効評価の可能なDM1のヒト細胞病態モデルを構築することに成功しました。
今回新たに構築したヒトiPS細胞評価系を活用することで、DM1治療薬の探索や開発などの創薬研究に貢献することが期待されます。
この研究成果は2023年1月11日10時(英国時間)に英国科学誌「Scientific Reports」にオンライン公開されました。
DM1は成人において最も頻度の高い筋ジストロフィーとされていますが、根本的な治療薬は存在していません。治療薬の探索、開発を行うためには、DM1患者さんで認められる病態を再現したヒト細胞評価系の開発が求められています。
DM1は、常染色体優性遺伝形式をとる遺伝性疾患であり、DMPK(dystrophia myotonica-protein kinase)遺伝子のCTG繰り返し配列が異常に伸長することが原因とされています。変異したDMPK遺伝子から産生される異常RNAは、遺伝子スプライシング機能を担うタンパク質MBNL1 (muscleblind like splicing regulator 1)に結合することで、細胞核内で凝集体を形成します。その結果、MBNL1の正常な機能が阻害され、多くの遺伝子におけるスプライシング異常が生じることがDM1病態発症の主要な機序であるとされています。
そこで本研究グループは、DM1患者さん由来のiPS細胞から、DM1の骨格筋における病態を再現する骨格筋細胞の分化誘導方法を特定し、治療薬による病態改善効果を定量的に調べることのできるヒト細胞評価系を開発することを目指して研究を行いました。
1) MBNL1核内凝集評価系の構築
本研究グループは以前に、ヒトiPS細胞に骨格筋特異的転写因子MyoD1を強制発現させることで骨格筋細胞への分化誘導を行う方法を開発しました(リンク:CiRAニュース 2013年4月24日「効率よく、再現性高くヒトiPS細胞から筋肉細胞を作製 筋肉疾患の創薬プラットフォームの開発に向け」)。
そこで、DM1患者さんと健常人から作製したiPS細胞(リンク:CiRAニュース 2017年2月13日「患者さん由来iPS細胞を用いて、筋強直性ジストロフィーの病因である遺伝子変化を詳細に解析」)に対して、MyoD1を強制発現させることで骨格筋細胞を作製しました。その結果、10日間の培養によって分化したDM1患者さん由来の骨格筋細胞の核内において、MBNL1タンパク質が凝集することを確認しました(図1A上部:パラホルムアルデヒド)。また、細胞の状態を固定する方法を検討し、アセトン-メタノールを用いた固定法注4)を用いることで、凝集したMBNL1タンパク質のみを特異的に検出し、画像解析によるMBNL1凝集数の定量評価が可能となりました(図1A下部:アセトン-メタノール)。
本手法を用いることで、3名のDM1患者さん由来の骨格筋細胞において核あたりのMBNL1凝集数が増加することを確認し、定量的なMBNL1核内凝集評価系を構築することに成功しました(図1B)。
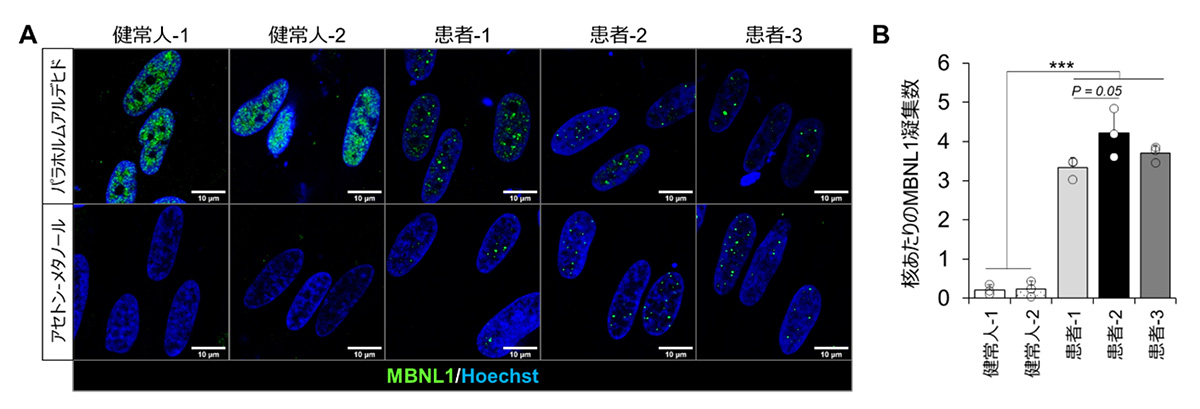
図1:DM1患者さん由来骨格筋細胞におけるMBNL1核内凝集の確認
A:免疫染色法を用いて確認した分化10日後のMBNL1タンパク質(緑)の分布。健常人由来の骨格筋細胞の核内でMBNL1が均一に広く分布しているのに対し、患者さん由来の骨格筋細胞においてはMBNL1が凝集し、点状に局在した分布を示した(パラホルムアルデヒド)。アセトン-メタノール固定法では凝集したMBNL1が特異的に検出されている。
B:Aのアセトンメタノール固定法を用いて検出されたMBNL1核内凝集数を定量したグラフ。
2) 遺伝子スプライシング異常評価系の構築
次に、DM1患者由来iPS細胞から誘導した骨格筋細胞において遺伝子のスプライシング異常が再現されるかを調べました。しかしながら、DM1患者さんでスプライシング異常が認められる代表的な遺伝子であるDMDおよびBIN1について、10日間の分化培養では骨格筋細胞の成熟度が低かったため、その異常を検出することが難しいことが分かりました。
そこで、培養方法を検討し、新たな分化誘導方法を開発しました(図2A)。新たに開発した培養方法を用いて分化した骨格筋細胞から、遺伝子を抽出および精製し、定量的リアルタイムPCR法注5)による遺伝子スプライシング評価を行いました。その結果、17日間の培養により分化したDM1患者さん由来の骨格筋細胞において、成人型遺伝子の指標であるDMD exon 78およびBIN1 exon 11挿入遺伝子の発現量が低く、遺伝子スプライシング異常が生じていることを確認しました(図2B)。これらの結果から、17日間の分化誘導方法により、遺伝子スプライシング異常の定量的な評価系を構築することに成功しました。
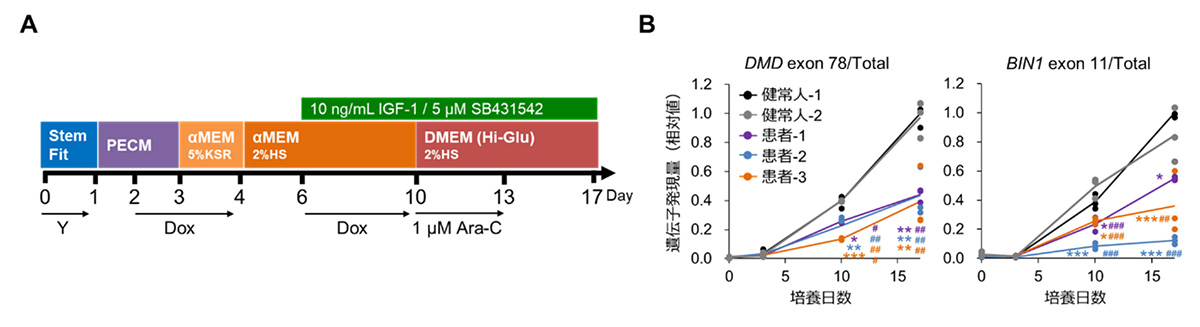
図2:DM1患者さん由来骨格筋細胞における遺伝子スプライシング異常の確認
A:新たに開発した17日間の分化培養方法。
B:定量的リアルタイムPCR法を用いて解析したDMD exon 78およびBIN1 exon 11の発現量。それぞれの総遺伝子量に対する発現量として示した。17日間の分化培養を行うことで、DM1患者さん由来の筋細胞におけるスプライシング異常が顕著に認められた。
3) アンチセンス核酸処置によるDM1病態改善の確認
続いて、MBNL1タンパク質核内凝集および遺伝子スプライシング異常を再現した評価系に対して、実験的にDM1への有効性が認められているアンチセンス核酸CAG25注6)を処置する薬効の評価試験を行いました。
その結果、DM1患者さん由来の骨格筋細胞において、アンチセンス核酸処置により、MBNL1核内凝集数が減少し(図3A)、遺伝子スプライシング異常が改善することを確認しました(図3B)。したがって、これらのDM1病態評価系を薬効評価に用いることの妥当性を確認することができました。
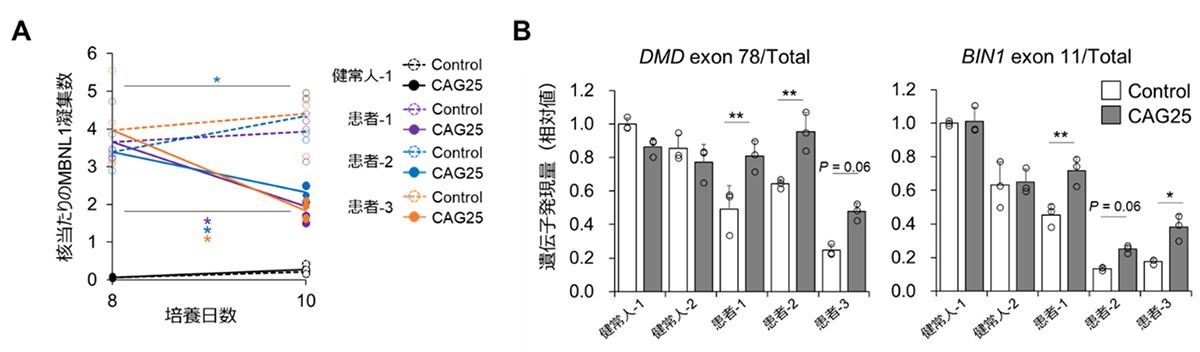
図3:アンチセンス核酸CAG25処置によるDM1病態改善の確認
A:MBNL1核内凝集におけるアンチセンス核酸処置の薬効評価結果。アンチセンス核酸を処置することでDM1患者さん由来の骨格筋細胞において認められるMBNL1核内凝集数が減少した。
B:遺伝子スプライシング異常におけるアンチセンス核酸処置の薬効評価結果。アンチセンス核酸を処置することで、DM1患者さん由来の骨格筋細胞におけるDMD exon 78およびBIN1 exon 11挿入遺伝子の発現が増加し、スプライシング異常が改善したことが分かる。
4) SERCA1遺伝子スプライシング異常評価系の構築
最後に、筋力を発揮するために重要な役割を果たす細胞内カルシウム制御分子SERCA1(遺伝子名:ATP2A1)遺伝子のスプライシング異常が再現されるかを調べました。しかし、MyoD1を強制発現する分化誘導法では、骨格筋細胞の成熟度が低く、病態を再現することができませんでした。
そこで、以前に本研究グループが開発した、遺伝子導入を行わない分化誘導方法でヒトiPS細胞から骨格筋幹細胞を誘導し、より成熟した骨格筋細胞を作製する検討を行いました(リンク:CiRAニュース 2022年5月30日「遺伝子操作を加えずヒトiPS細胞から成熟骨格筋細胞を作製する技術を発明」)。
骨格筋幹細胞から分化誘導した骨格筋細胞は、MyoD1を強制発現した骨格筋細胞に比較して成熟度が高く、DM1患者さん由来の骨格筋細胞においてSERCA1遺伝子のスプライシング異常を検出することに成功しました。また、アンチセンス核酸CAG25処置により、スプライシング異常が改善したことから(図4)、SERCA1遺伝子のスプライシング異常を指標とした薬効評価系を構築することに成功しました。
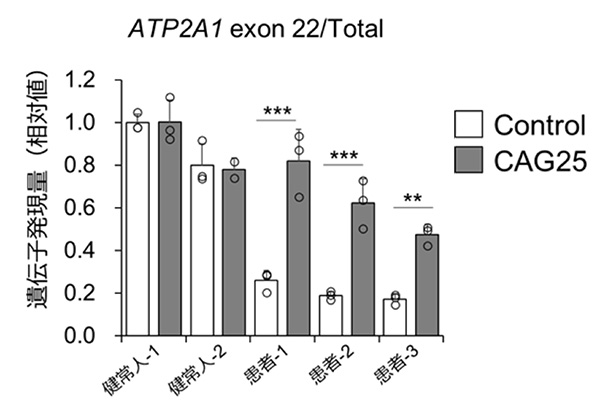
図4:アンチセンス核酸CAG25処置によるSERCA1遺伝子スプライシング異常改善の確認
SERCA1遺伝子(ATP2A1)スプライシング異常評価におけるアンチセンス核酸処置の薬効評価結果。アンチセンス核酸を処置することで、DM1患者さん由来の骨格筋細胞におけるATP2A1 exon 22挿入遺伝子の発現が増加し、スプライシング異常が改善したことが分かる。
本研究では、DM1患者さん由来のiPS細胞から骨格筋細胞の分化誘導方法を検討することで、DM1患者さんの骨格筋において確認されるMBNL1タンパク質の核内凝集および遺伝子スプライシング異常の再現に成功し、ヒト細胞による定量的な評価系を構築しました。
短期間で評価可能なMyoD強制発現細胞による評価系はDM1の治療薬スクリーニングのための応用、成熟度が高く、筋力発現に重要なSERCA1遺伝子スプライシング異常の評価を可能にした骨格筋幹細胞を経由する評価系は、DM1治療薬の臨床における薬効予測精度向上のための応用がそれぞれ期待されます。
根本的な治療薬が存在しないDM1に対する新規治療薬の開発が切望されています。今回新たに構築したDM1患者さん由来のヒトiPS細胞評価系を用いることで、DM1に有効な治療薬の探索と開発に貢献することが期待されます。
- 論文名
Establishment of quantitative and consistent in vitro skeletal muscle pathological models of myotonic dystrophy type 1 using patient-derived iPSCs - ジャーナル名
Scientific Reports - 著者
Ryu Kawada1,2, Tatsuya Jonouchi1, Akihiro Kagita1, Masae Sato1, Akitsu Hotta1, Hidetoshi Sakurai1*
*責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)臨床応用研究部門
- 大正製薬株式会社 Discovery研究所
本研究は、下記機関より支援を受けて実施されました。
- 大正製薬株式会社
- 国立研究開発法人 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
注1)骨格筋特異的転写因子MyoD1の強制発現系
骨格筋特異的転写因子MyoD1をテトラサイクリン誘導性promoter下に導入したシステムを用い、抗生物質であるドキシサイクリンを添加することにより 強制的にMyoD1遺伝子を発現させるシステム。これにより、iPS細胞から約1週間で骨格筋細胞を作製することができる。
注2)遺伝子スプライシング
遺伝子からタンパク質が作られる過程で必要な反応。一般的な真核生物のDNAから転写されたmRNA前駆体には、イントロンと呼ばれる直接タンパク質のアミノ酸配列に関わらない領域がある。このイントロンを除き、残ったエクソンと呼ばれる領域からなるmRNAが作られる過程をスプライシングという。スプライシングを受けたmRNAの情報をもとにタンパク質が合成される。
注3)骨格筋幹細胞
骨格筋系の細胞へと分化することができる幹細胞。
注4)アセトン-メタノールを用いた固定法
有機溶媒であるアセトンとメタノールを等量混合した溶液を用いて、免疫染色実施前の細胞固定を行う方法。タンパク質の化学的架橋を伴うホルムアルデヒドとは異なり、脱水作用とタンパク質の凝固・沈殿作用により細胞の固定を行う。今回の検討においては、可溶性のMBNL1タンパク質は細胞外に漏出した一方で、異常RNAと結合、凝集した不溶性のMBNL1タンパク質が保持されることで免疫染色により検出された。
注5)定量的リアルタイムPCR法
ポリメラーゼ連鎖反応(PCR)を用いて、サンプルの中にある特定遺伝子量を定量的に調べる方法。標的とする遺伝子配列に特異的に結合する核酸物質および蛍光物質を用いることで、PCRによる遺伝子の増幅量をリアルタイムに検出する。迅速性と定量性に優れた遺伝子解析方法。
注6)CAG25
以前に他の研究グループが報告したアンチセンス核酸物質。DM1で認められる異常RNAにおける繰り返し塩基配列を標的とし、細胞および動物を用いた実験段階における有効性が確認されている(Science. 2009 Jul 17;325(5938):336-9.)。






















