
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2023年2月27日
サイクリン依存性キナーゼCDK8/19阻害はヒトiPS細胞からの膵島様細胞への分化誘導において重要な役割を果たす
ポイント
- ヒトiPS細胞から膵島様細胞を作製するために使用する試薬の遺伝毒性リスクを評価したところ、アクチビン受容体様キナーゼの阻害剤として知られるALK5阻害剤IIに突然変異を引き起す性質を持つ可能性が判明した。
- ALK5阻害剤IIの代替化合物の探索の中で、ALK5阻害剤IIのオフターゲット効果注1)として見出したCDK8/19注2)阻害活性が膵β細胞への分化を促進することを発見した。
- 代替化合物で作製した膵島様細胞では、移植前の性状やマウスへの移植後の薬理効果を含む性状が再現された。
- 本研究は、ヒト多能性幹細胞から膵島様細胞への分化メカニズムの解明に役立つとともに、細胞治療製品を作る際の原材料に対するリスク低減アプローチの一例になると期待される。
糖尿病の根本的な治療法として、ヒトiPS細胞やES細胞などのヒト多能性幹細胞から作製した膵島様細胞の移植が期待されています。膵島様細胞を製造するにあたって、製造工程で用いる培地成分等の最終製品への残存リスクは製造工程由来不純物の安全性評価によって適切に管理されます。しかしながら、リスクをもつ培地成分等に暴露されたことによって膵島様細胞の構成細胞が抱える潜在的な造腫瘍性注3)を予め適切に捉えて品質管理を行うのは非常に困難です。
佐久間健介 主任研究員(オリヅルセラピューティクス株式会社 膵島細胞治療事業部、元武田薬品工業株式会社T-CiRAディスカバリー)、豊田太郎 講師(CiRA未来生命科学開拓部門、元タケダ-CiRA共同研究プログラム(T-CiRA))らの研究グループは、ヒトiPS細胞から膵島様細胞(human iPSC-derived Pancreatic Islet Cell; iPIC)を作製する過程で使用する分化誘導因子の安全性リスク評価を行い、分化誘導因子の1つである、ALK5阻害剤IIが突然変異を引き起す性質(変異原性)をもつ可能性を明らかにしました。
また、変異原性をもつALK5阻害剤IIを置き換えるための解析の過程で、サイクリン依存性キナーゼCDK8/19の阻害作用がALK5阻害剤IIにあることを発見しました。そして、このCDK8/19阻害作用が膵β細胞への分化に重要な役割を果たしていることを見出しました。また、CDK8/19阻害剤を取り入れた独自の誘導法を確立することでリスクを低減したiPICを作製することに成功しました。
これらの知見は、ヒト多能性幹細胞から膵島様細胞への分化メカニズムの解明に役立つとともに、細胞治療製品を作る際の原材料に対するリスク軽減アプローチの一例になると期待されます。
この研究成果は2023年1月5日(英国時間)に英国科学誌「Stem Cell Research & Therapy」でオンライン公開されました。
1型糖尿病は自己免疫疾患であり、膵臓β細胞の破壊とインスリン注4)分泌の減少を特徴とし、高血糖や様々な合併症を引き起こします。その標準的な治療法は、インスリンを投与することです。しかしながら、重症例では適切なインスリン治療にもかかわらず、不安定な血糖コントロールや低血糖に苦しむことがあります。Brittle型と呼ばれるこのような重症1型糖尿病の患者さんには膵臓または膵島移植が検討されていますが、臓器提供に依存するため移植を希望される患者さんの数に対してドナー数が絶対的に不足しているのが現状です。そのため、細胞供給源の一つとして、ヒト多能性幹細胞から作製した膵島の利用が強く期待されています。
多能性幹細胞由来の膵島は、多くの場合、ヒト膵島の発生過程を模倣して化合物や成長因子などを多段階的に細胞に作用させることで作製されます。分化誘導に使用されるこうした化合物のなかには、変異原性があり人体への投与に適切とはいえないものがあります。細胞治療において細胞の処理に使われる化合物は直接体内に投与されるわけではありませんが、処理を受けた細胞は体内に移植されたあと数年から生涯にわたって生存し、その効果の発揮を期待されるものが多くあります。このため、細胞の処理に用いられる化合物も可能なかぎり安全性の高いものを使用したほうが良いと考えられます。しかしながら、膵島様細胞の作製方法は多数報告されていますが、細胞の処理に用いられる化合物の変異原性の評価はこれまでに報告がありませんでした。
そこで本研究では、ヒトiPS細胞由来の膵島様細胞(iPIC)の作製で使用される化合物の変異原性を評価し、変異原性をもつことが疑われる化合物があった場合は別の化合物への置き換えを検討しリスクを軽減することを目的としました。
1)ALK5阻害剤IIに平面的な構造に起因する変異原性リスクがある
ヒトiPS細胞から膵島様細胞(iPIC)を作製する過程には多種類の化合物が使用されています。そのなかから、アミノ酸や糖とは異なり、生体内に存在しない14種類の低分子化合物に対して変異原性を検討しました。具体的には、医薬品中の不純物に関するガイドラインICH M7注5)の推奨を参考に、まず(定量的)構造活性相関((Q)SAR)注6)という化学構造に基づいた解析手法を用いてコンピューター(in silico)で変異原性を予測しました。DEREKとCASE Ultraという相補的な2種類の解析の結果、5種類の化合物が変異原性を示す可能性があることが分かりました(図1A)。
続いて、上記の5種類の化合物に対して、実際の生物で発がんにつながるDNA損傷による突然変異の誘発を鋭敏に検出できる、細菌を用いた変異原性試験(Ames試験)注7)を実施しました。性質の異なる5種類の菌株(ネズミチフス菌4株、大腸菌1株)を用いて変異原性を評価したところ、平面性の高い化合物がDNA二重らせんの塩基対の間に挿入されることによるフレームシフト型の変異を検出しやすい菌株1株において、ALK5阻害剤IIだけが変異を引き起こしました。このことから、ALK5阻害剤IIの分子構造に起因する変異原性が考えられました(図1A)。
そこで、変異原性が平面性の高い化合物の構造によるものか、ALK5阻害活性によるものかを明らかにするために、ALK5阻害剤IIとその構造類似体および、構造がわずかに異なる代表的な2種類のALK5阻害剤の変異原性をAmes試験によって評価しました。その結果ALK5阻害活性のない構造類似体でも変異原性が検出された一方で、構造がわずかに異なる2種類のALK5阻害剤では変異原性が検出されませんでした(図1B)。これらのことから、ALK5阻害剤IIには平面構造に起因する変異原性があると考えられます。
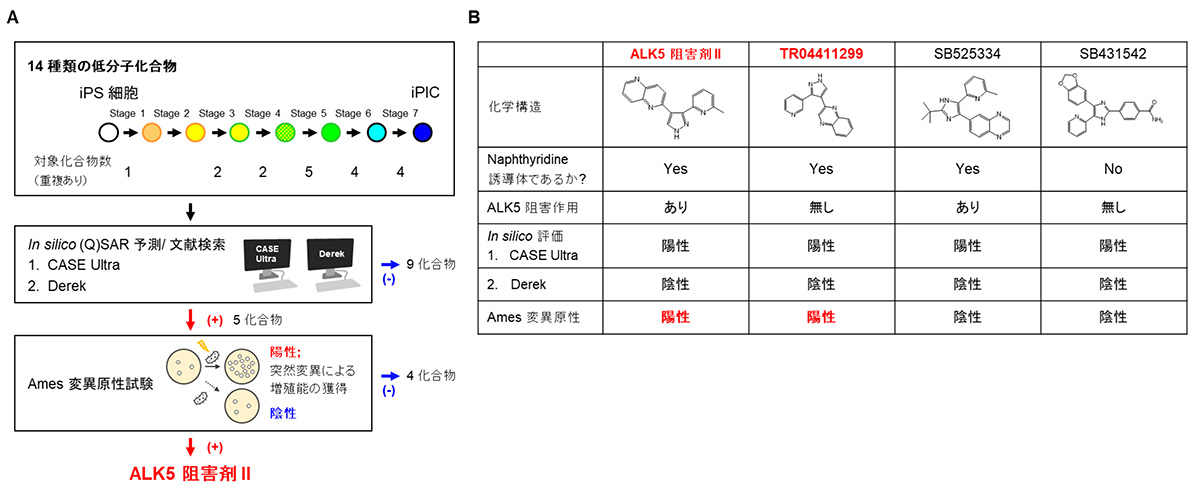
図1 膵島様細胞への分化誘導因子ALK5阻害剤IIにはAmes試験下で変異原性がある。
(A) 今回行った変異原性リスク評価の概要フローチャート。ヒトiPS細胞から膵島様細胞を作製する過程で用いる14種類の低分子化合物についてin silicoの解析手法2種、細菌を用いた変異原性試験の順に評価を行った。
(B) ALK5阻害剤IIと関連化合物の評価結果のまとめ。ALK5阻害剤II、TR04411299(類似構造を有するがALK5を阻害しない)、他のALK5阻害剤(SB525334及びSB431542)。
2)ALK5阻害剤IIはCDK8/19の阻害を介して膵β細胞への分化を促進する
ALK5阻害剤IIを変異原性の懸念のない物質に置き換えるために、30種類のALK5阻害剤の中からin silicoの解析によって20種類の変異原性を疑う警告のない化合物を選択し、それらがALK5阻害剤IIの代わりにiPICの作製に使用できるかを検討しました。しかし、いずれの化合物も膵β細胞への分化を促進することはなく、ALK5阻害剤IIと置き換えることができませんでした(図2A左)。
キナーゼ阻害剤は多くの場合、主活性を示す対象とは別の分子(オフターゲット)に対して阻害活性(オフターゲット効果)を有することが知られています。そこで、われわれはALK5阻害剤IIのオフターゲット効果を評価しました。TR-FRET法注8)という異なる分子どうしの結合が成立するかを調べる方法を用いて、ALK5阻害剤IIが阻害する可能性のあるプロテインキナーゼを網羅的に評価したところ、約350種類のうち10種類のプロテインキナーゼが、既知の標的であるALK5に加えてALK5阻害剤IIにより阻害されることが分かりました。次に、他の代表的なALK5阻害剤がこれら10種類のキナーゼを阻害するかを評価したところ、ALK5阻害剤IIだけがCDK8/19を阻害することが判明しました(図2A右)。これらの結果から、ALK5阻害剤IIによる膵β細胞への分化促進には、CDK8/19の阻害が関与する可能性が考えられました。
続いて、膵β細胞への分化にCDK8/19の阻害が中心的な役割を果たすかを明らかにするため、ALK5阻害作用のない複数種類のCDK8/19阻害剤に対して、膵β細胞への分化を促進するかどうかを調べました。その結果、いずれのCDK8/19阻害剤もALK5阻害剤Ⅱの代わりに膵β細胞への分化を促進することが観察されました。
さらに、検証した阻害剤のCDK8/19の阻害作用そのものが膵β細胞の分化を促すことを確かめるために、CDK8/19阻害剤(TR06096159)と、これに非常に類似した化合物(TR05978156)を用いて検討しました。TR06096159にはCDK8/19の強い阻害作用がありますが(CDK8 IC50 = 6.4 nM)、わずかにCDK8/19との結合部位の構造を変えたTR05978156にはほとんど阻害作用がないことが分かっています(CDK8 IC50 ≧ 10 μM)(図2B左)。その結果、阻害作用のないTR05978156は膵β細胞への分化を促進しませんでしたが、阻害作用のあるTR06096159は膵β細胞への分化を促進しました(図2B右)。これらの結果から、CDK8/19の阻害が膵β細胞への分化を促進することが分かりました。
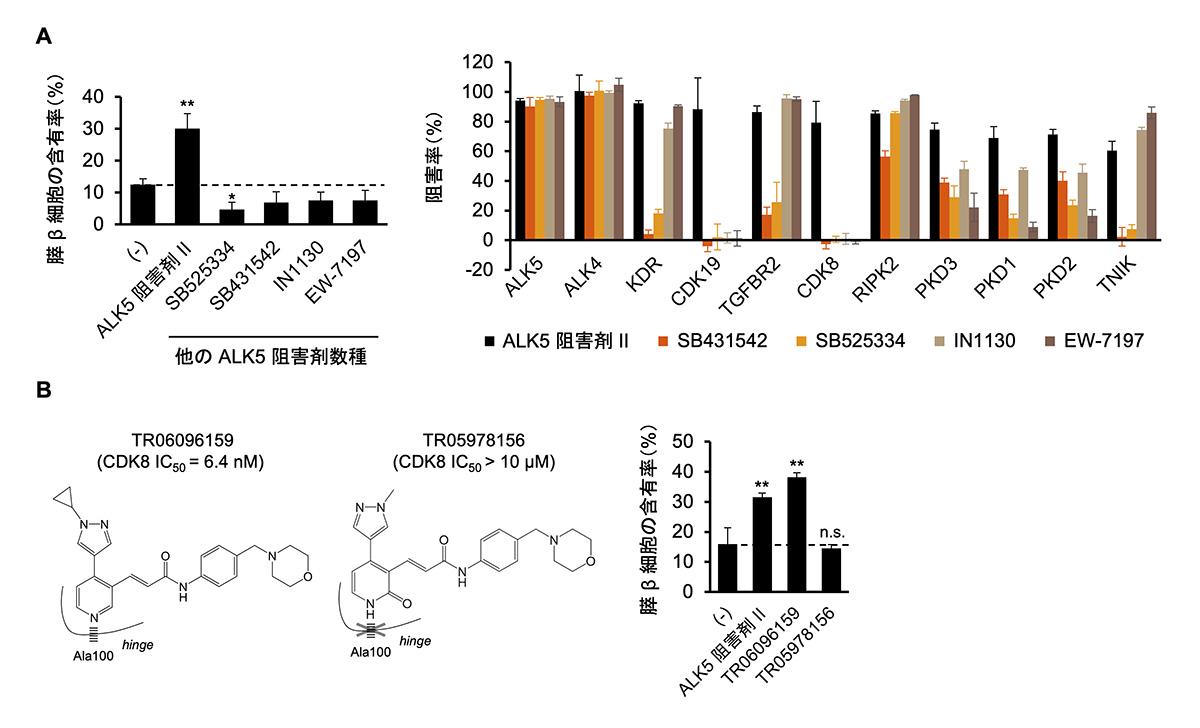
図2 ALK5阻害剤IIの膵β細胞誘導にはオフターゲットのCDK8/19阻害作用が重要である。
(A)(左)ALK5阻害剤II以外のALK5阻害剤を用いても膵β細胞への分化は促進されなかった。(右)ALK5阻害剤IIが阻害しうるプロテインキナーゼを網羅的に調べた。ALK5阻害剤IIには、CDK8/19を阻害するというユニークな阻害作用があった。他のALK5阻害剤(SB431542、SB525334、IN1130、EW-7197)にはCDK8/19阻害作用はなかった。
(B)(左)強力なCDK8/19阻害剤TR06096159とCDK8/19との結合部位の構造を変えてほとんど阻害作用がなくなった化合物TR05978156の構造。 (右)TR06096159は膵β細胞への分化を促進したが、TR05978156では分化を促進されなかった。
3)ALK5とCDK8/19の両者を阻害することで、iPIC作製におけるALK5阻害剤IIの作用を模倣できる
次に、ALK5阻害とCDK8/19の阻害の役割の理解を通じて、変異原性の懸念のない化合物を用いてiPICの作製を試みました。Ames試験やそれに先立ったin silicoの解析で変異原性の懸念がないことが確認されたSB431542(ALK5を阻害)、Senexin B(CDK8/19を阻害)をそれぞれ単独、あるいは組み合わせて(以後SB/Senと表記:ALK5とCDK8/19を阻害)、ALK5阻害剤IIで作製したiPICと比較しました。
SB/Senで作製した場合は、細胞集団中の膵β細胞の割合や細胞の収量が、ALK5阻害剤で作製した場合と同程度でした。一方、Senexin BやSB431542を単独で使用すると、いずれも細胞の収量や細胞集団中の膵β細胞の割合が低下しました(図3A)。さらに、4種類の方法で作製されたiPICに含まれる細胞組成を詳細に解析するため、それぞれの構成細胞約3,000個について、一細胞ごとに遺伝子発現を網羅的に解析し比較しました。膵β細胞の指標となる遺伝子を発現する細胞(INS+NKX6.1+)をさらに細かく分類しても、SB/Senで作製した場合はALK5阻害剤IIで作製したiPICとほぼ同様の組成でした。これらのことから、SB/SenをALK5阻害剤IIの変異原性の懸念のない置き換え化合物としてiPICの作製に用いることができると考えられました(図3B)。
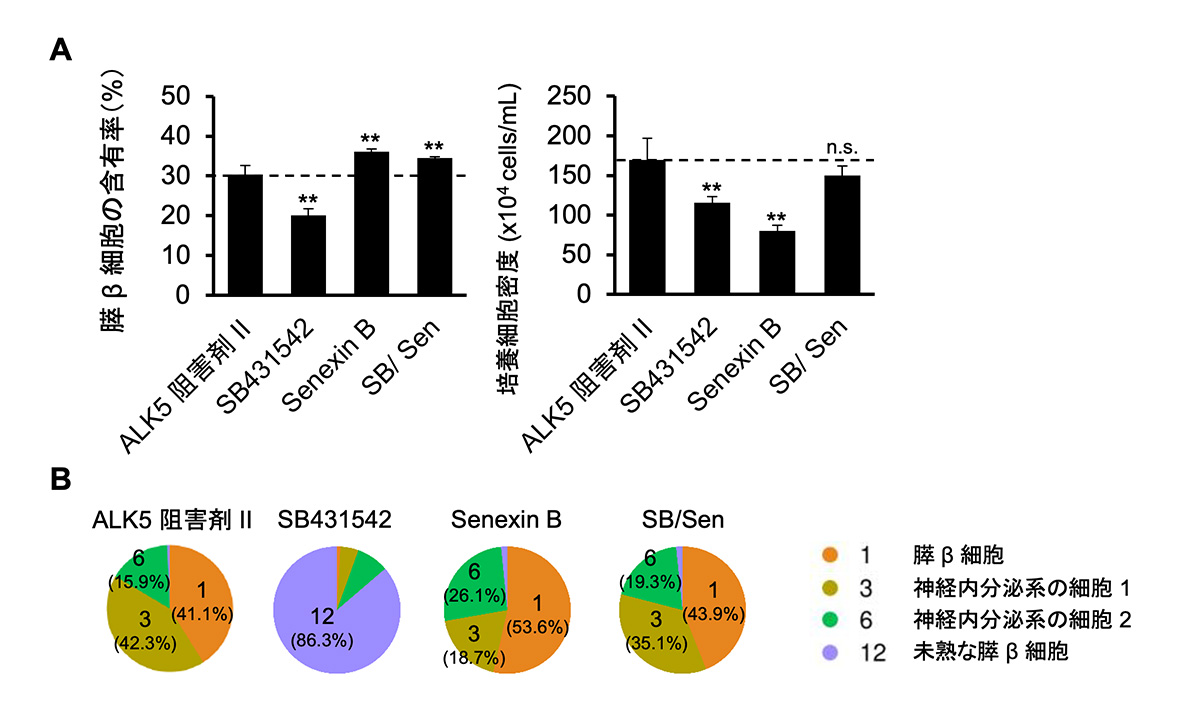
図3 膵β細胞への分化誘導においてALK5阻害とCDK8/19阻害はそれぞれ違う役割をもつ。
(A) ALK5阻害剤II、他のALK5阻害剤(SB431542)、ALK5阻害剤IIのオフターゲットであることが分かったCDK8/19の阻害剤(Senexin B)、それら両者の組み合わせ(SB/Sen)を用いてiPICに分化させた場合の膵β細胞の割合(左)と細胞の収量(右)。
(B) 4種類のiPICに対して単一細胞発現解析を行い、膵β細胞の指標を強く発現する細胞群についてより細かく分類した亜集団の割合。図中の番号は分類されたクラスターの整理番号を表す。
iPICを移植することで糖尿病のモデル動物を治療することができます。SB/Senで作製した細胞を同モデルに移植した場合でも従来のiPICと同様に生体内での治療効果をもつかどうかについて、ALK5阻害剤IIあるいはSB/Senを用いて作製したiPICを生体内に移植して比較しました。
ストレプトゾトシン投与によって糖尿病を誘発した免疫不全マウスの皮下に移植したところ、いずれのiPICを移植しても、同様の経時変化で、糖尿病状態の指標である高血糖が正常化され、その状態が半年以上維持されました(図4A)。インスリン分泌の指標であるヒトC-ペプチド注9)の推移も、移植から21週後に実施したグルコース負荷試験における応答性も、移植から6カ月後の組織像のいずれにも差異が観察されませんでした(図4B-D)。これらの結果から、変異原性のALK5阻害剤を用いる代わりに、非変異原性のALK5阻害剤とCDK8/19阻害剤を併用することで、iPICの薬効も再現できることが示されました。
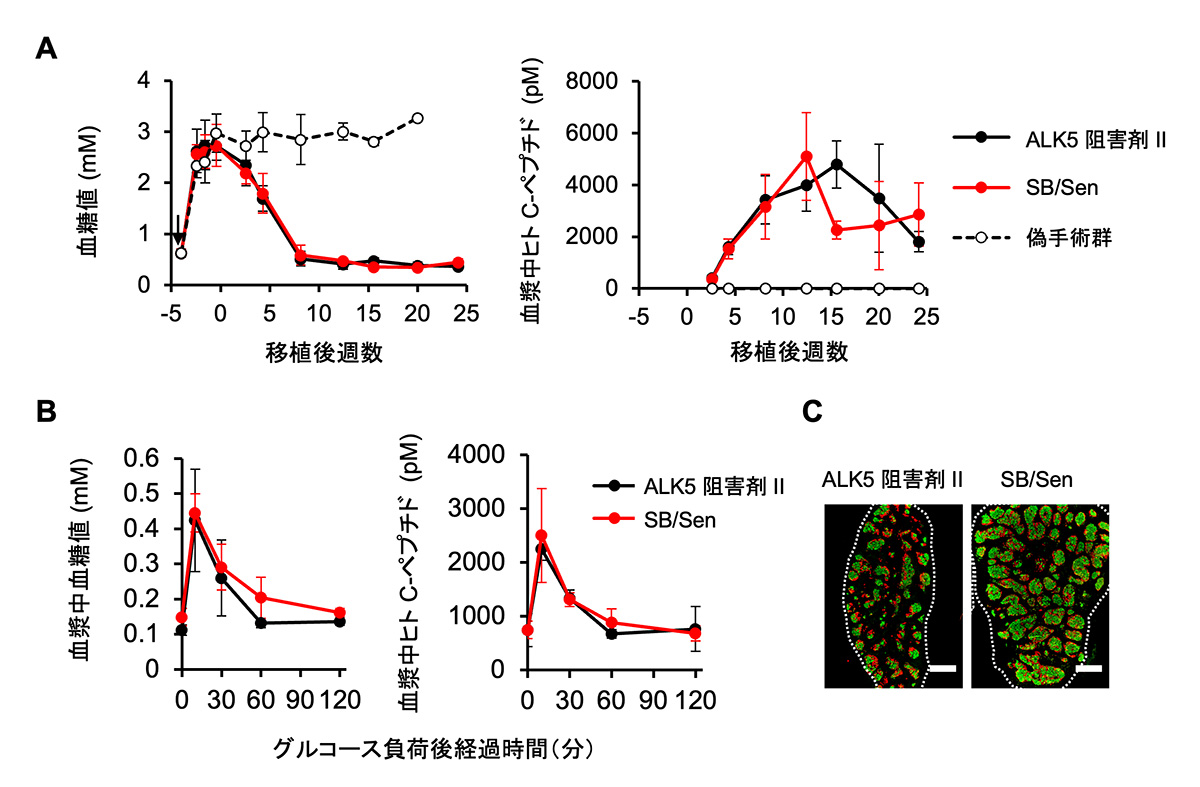
図4 変異原性の懸念のない化合物で作製したiPICは、
ALK5阻害剤IIで作製したiPICと同様に生体内で機能する。
ストレプトゾトシン投与((A)内の黒矢印)によって糖尿病を誘発した免疫不全マウスの皮下に、ALK5阻害剤IIあるいはSB/Senを用いて作製したiPICを移植した。
(A) 血糖値の経時変化(左)と血漿中ヒトC-ペプチドの経時変化(右)。
(B) 移植21週間後に経口糖負荷試験を実施した際の血糖値(左)と血漿中ヒトC-ペプチド(右)の経時変化。
(C)移植6か月後の移植片の染色像。膵島で産生されるホルモンのインスリン(緑)およびグルカゴン(赤)は、膵島様構造を構成する膵β細胞、膵α細胞の位置をそれぞれ示す。いずれの方法で作製した場合も、同程度に観察された。スケールバー 0.5 mm。
本研究では、ヒトiPS細胞から分化誘導によって膵島様細胞を作製する際に、細胞処理に用いられる生体内に存在しない低分子化合物に注目し、その変異原性を評価しました。その結果、ALK5阻害剤IIに変異原性の可能性があり、少なくとも変異に鋭敏な微生物に実際の変異を引き起こすことが示されました。
さらに、ALK5阻害剤IIの代替化合物探索の過程で、オフターゲットであるCDK8/19の阻害が膵β細胞への分化を促進することが明らかとなりました。一方で、ALK5阻害剤IIの作用を再現するには、ALK5とCDK8/19の両方の阻害が必要であり、ALK5阻害剤IIを変異原性の懸念のない化合物に置き換え、CDK8/19阻害剤を併用する新たなiPICの作製方法を開発しました。さらに新規の作製方法において、生体外(in vitro)の細胞の遺伝子発現のプロファイルも移植後の生体内(in vivo)での薬効も従来法と同様に再現され、変異原性の懸念のない化合物でもiPICを作製できることが示されました。
本研究で得られた知見は、ヒト多能性幹細胞から膵島様細胞への分化メカニズムの解明に役立つとともに、細胞治療製品を作る際の原材料に対するリスク軽減アプローチの一例になると期待されます。
- 論文名
CDK8/19 inhibition plays an important role in pancreatic β-cell induction from human iPSCs - ジャーナル名
Stem Cell Research & Therapy - 著者
Kensuke Sakuma1,2*, Noriko Tsubooka‑Yamazoe1,2, Kiyohiro Hashimoto3, Nozomu Sakai4, Shinya Asano5, Saori Watanabe‑Matsumoto2,7, Takeshi Watanabe3, Bunnai Saito4, Hirokazu Matsumoto2,6, Hikaru Ueno1,2, Ryo Ito1,2 and Taro Toyoda2,7*
*責任著者 - 著者の所属機関
- オリヅルセラピューティクス株式会社 膵島細胞(iPIC)治療事業部
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 武田薬品工業株式会社 Drug Safety Research and Evaluation Group
- 武田薬品工業株式会社 Drug Discovery Sciences
- Axcelead Drug Discovery Partners株式会社 Integrated & Translational Science
- 武田薬品工業株式会社 T-CiRAディスカバリー&イノベーション
- 京都大学iPS細胞研究所(CiRA) 未来生命科学開拓部門
- 関連サイト
本研究は、CiRAと武田薬品工業株式会社との共同研究プログラム「T-CiRA」およびその研究内容の事業化を目指して設立されたオリヅルセラピューティクス株式会社によるものです。
また、下記の支援を受けて実施されました。
- iPS細胞研究基金
注1)オフターゲット効果
本来の標的(ターゲット)とは異なる別の分子(オフターゲット)に対して活性化や阻害を引き起こす効果のこと。
注2)CDK8/19
サイクリン依存性キナーゼ(CDK)8およびCDK8と同一の遺伝子から派生した遺伝子(パラログ)であるCDK19。サイクリン(Cyclin)による活性化を受け細胞分裂の刺激因子としてはたらくCDK/cyclinモジュールの一般的な機能のほかに、いくつかのCDKは遺伝子の転写調節や転写後のRNAの加工(プロセシング)にも関与することが報告されている。CDK8/19は他の多くのタンパク質とともに転写を補助する巨大なメディエーター複合体を形成し、遺伝子発現制御に広く関わることが知られてきている。
注3)造腫瘍性
体に移植された細胞が増殖することにより、悪性または良性の腫瘍を形成する能力のこと。
注4)インスリン
血液中の糖を取り込ませるように細胞にはたらきかけ、血糖値を下げる効果があるホルモン。膵臓の中でも膵島と呼ばれる内分泌細胞の集まった部分にあるβ細胞で作られ、血液中に放出される。
注5)ICH M7
医薬品規制調和国際会議(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)が作成したガイドラインの一つ。ICHは薬事規制の国際調和を推進するため、医薬品の規制に関するガイドラインを作成している。ICH M7は、潜在的発がんリスクを低減するための医薬品中DNA反応性(変異原性)不純物の評価および管理に関するガイドライン。
注6)(定量的)構造活性相関((Q)SAR)
定性的な構造活性相関(SAR:structure-activity relationship)、定量的な構造活性相関(QSAR:quantitative SAR)の両方を指す表記法であり、化合物の構造上の特徴と各種エンドポイント(本研究では、変異原性)の相関関係を指す。
次項の細菌を用いる変異原性試験(Ames試験)の精度の良い予測法・スクリーニングツールとしては、専門的な知識や経験に基づくルールベースの方法(本研究ではDEREK)と統計ベースの方法(本研究ではCASE Ultra)およびそれらを組み合わせた方法等があり、ICH M7ガイドラインでは2つの相補的な予測モデルを用いることが推奨されている。
注7)Ames試験
変異原性試験の代表的な試験。アルキル化剤やインターカレーターなどの発がん性化学物質に感受性をもつ変異菌株を用いて実施される。再現性が良く他の変異原性試験と比べても予測精度が安定していることから医薬品、医療機器、化粧品、食品、農薬等の研究開発において発がん性化学物質の検出に広く用いられてきた。
注8)TR-FRET
時間分解蛍光測定(TRF: Time-Resolved Fluorescence)と蛍光共鳴エネルギー移動(FRET: Fluorescence Resonance Energy Transfer)を組み合わせた生体分子間の相互作用解析手法がTR-FRETであり、本研究では各種キナーゼタンパク質と基質混合物に対して評価対象のキナーゼ阻害剤が競合的な阻害作用を示すかどうかを評価した。
注9)C-ペプチド
インスリンが合成される際には、前駆体(プロインスリン)が切断され、インスリンとC-ペプチドが1:1の割合で作られる。さらにインスリンとC-ペプチドは同程度の割合で分泌されるため、インスリンの合成量や分泌量の指標として使われる。






















