
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2024年4月12日
ヒトiPS細胞由来の膵島様細胞の移植後に出現する新規増殖性目的外細胞の同定および除去
ポイント
- ヒトiPS細胞由来の膵島様細胞(iPICs)注1)を移植して長期経過後に観察される、増殖性の間葉系幹細胞(MSCs)注2)と平滑筋細胞(SMCs)の特性を持つ未知の細胞をPMSCsと呼ぶことにした。
- PMSCsとなりうる細胞を検出する培養系を構築し、ドセタキセル注3)処理で除去できることを見出した。
- 移植前にドセタキセルで前処理したiPICsは、累積108個以上移植しても増殖性細胞が観察されなくなった。
- 糖尿病の移植治療で想定される膵島様細胞の大量製造において、目的外細胞を除去し、安全性を高めることに役立つと期待される。
日吉秀行 主任研究員(武田薬品工業株式会社 R&Dリサーチグローバルアドバンストプラットフォーム)、豊田太郎 講師(CiRA未来生命科学開拓部門、元タケダ-CiRA共同研究プログラム(T-CiRA))らの研究グループは、iPS細胞由来の膵島細胞を多数移植した際に、予期せぬ目的外細胞が出現することを見出し、その培養方法と除去方法を見つけました。
糖尿病に対する細胞療法として、ヒトiPS細胞やES細胞などのヒト多能性幹細胞(PSCs)から作製した膵島様細胞の移植が期待されています。PSCsから作製された膵島細胞集団には、内分泌細胞注4)以外の細胞(目的外細胞)が混入する可能性があります。過去の研究から、目的外細胞として膵臓の内分泌組織以外の構成要素が移植後に増殖して組織構造を形成することがあると報告されています。しかし、膵臓系譜以外の増殖性の目的外細胞の混入の可能性や、その性質の解明はほとんど研究されていませんでした。
研究グループは、iPS細胞由来の膵島様細胞を移植して長期間経過後の移植片を多数観察したところ、予期せぬ目的外細胞が出現することがあることに気づきました。この細胞は間葉系幹細胞(MSCs)と平滑筋細胞(SMCs)の特性を持つことから、増殖性MSCおよびSMC様細胞(PMSCs)と呼ぶことにしました。PMSCsは、移植前には検出されず、細胞を多数(108個以上)移植した場合に検出されるため、ごく少数の細胞に由来すると考えられました。そこで、PMSCsを移植せずに検出するために、PMSCsになると推定される細胞集団を増やす培養法を構築しました。この培養系を用いた解析から、PMSCsになると推定される細胞はドセタキセルという化合物で処理することで減少することを見出しました。また、ドセタキセルで処理した細胞を移植すると、細胞を移植してから長期間観察しても、PMSCsが検出されなくなりました。本研究は、移植治療のためのヒトiPS細胞由来膵島様細胞に潜在して、移植長期間過後に顕在化する可能性のある目的外細胞を事前に除去し、安全性を高めることに役立つと期待されます。
この研究成果は2024年4月10日(米国時間)に米国科学誌「Proceedings of the National Academy of Sciences」でオンライン公開されました。
膵島の移植は糖尿病に対する根治療法の一つですが、移植用膵島の不足が問題となっています。そのため、膵島に代わりヒト多能性幹細胞(ES細胞およびiPS細胞)から作製する膵島様細胞を移植することが期待されています。培養皿上で膵島様細胞を作製する研究は近年大きな進捗があり、発生過程を模倣した段階的な分化誘導により幼若期の膵島様細胞を作製することが可能となっています。また、これを移植することで1型糖尿病モデルマウスを治療できることが示されています。しかしながら、各段階の分化誘導の効率は100%ではないため、目的外の細胞が副産物として混入する可能性があり、それらが望まない作用をする懸念があります。人工的に作製された膵島様細胞の性質は多く報告されていますが、安全性の観点で重要となる目的外細胞の性質は報告が少なく、不明な点が多くあります。過去の研究から、目的外細胞として膵臓の内分泌組織以外の構成要素が移植後に増殖して組織構造を形成することがあると報告されています。しかし、膵臓系譜以外の増殖性の目的外細胞の混入の可能性や、その性質の解明はほとんど研究されていませんでした。
研究グループは以前に、ヒトiPS細胞から作製した膵島様細胞(iPSC-derived pancreatic islet cells, iPICs)に混入される非内分泌前駆細胞を選択的かつ効率的に減少させる方法を報告しました(CiRAニュース2022年4月7日)。このようにして得られた104個程度のiPICsの中では、増殖性の非内分泌前駆細胞の集団が検出不能な程度まで減少しており、106個程度を移植した場合でも嚢胞性構造による移植物の拡大などの異常は観察されませんでした。一方、1型糖尿病患者への臨床応用には、108-109個程度の細胞数が必要と考えられているため、より大規模な実験でiPICsの長期安全性を確認する必要があります。しかし、マウスでの移植実験では通常106個の細胞を使用し、より高い細胞密度での移植は、移植後の細胞生存率が低下し、目的外細胞のリスクを過小評価する可能性があります。
そこで、本研究では、106個程度のiPICsを用いて多数の検討を行い、累積108個以上の数の細胞を評価しました。そして、その結果から浮かび上がってきた、懸念のある細胞特性を把握し、効果的に検出する方法や、除去方法の構築を試みました。
1)移植細胞の中には、移植後に増殖する膵臓系譜外の細胞が混入していることがある
多くの細胞数を用いてiPICsの長期安全性を評価するために、我々は106の桁数のiPICsを免疫不全マウスの皮下に移植する実験を繰り返しました。移植後23-26週目には、ほとんどの移植片はiPIC由来の内分泌細胞集団、宿主由来の血管、および宿主由来の線維組織で構成され、異常な細胞組織は見られませんでした(図1A)。しかし、低い頻度で異常な組織構造、すなわち膵臓以外と考えられる組織の存在が確認されました(13%、12/96匹のマウス)。また、7段階ある分化誘導過程のうち6段階目までしか処理をしていない細胞(s6-iPICs)を移植したところ、7段階目まで処理した細胞(s7-iPICs)より高い頻度で異常な組織構造が観察されました(84%、45匹中38匹のマウス)。s6-iPICs中には、s7-iPICsよりもわずかにですが、非内分泌系の前駆細胞が多く含まれているため、異常な組織構造の出現頻度は非内分泌系の前駆細胞の残存量と相関していると考えられました。
これらの異常組織は、膵内分泌細胞マーカー(PDX1、インスリン注5)、およびグルカゴン)または膵管様嚢胞構造のマーカー(PDX1およびCK19)を発現していませんでした(図1B、C)。一方、この組織はヒトの細胞を認識する抗体と反応し、増殖している細胞の指標であるKi67を高頻度で発現していました(図1D)。これらの結果から、異常組織は、膵管の系譜でもなく、移植後に増殖を続け、長期間経過後に検出可能となるものと考えられました。
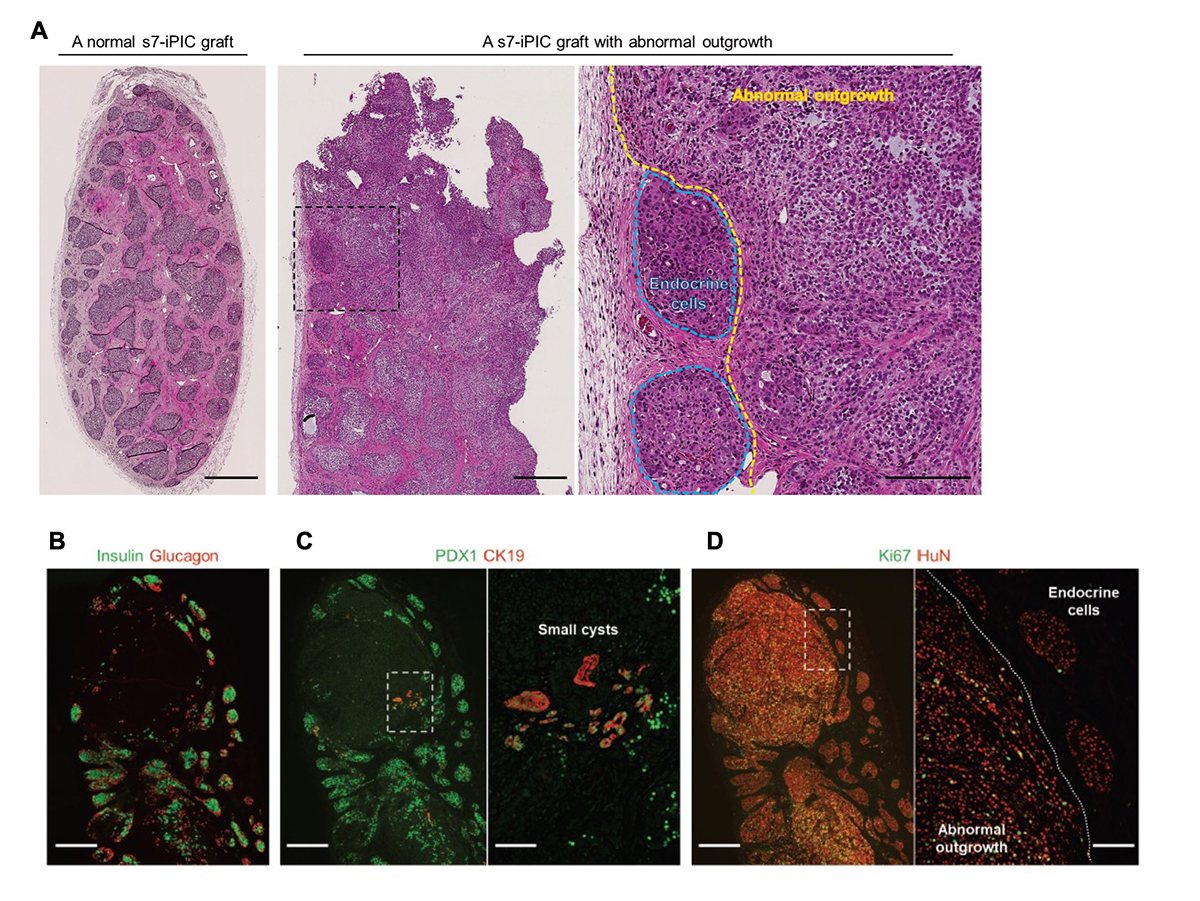
図1. 移植したiPICからは増殖性示す膵臓系譜外の細胞が観察されることがある。
正常およびストレプトゾトシンを投与して糖尿病にしたNOD-scidマウスの皮下へs7-iPIC(2.0-4.0 × 106細胞/マウス)を移植した。
(A) 移植から24週後にヘマトキシリン・エオジン(HE)で染色した移植片像。正常なs7-iPICの移植片(左)および異常な組織(中央、右)。右は、点線で囲まれた領域の拡大像。スケールバー500μm(左、中央)、200μm(右)。画像は、同様の結果を示す数十のサンプルの代表例。
(B-D) 移植から24週後に観察された異常組織の免疫組織染色像。スケールバー500μm(低倍率)、100μm(高倍率)。HuN; ヒト細胞の核。これらの画像は、同じ試料の連続断片から取得されたもので、数十の試料の代表例。
2)異常な組織は既知の細胞型として分類できない未知の細胞集団に由来する。
この異常組織の特徴を明らかにするために、シングルセルRNAシーケンシング(scRNA-seq)による解析を試みました。解析には、異常組織の出現頻度が高いs6-iPICsを用い、宿主由来の細胞の混入による解析細胞数の低下を防ぐために、非生分解性のアルギン酸ゲルに細胞を埋め込むという工夫をしました。皮下移植2か月後(Vivo s6-iPICs 2 months)と6か月後(Vivo s6-iPICs 6 months)に移植物を回収し、移植直前の細胞(Vitro s6-iPICs)および成人ヒト膵島細胞(Human Islets)の遺伝子発現と比較しました。
クラスター分析を実行したところ(図2A)、非内分泌細胞(Non-endocrine)として分類された3つのクラスターの一つ(クラスター15)が、膵管系のマーカーを発現していませんでした(図2B)。この細胞分画の特徴的な遺伝子を抽出したところ、VIM、COL3A1、およびCOL1A1などの間葉系幹細胞(MSC)関連遺伝子を発現していることが分かりました。このような細胞集団は既知の膵臓系譜の細胞型として分類できないため、異常な組織は未知の細胞集団に由来すると考えられました。さらに、この細胞集団には増殖性に関するスコアが高い細胞がいくつか含まれており、移植後の異常な組織形成と一致すると考えられました。
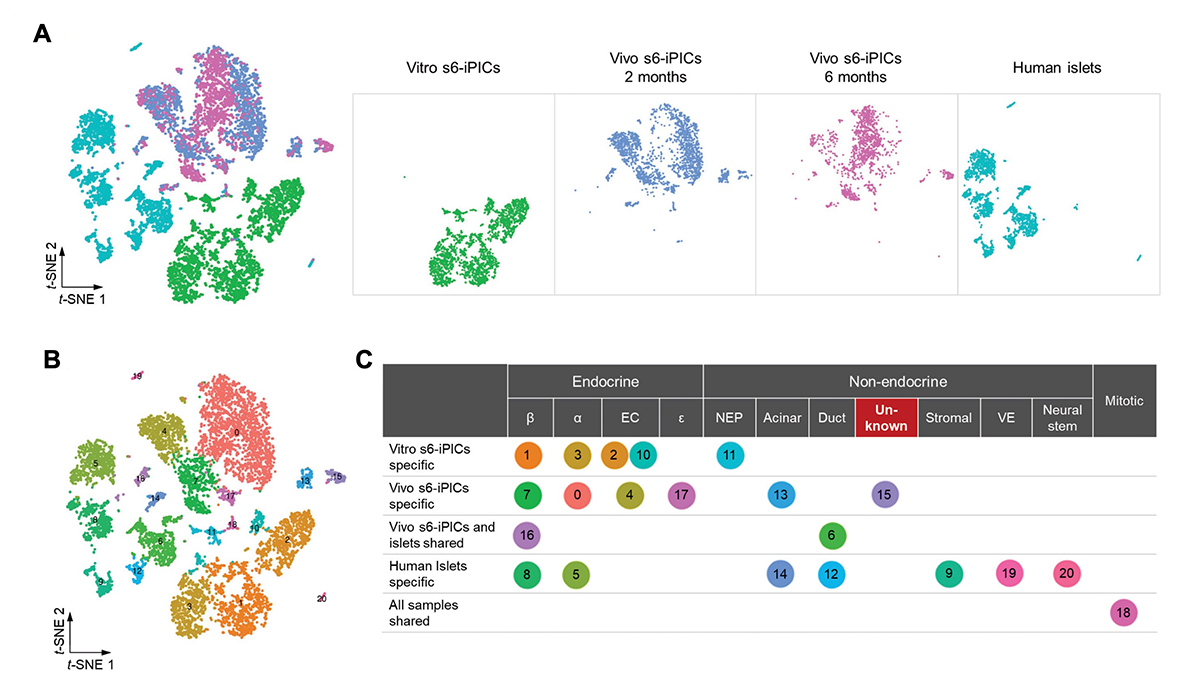
図2. 単一細胞ごとの遺伝子発現解析による未知の細胞集団の抽出。
(A) 移植前後のiPICとヒト膵島の単一細胞ごとの遺伝子発現プロファイルをもとにそれぞれの細胞の類似性をt-SNEという手法を用いて2次元的に表現した図。点の一つが一つの細胞を表す。全ての群をまとめた図(左)。各群を個別に示した図(右)。
(B) Shared nearest neighbor clustering(共有最近傍隣接クラスタリング)による細胞集団の分類。
(C) (B)で分類された各クラスターに対して、特徴的な遺伝子発現をもとに既知の細胞型に割り当てた表。クラスター6と16は移植後のs6-iPICs(Vivo s6-iPICs)とヒト膵島でともに存在。クラスター18は増殖性の細胞集団で、すべてのサンプルで存在していた。
β;β細胞となる運命の細胞または実際のβ細、α;α細胞となる運命の細胞または実際のα細胞、EC;腸クロム親和性細胞様の細胞、ε;ε細胞となる運命の細胞、NEP;非内分泌前駆細胞、Acinar;腺房様細胞または実際の腺房細胞、Duct;膵管様細胞または実際の膵管細胞、Unknown;既知の細胞に分類できなかった不明な細胞、Stromal;間質細胞、VE;血管内皮細胞、Neural stem;神経幹細胞、Mitotic;有糸分裂している細胞。
3)異常組織は、増殖性のMSCおよびSMC様細胞(PMSCs)から成る
この細胞集団クラスター15の特性を明らかにするために、既知の組織や細胞株への転写体の類似性をRCA注6)にて評価しました(図3A)。クラスター15は平滑筋、子宮、MSC、およびiPS細胞の性質を示すスコアが高いグループと分類されました(図3A、B)。一方、成人ヒトの膵島の間質細胞(クラスター9)も同じグループに分類され、MSC関連マーカーの発現を示していました。しかし、これら2つのクラスターの比較解析(疑似時間の推定と、共通の発現動態を持つ遺伝子集団に対するGO解析)から、クラスター15は真の間質細胞(クラスター9)とは異なる未熟で増殖性の細胞集団であると考えられました。
クラスター15で、他の細胞集団に比べて高く発現している上位20の遺伝子を抽出し(図3C)、その発現量の程度をt-SNEで描かれる図に重ねたところ、クラスター15ではOGN、IGF1、およびSFRP4といった子宮関連遺伝子が特異的に発現していました。一方、VIM やCOL3A1などのMSC関連遺伝子はクラスター15だけでなくクラスター9でも発現していました(図3D)。さらに、クラスター15はα-平滑筋アクチン(α-SMA)遺伝子ACTA2 を特異的に発現していました(図3C、D)。そして、移植片を免疫染色にて観察したところ、クラスター15特異的マーカーであるIGF1およびα-SMAタンパク質が移植片の異常組織で発現していることを確認できました(図3E、F)。これらの結果から、クラスター15の細胞集団が移植後に現れる異常組織の構成要素で、MSCおよび平滑筋(SMC)の特性を持っていると考えられ、以後、増殖性MSCsおよびSMCs様の細胞(PMSCs)と呼ぶことにしました。また、過去に報告されたES細胞またはiPS細胞由来の膵島様細胞の移植物の遺伝子発現データにおいても、VIM、COL3A1、OGN、IGF1、SFRP4、およびACTA2 などのPMSCs特異的マーカーを発現する細胞集団が存在していました。したがって、PMSCsは、この検討で用いた細胞株、誘導プロトコル、または移植方法に特異的な現象ではなく、PSC由来の膵島様細胞の移植物に一般的に存在する細胞であると考えられました。
特に注目すべきは、PMSCs特異的マーカーは移植前の細胞には発現していなかったことです(図3D)。そこで、PMSCsの起源を評価するために、階層的クラスタリング解析を実施したところ、非内分泌系の前駆細胞集団(クラスター11)に近いと考えられました(図3G)。このため、この細胞集団には、嚢胞だけでなくPMSCsにも分化・成熟するものが含まれていると考えられました。
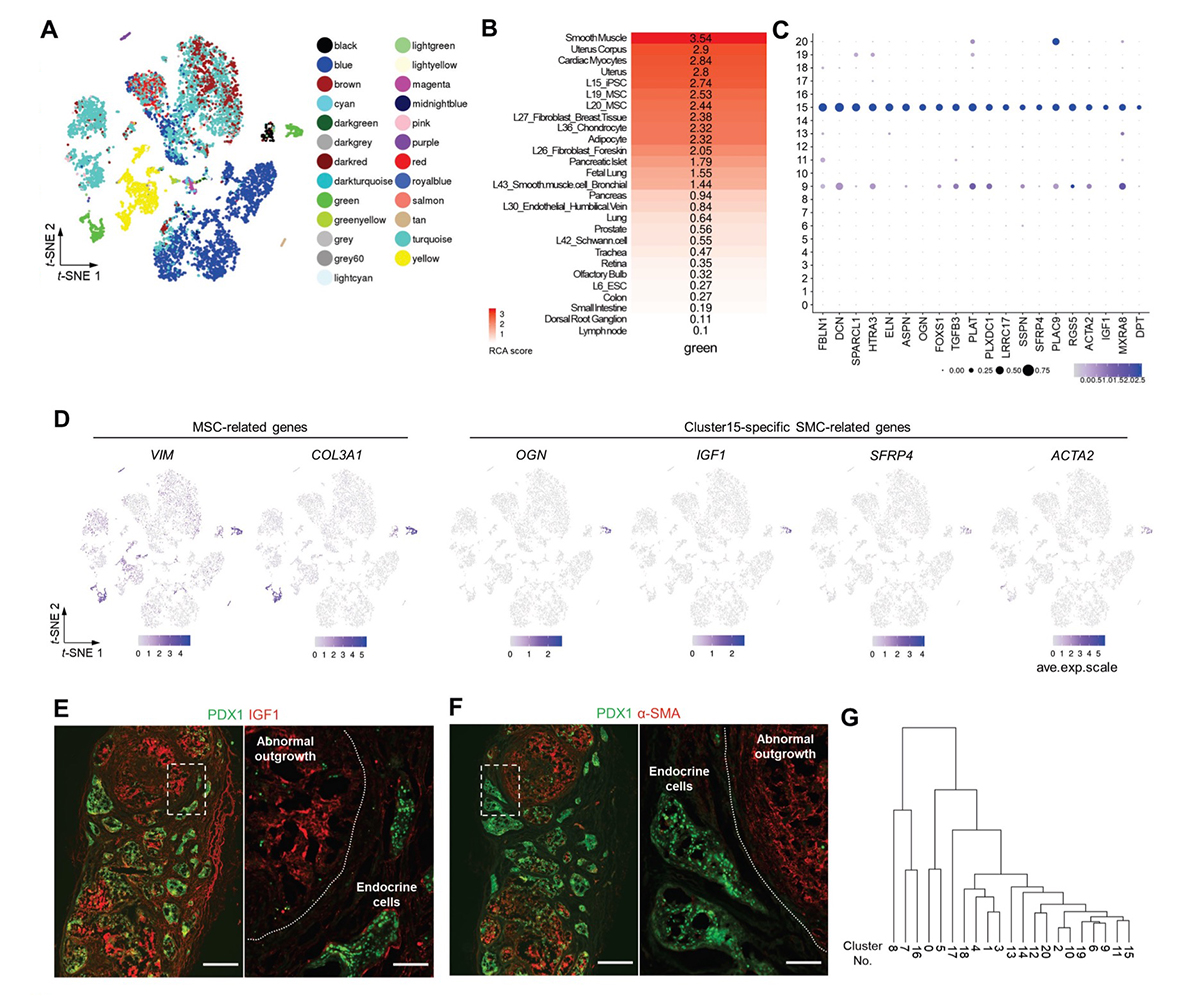
図3. 異常組織は、増殖性のMSCおよびSMC様の細胞(PMSCs)から成る
(A) Reference component analysis(RCA)によって分類した細胞集団をt-SNEの図(図2A)上で表示。
(B) RCAで「green」の群と分類された細胞(図2Cのクラスター15および9)と類似性のある組織や細胞株の類似性の程度を高い順に並べたヒートマップ。
(C) クラスター15特異的に発現する上位20遺伝子のバブルプロット(P < 0.05、fold-change > 1.2、およびpct.2 < 0.05)。色の濃さは平均的な相対発現量を示す。バブルの大きさは発現細胞の割合を示す。Pct. 2, は他のすべてのクラスターにおけるマーカーを発現する細胞の割合。
(D) MSCおよびクラスター15特異的なSMC関連遺伝子の単一細胞における発現をt-SNEの図(図2A)上で表示。
(E) (F) s7-iPICを移植して24週後に検出された異常組織の免疫染色像。スケールバー500μm(低倍率)、100μm(高倍率)。これらの画像は、図1B-Dと同じ試料の連続切片で、同様の結果を示す数十の試料の代表例。
(G) 階層的クラスタリング解析。
4)EGF刺激下での延長培養は、移植後のPMSCsに似た細胞集団(推定PMSCs)を出現させる
PMSCsは非内分泌系の前駆細胞から生じると考えられるのは、移植前には存在せず、生体内で数か月かけて分化・成熟して初めて明確となると予想されるからです。したがって、PMSCsの除去方法の探索には、移植試験と数か月の成熟期間が必要であり、検討の効率が極めて悪いと考えられました。そこで、移植せずにPMSCsの出現を簡単に予測できるin vitroの培養系を構築しました。そして、ヒト上皮成長因子(EGF)受容体のリガンド(betacellulinやEGFなど)の添加が、PMSCsの起源と考えられるPDX1−/CHGA−の非内分泌細胞の量を増加させること発見しました(図4A)。さらに、長期培養後のPDX1−/CHGA−の細胞集団には、PMSCsのマーカーであるα-SMAを発現する細胞が含まれていました(図4B)。このPDX1−/CHGA−の細胞集団はscRNA-seqとその後のRCA解析から、移植後に得られるPMSCsと同様に、平滑筋、子宮、およびMSCに近いと推測されました(図4C、D)。また、PDX1−/CHGA−の細胞集団は、OGN やCOL3A1などのPMSCsに特異的な遺伝子を発現し、一部ではACTA2 を発現していました(図4E)。これらの結果から、EGF刺激下の延長培養で得られるPDX1−/CHGA−の細胞集団は、移植後に現れるPMSCsに近い(推定PMSCs)と考えられ、この系を用いてPMSCsの出現を予防する方法の探索につなげられると考えました。
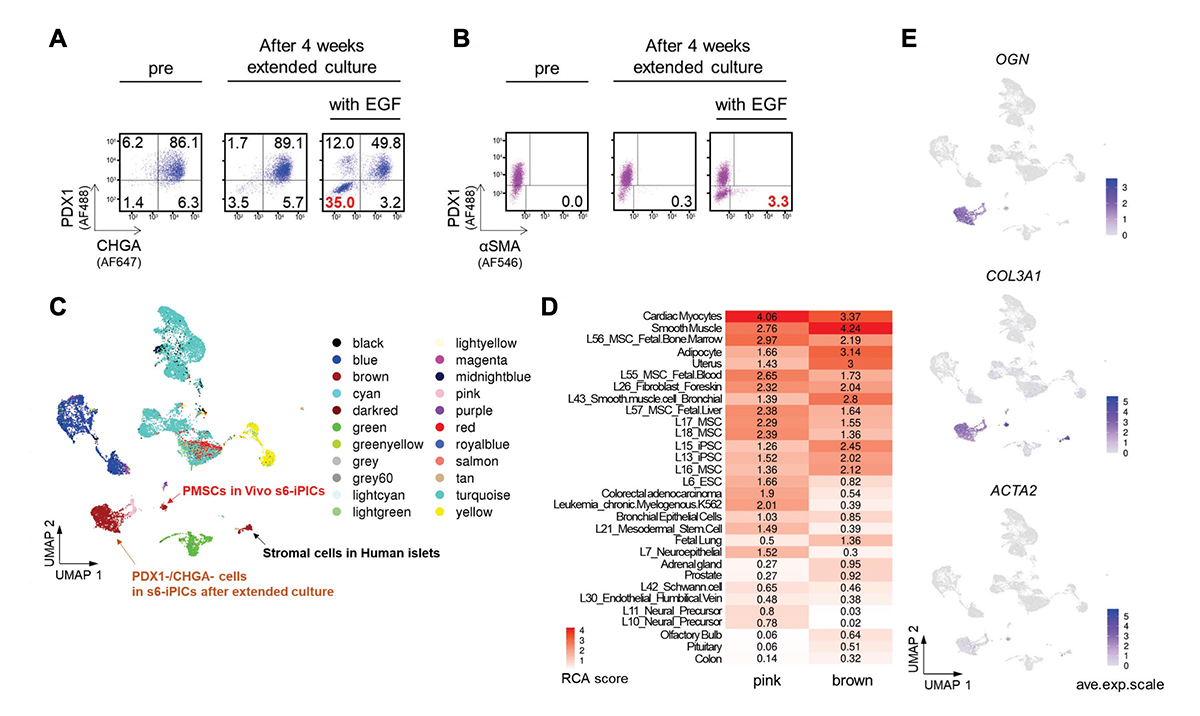
図4. EGF刺激下での延長培養は、移植後のPMSCsに似た細胞集団(推定PMSCs)を出現させる
(A、B) s6-iPICsをEGF刺激下あるいは非刺激下で4週間延長培養する前後のタンパク質発現をフローサイトメトリーで測定した。数値は各分画の細胞集団の割合を示す。
(C) UMAPによって細胞の類似性を表した図上にRCAによる分類を当てはめた図。延長培養後のPDX1−/CHGA−細胞、Vivo s6-iPICsにおけるPMSCs、およびヒト膵島の間質細胞は「pink」の群と「brown」の群として分類される。
(D) RCAで「pink」の群と「brown」の群と分類された細胞と類似した組織や細胞株を類似性の程度の順に並べたヒートマップ。
(E) UMAPで表した図上にPMSCsのマーカーとなる遺伝子の単一細胞における遺伝子発現。
5)シスプラチンとドセタキセルは、キナーゼ阻害以外の機序で"推定PMSCs"を除去する
続いて、"推定PMSCs"を除去する液性因子を探索しました。まず、s7-iPICsがs6-iPICsよりも移植後にPMSCsの頻度が低いことから(図1C)、7段階目の分化誘導因子の効果を解析したところ、AXL阻害剤であるR428が、PMSCsを減少させることが分かりました(図5A、B)。一方で、AXL阻害剤(R428)や他のキナーゼ阻害剤(PD-166866、およびTR06141363)で処理したs7-iPICsでも、移植後にPMSCsが現れたことを考慮すると、残存するPMSCsを確実に除去するためには、キナーゼ阻害以外の作用メカニズムを組み合わせることが有効と考えました。
PMSCsは増殖能と子宮特性を示すため、次に、子宮内膜癌の第一選択化学療法として使用されるプラチナ複合体であるシスプラチン、タキサンであるドセタキセル、パクリタキセルに注目しました。検討の結果、シスプラチンやドセタキセル処理した細胞では、PMSCsが減少することが分かりました(図5C、D)。さらに、ドセタキセルは、延長培養後に増加するPDX1+/CHGA−細胞集団も減少させました。これは、膵臓系非内分泌集団で、移植後に嚢胞性腫瘍を形成する可能性があるものです(推定嚢胞性細胞)。一方で、シスプラチンおよびドセタキセル処理は、CHGA+の内分泌細胞の数に影響を与えませんでした(図5D)。これらの結果から、プラチナ複合体やタキサンの処理は、キナーゼ阻害以外のメカニズムによってPMSCsの出現を予防につながる有効な化合物であると考えられました。
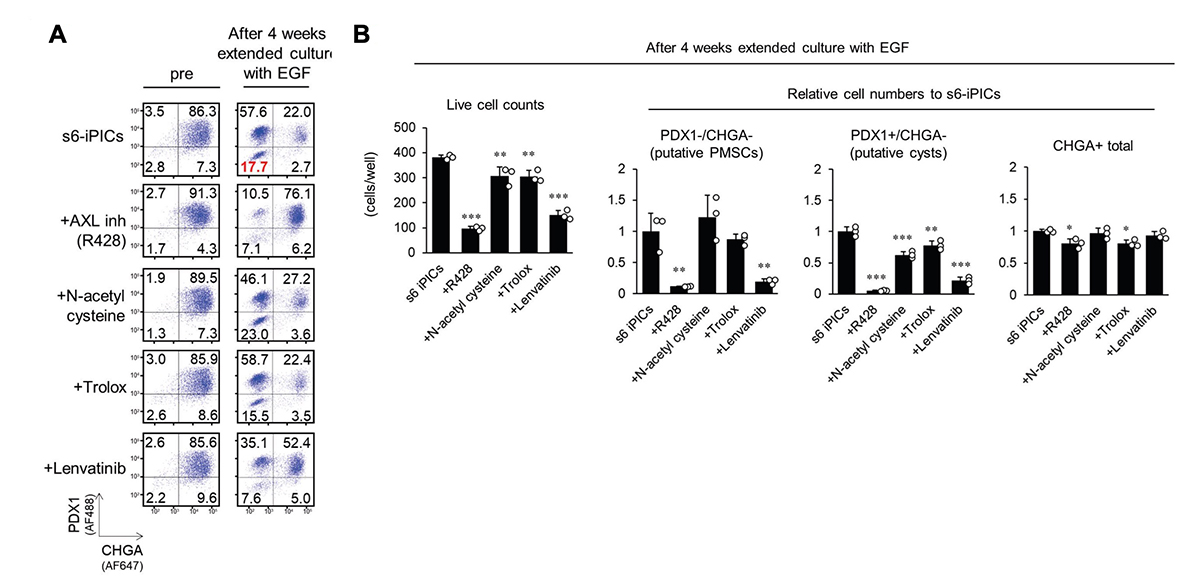
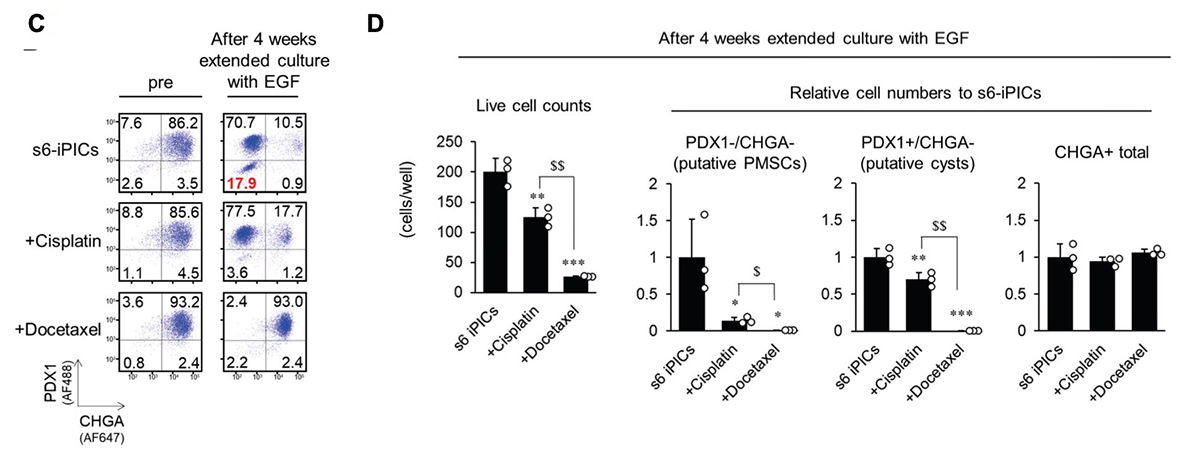
図5. シスプラチンおよびドセタキセルは"推定PMSCs"を効果的に除去する。
s6-iPICsに様々な処理をしてから、4週間延長培養した。その前後のタンパク質発現をフローサイトメトリーで測定した。数値は各分画の細胞集団の割合を示す。s6-iPICsに分化誘導7段階目で用いる各因子(A、B)あるいは子宮内膜癌の第一選択化学療法薬で処理した場合(C、D)におけるPDX1−/CHGA−、PDX1+/CHGA−、およびCHGA+集団の生細胞数および相対細胞数(B、D)。相対細胞数はs6-iPICsの細胞数を1とした。値は平均 ± 標準偏差(n = 3、技術的反復数)。*P < 0.05、**P < 0.01、***P < 0.001 v.s. 6-iPICs(Dunnett検定)。$P < 0.05、$$P < 0.01(Aspin-Welch検定)。
6)ドセタキセルで処理したiPICsでは、異常組織の出現なく治療効果を示す
最後に、ドセタキセルによる"推定PMSCs"および"推定嚢胞性細胞"の除去が、移植したs7-iPICsからの異常組織の出現を予防するか検討しました。このため、ストレプトゾトシンで糖尿病にしたマウスに、ドセタキセル処理したiPICsを移植しました。複数の移植試験を繰り返し、最終的にドセタキセル処理されたiPICsを85匹のマウスに移植しました(累積移植細胞数>3.0×108細胞)が、PMSCsや嚢胞は観察されませんでした(図6A-E)。また、分化誘導7段階目の因子が存在しない場合での、ドセタキセルの効果を検証明するため、s6-iPICsを用いてドセタキセルの有無を評価したところ、ドセタキセル処理により、s6-iPICsでもPMSCsおよび嚢胞の出現頻度が減少しました(図6E)。なお、移植後8週間以内にマウスの血糖値は正常化され、移植後23週目に経口グルコース耐性試験から血糖値に応じてインスリン分泌量を調節したことから、ドセタキセルで処理してもiPICsによる糖尿病の治療効果は維持されていました。
以上のことから、ドセタキセル処理はin vitroの延長培養だけでなく、in vivoの移植においてもPMSCsの除去に効果的で、iPICsの治療効果も維持されることが示されました。
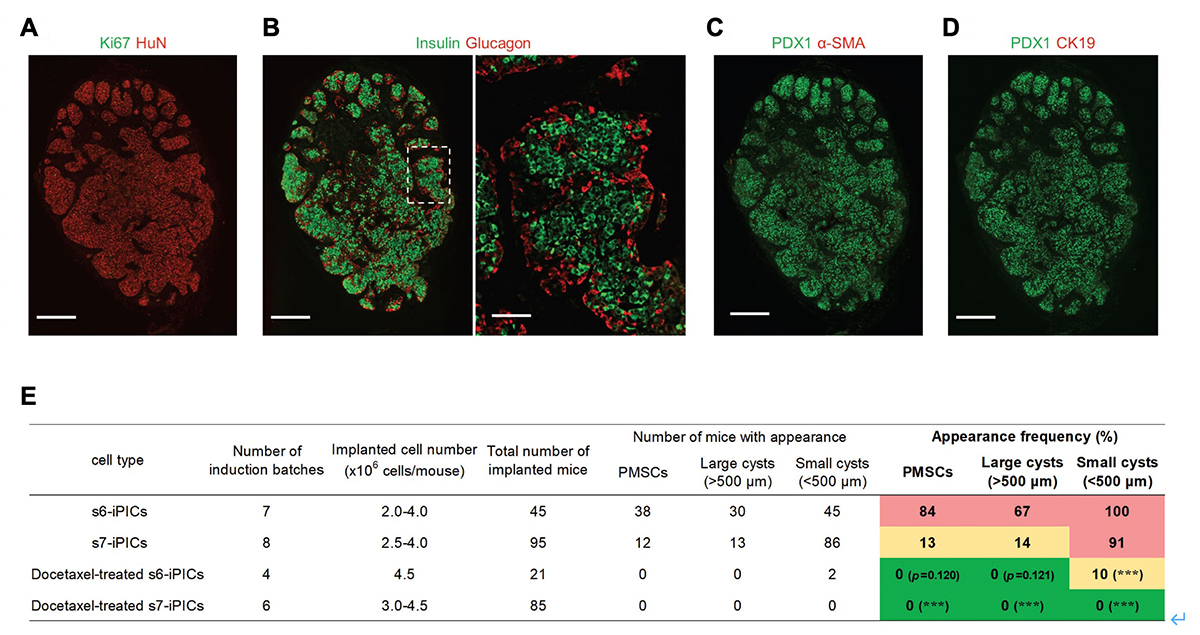
図6. ドセタキセルで処理したiPICsでは、異常組織の出現なく治療効果を示す。
正常およびストレプトゾトシンを投与して糖尿病にしたNOD-scidマウスの皮下へs6-iPICsまたはs7-iPICs(3.0-4.5 × 106細胞/マウス)を移植した。
(A-D) ドセタキセル処理したs7-iPICsを移植して24週後の免疫染色像。スケールバー 500μm(低倍率)、100μm(高倍率)。
(E) ドセタキセルの処理の有無と移植片におけるPMSCs、大嚢胞(直径> 500μm)、および小嚢胞(直径< 500μm)の出現頻度のまとめ。s6-iPICsおよびs7-iPICsのデータの一部は図1と共有している。*P < 0.05、**P < 0.01、***P < 0.001 v.s. s7-iPICs、Fisherの正確確率検定。
本研究では、ヒトiPS細胞から分化誘導によって膵島様細胞を作製する際に、混入される可能性のある目的外の細胞の中でも、移植後に検出可能となる極めて少ない細胞分画に注目し、その性質を評価しました。その結果、移植後に、一部で膵臓系譜以外の組織が形成されることがありました。解析から、その組織は間葉系幹細胞(MSC)および平滑筋細胞(SMC)特性を持つことから、PMSCsと名付けました。PMSCsは増殖性であるため、細胞治療に向けては移植細胞に混入させないことが大事です。しかし、PMSCsの混入頻度は非常に低く106-107細胞中に含まれていないこともあります。また、移植前には特定のマーカーを発現していません。これらのことから、直接検出することも、除去法を検討することも困難でした。そこで、PMSCになると推定される細胞集団が増幅される条件で延長して培養する方法を考案しました。そして、PMSCになると推定される細胞集団を除去する方法として、特にドセタキセルが有効であることを示しました。そして、ドセタキセルで処理することで、糖尿病モデルマウスの治療効果を維持したまま、移植後のPMSCsの出現頻度を抑制したiPICsを作製できることを示しました。
本研究で得られた知見は、移植治療のためのヒト多能性幹細胞から膵島様細胞を製造する工程において、既存の方法と組み合わせて目的外細胞を除去することで安全性を高めることに役立つと期待されます。
- 論文名
Identification and removal of unexpected proliferative off target cells emerging after iPSC derived pancreatic islet cell implantation - ジャーナル名
Proceedings of the National Academy of Sciences - 著者
Hideyuki Hiyoshi1,2,*, Kensuke Sakuma1,2, Shinya Asano3, Stephanie C. Napier1,2, Shuhei Konagaya2,4, Taisuke Mochida1,2, Hikaru Ueno1,2, Takeshi Watanabe5, Yoshiaki Kassai1,2, Hirokazu Matsumoto1,2, Ryo Ito1,2, Taro Toyoda2,4,6,*
*責任著者 - 著者の所属機関
- 武田薬品工業株式会社 R&Dリサーチグローバルアドバンストプラットフォーム
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- Axcelead Drug Discovery Partners株式会社 Integrated & Translational Science
- 京都大学iPS細胞研究所(CiRA) 増殖分化機構研究部門
- 武田薬品工業株式会社 R&Dリサーチプレクリニカル&トランスレーショナルサイエンス薬剤安全性研究所
- 京都大学iPS細胞研究所(CiRA)未来生命科学開拓部門
本研究は、CiRAと武田薬品工業株式会社との共同研究プログラム「T-CiRA」によるものです。
また、下記の支援を受けて実施されました。
- iPS細胞研究基金
注1)膵島様細胞(iPICs)
膵島は膵臓の中にあるインスリンを放出する細胞(内分泌細胞)の塊のこと。その塊に似た細胞集団をiPS細胞から作ったものをiPICsと呼ぶ。
注2)間葉系幹細胞(MSCs)
成体内に存在する幹細胞の一種で、骨や軟骨、脂肪などに分化する能力がある。
注3)ドセタキセル
細胞分裂に必要な微小管の形成を止める働きがある。抗がん剤の一つとして治療に利用されている。
注4)内分泌細胞
インスリンなど、血液中にホルモンを放出する働きを持つ細胞。
注5)インスリン
血液中の糖を取り込ませるように細胞にはたらきかけ、血糖値を下げる効果があるホルモン。膵臓の中でも膵島と呼ばれる内分泌細胞の集まった部分にあるβ細胞で作られ、血液中に放出される。
注6)RCA
Reference Component Analysis(RCA)は、異なるグループ間の共通の特徴を見つけ出し、その項目に関連する特徴量を抽出する解析のこと。データが複数の異なる分類に属する場合に特に有用である。






















