
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2024年9月27日
ヒトiPS細胞由来心外膜細胞から血管新生や心筋増殖を促す「心臓周皮細胞」を作製
ポイント
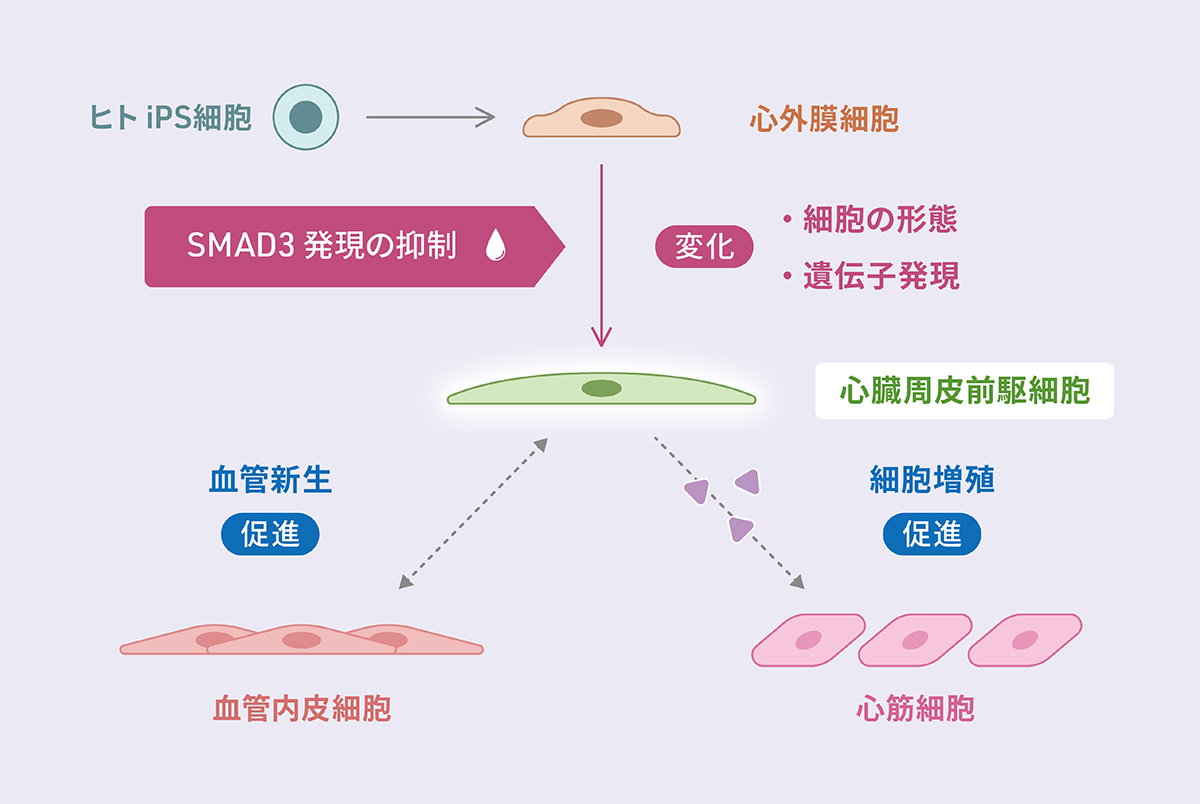
- ヒトiPS細胞から作製した心外膜注1)の細胞において、SMAD3注2)を減少させると心臓周皮細胞注3)の前駆細胞の特徴をもつ細胞へと分化した。
- SMAD3の減少により分化した細胞は、血管内皮細胞と相互作用し血管新生を促進する。
- SMAD3の減少により分化した細胞は、心筋細胞の増殖を活性化する物質を分泌する。
吉田善紀准教授(京都大学iPS細胞研究所(CiRA)増殖分化機構研究部門)、ルセナ-カカセ アントニオ准教授(研究当時:CiRA同部門特命助教、現在:大阪大学)、大学院生の三好悠太郎(CiRA同部門、京都大学大学院医学研究科)らのグループは、ヒトiPS細胞から作製した心外膜細胞において、SMAD3の減少が心臓周皮細胞への分化を促すことを明らかにしました。
心臓の表面をおおう心外膜は、心臓が作られる胎児期に、心外膜由来細胞(EPDC)を経由して、血管平滑筋細胞や線維芽細胞、心臓周皮細胞などの細胞へと分化します。これらの細胞は、心臓の微小血管とその周囲の組織を構成する細胞であり、心臓の形成に重要な役割を果たします。成人になると、胎児期の心外膜細胞の分化能力などは不活性化されますが、虚血などの傷害を受けると、一時的に再活性化し、EPDCへの分化や血管の形成(血管新生)を促すタンパク質の分泌により心臓組織の再生に寄与します。
本研究では、心外膜細胞がEPDCへと分化する上皮間葉転換注4)の過程に関わるSMAD3タンパク質に着目し、ヒトiPS細胞から作製した心外膜細胞における役割を調べました。SMAD3を減少させると心臓周皮細胞の前駆細胞の特徴をもつ細胞へと分化し、生体の心臓周皮細胞のように血管内皮細胞と相互作用し管状構造の形成を促進したり、心筋細胞の増殖を誘導するタンパク質を分泌することが明らかになりました。周皮細胞は血管壁を構成する血管内皮細胞を覆うように存在し、血管の脈管構造を安定化させたり、血管の形成を補助する細胞であり、心臓や腎臓など器官ごとに異なる特徴をもっています。
本研究では、ヒトiPS細胞から作製した心外膜細胞の特性の一端を明らかにしました。心臓の再生を助ける心外膜細胞の能力や特性をさらに深く理解していくことで、将来的に心疾患の治療開発にも役立つヒト心臓の生物学的な基盤が構築されると考えられます。
この研究成果は2024年9月27日(日本時間)に国際学術誌「Stem Cell Reports」にオンライン公開されました。
研究グループはこれまでに、ヒトiPS細胞から作製した心外膜細胞を用いて、その特性や分化に関わる分子メカニズムの一端の解明(CiRAニュース2022年2月9日)や、薬剤の効果を評価するために有用な心臓オルガノイドの作製(CiRAニュース2022年11月21日)を行いました。
胎児期や傷害時の心外膜細胞の活性化によるEPDCへの分化では、上皮間葉転換が起きていることが知られています。今回、研究グループは、上皮間葉転換の指令を細胞内に伝え、遺伝子発現を調節する主要な転写因子であるSMAD3の発現が、ヒトiPS細胞から作製した心外膜細胞で経時的に増加していることを見出し、その役割を解析しました。
上皮間葉転換では、通常、SMAD3がリン酸化されることで、上皮系から間葉系の特性を持つ細胞へと変化します。今回、SMAD3を減少させると、心臓の周皮細胞の前駆細胞の特徴をもつ細胞に分化することが新たにわかりました。この結果は、ヒトiPS細胞から作製した心外膜において、リン酸化による従来の上皮間葉転換とは異なる分子メカニズムでSMAD3が心臓周皮細胞への分化に関わることを示しています。
今後、心外膜とその分化した細胞の分子メカニズムをさらに明らかにしていくことで、心臓の再生を可能にする新たなアプローチなどの開発にもつながることが期待されます。
1)ヒトiPS細胞から分化誘導した心外膜細胞におけるSMAD3発現の上昇
はじめに、ヒトiPS細胞から心外膜細胞を分化誘導しました(図1A,B)。上皮間葉転換に関わるタンパク質のSMAD3、SMAD2、SMAD4の分化誘導12日目と24日目における発現を比較したところ、SMAD3のみ心外膜細胞への分化に伴い発現が上昇しました(図1C)。
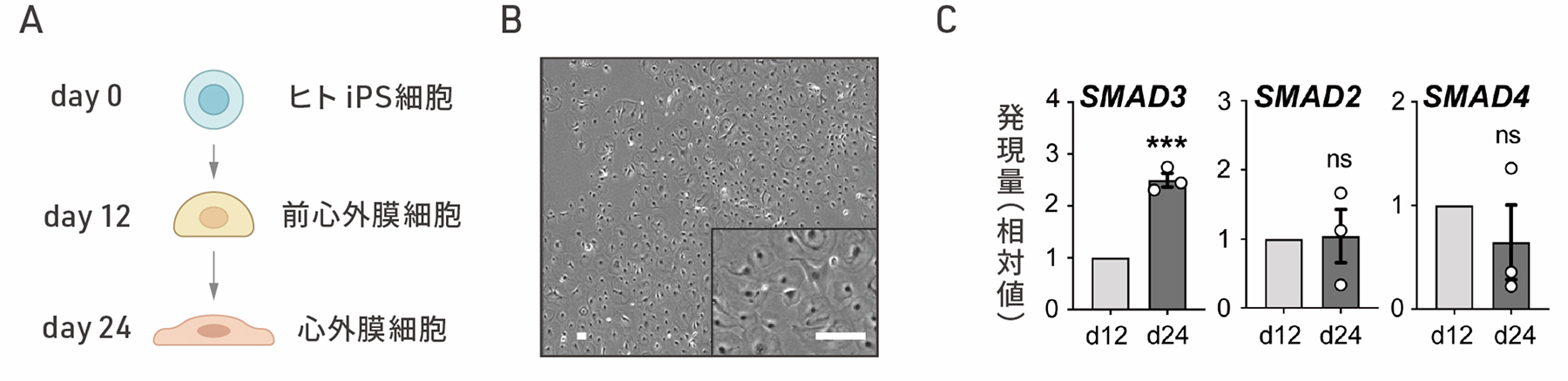
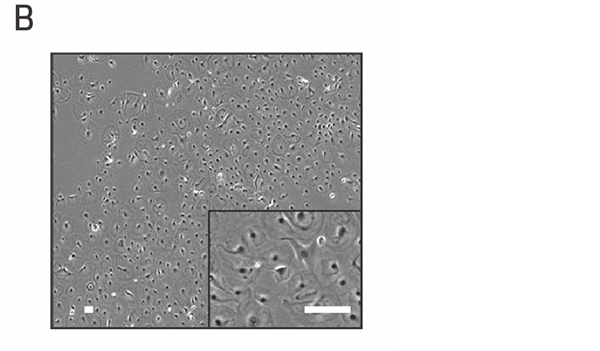
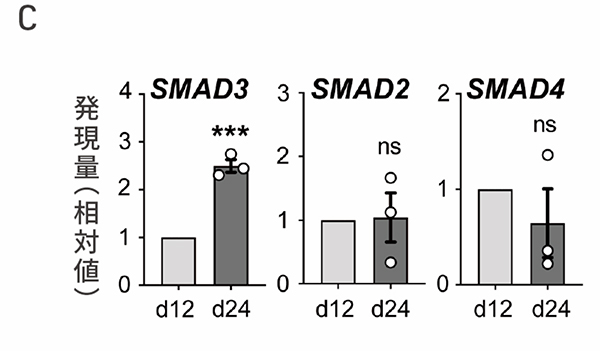
図1:ヒトiPS細胞から心外膜細胞への分化誘導
A:ヒトiPS細胞から心外膜細胞への分化誘導の概要図。12日目に前心外膜細胞となり、24日目に心外膜細胞へと分化する。
B:ヒトiPS細胞から作製した心外膜細胞(24日目)の顕微鏡画像。スケールバー(白色)は100μm。
C:ヒトiPS細胞から心外膜細胞への分化誘導12日目と24日目のSMAD3, SMAD2, SMAD4のmRNA発現の比較。
2)SMAD3の減少による心外膜細胞の変化
次に、ヒトiPS細胞から分化させた心外膜細胞におけるSMAD3の役割を調べました。ヒトiPS細胞から分化させて24日目の心外膜細胞に対して、一時的に特定の遺伝子発現を抑制することのできるsiRNAを用いて、SMAD3の発現を抑制し、細胞内のSMAD3を減少させました。その結果、siRNA処理後の時間経過に伴い、細胞の形態が紡錘形に変化しました(図2A)。さらに、遺伝子発現を調べたところ、上皮間葉転換のときにみられる遺伝子発現の変化が確認され、特に心臓周皮細胞に特異的な遺伝子の多くが発現上昇しました(図2B)。さらなる解析の結果、SMAD3の発現を抑制した細胞は、心臓周皮細胞の前駆細胞に似ていることがわかりました。また、この細胞の変化において、SMAD3のリン酸化状態は変化していなかったことから、従来とは異なる様式のSMAD3の上皮間葉転換の経路と考えられます。
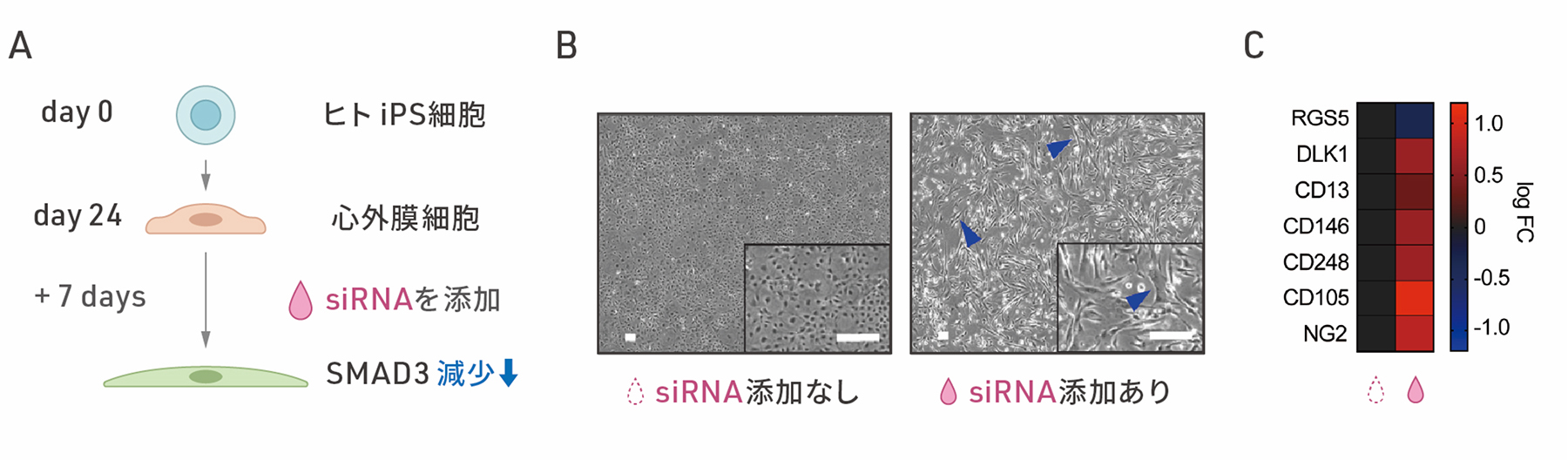
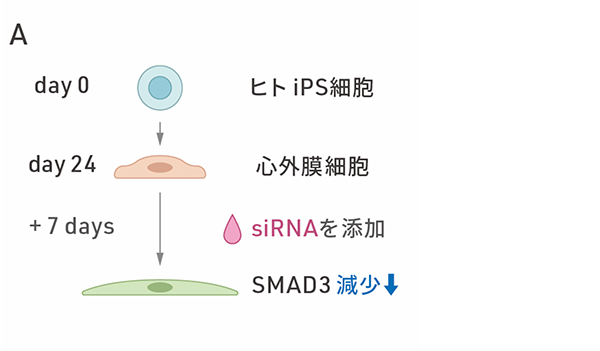
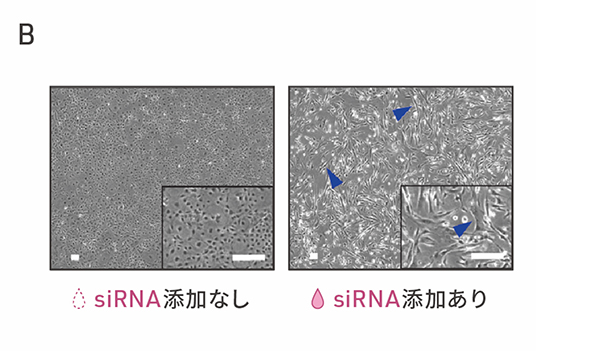
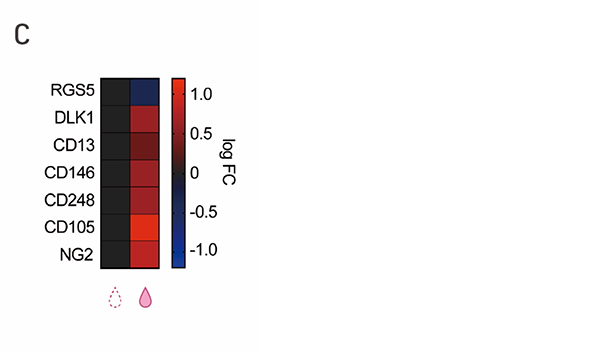
図2:SMAD3の減少による心外膜細胞の変化
A:siRNAを用いたSMAD3発現の抑制の概要図。
B:心外膜細胞におけるSMAD3発現の抑制による細胞の形態変化の顕微鏡画像。左はsiRNAを添加しない場合、右はsiRNAによりSMAD3発現を抑制して7日後の細胞の顕微鏡画像。スケールバー(白色)は100μm。
C:SMAD3発現を抑制して7日目の細胞における心臓周皮細胞マーカー遺伝子群のmRNA発現。左がsiRNAを添加しない場合、右がsiRNAを添加した場合。RGS5以外の遺伝子で発現上昇がみられた。
3)血管新生への作用の評価
心臓周皮細胞は、基底膜を隔てて心臓の血管内皮細胞に沿うように位置し、血管の構造の安定化や血管新生に寄与することが知られています(図3A)。SMAD3の発現を抑制した細胞が心臓周皮細胞のように血管新生の促進作用をもつかどうかを調べました。心外膜細胞にsiRNAを添加して8日目の細胞を血管内皮細胞と共培養したところ、細胞どうしの結合の数が増加しました(図3B,C)。siRNAを添加した細胞は、血管内皮細胞と物理的に相互作用し、血管新生に寄与することが示唆されました。
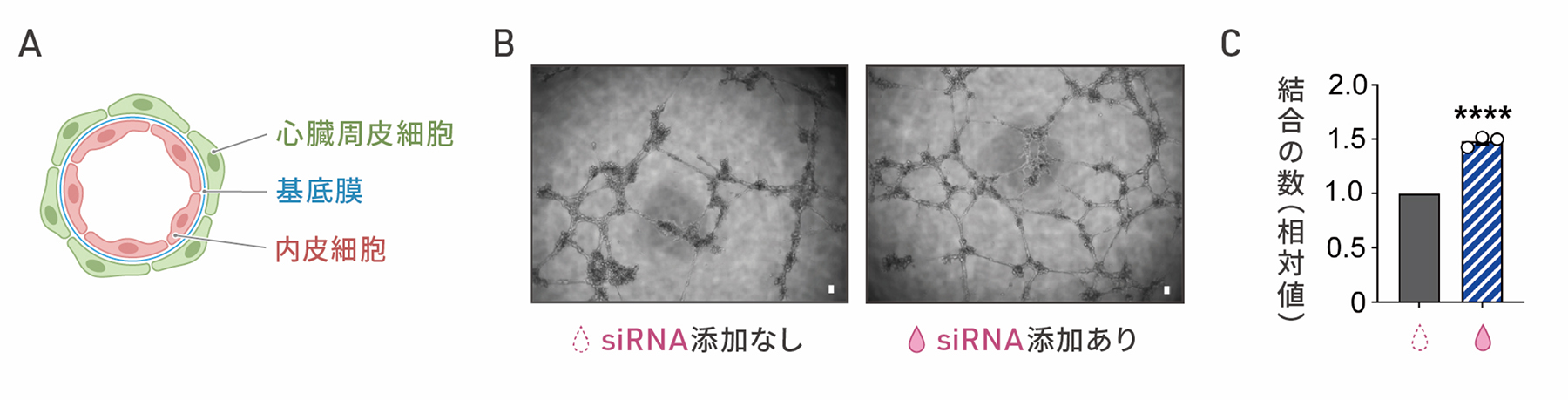
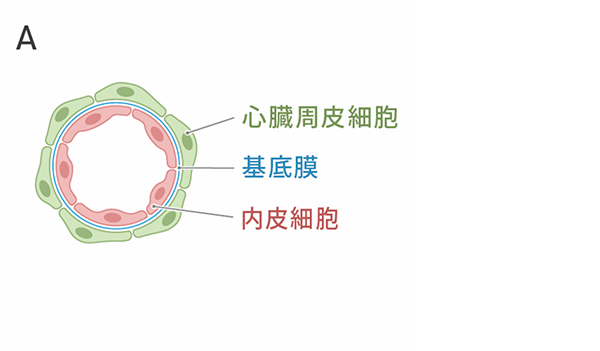
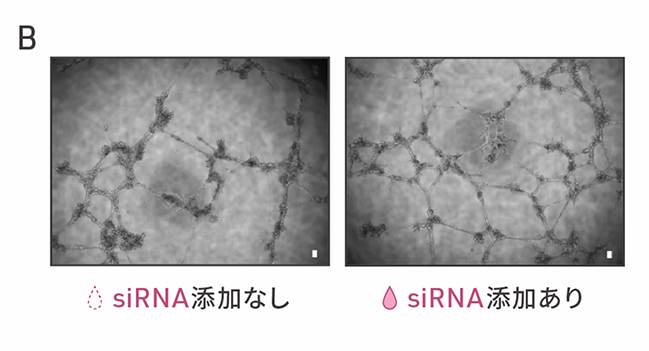
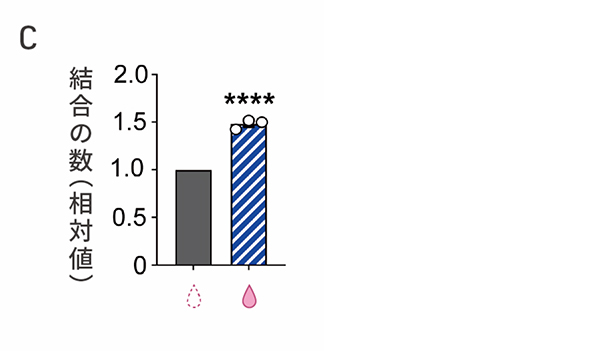
図3:SMAD発現を抑制した細胞の血管新生促進作用
A:生体内での血管内皮細胞と心臓周皮細胞の局在のイメージ図。
B:心外膜細胞と血管内皮細胞の共培養の顕微鏡画像。左がsiRNAを添加しない細胞との共培養、
右がsiRNAを添加した細胞との共培養の結果。スケールバー(白色)は100μm。
C:チューブ形成の定量評価。左がsiRNAを添加しない細胞、右がsiRNAを添加した細胞を共培養した場合。
4)心筋細胞への作用の評価
SMAD3の発現を抑制した細胞をさらに調べると、血管新生を促進するタンパク質VEGFAなどの分泌の増加が確認されました。研究グループは、SMAD3を減少させた細胞の分泌する物質が心筋細胞の細胞増殖を促進するパラクライン効果をもつかどうかを検証しました(図4A)。ヒトiPS細胞から作製した細胞周期を可視化できる心筋細胞に心外膜細胞からSMAD3を減少させた細胞の培養上清を添加したところ、緑色の蛍光で示される細胞増殖の活性化された心筋細胞が増加しました(図4B)。
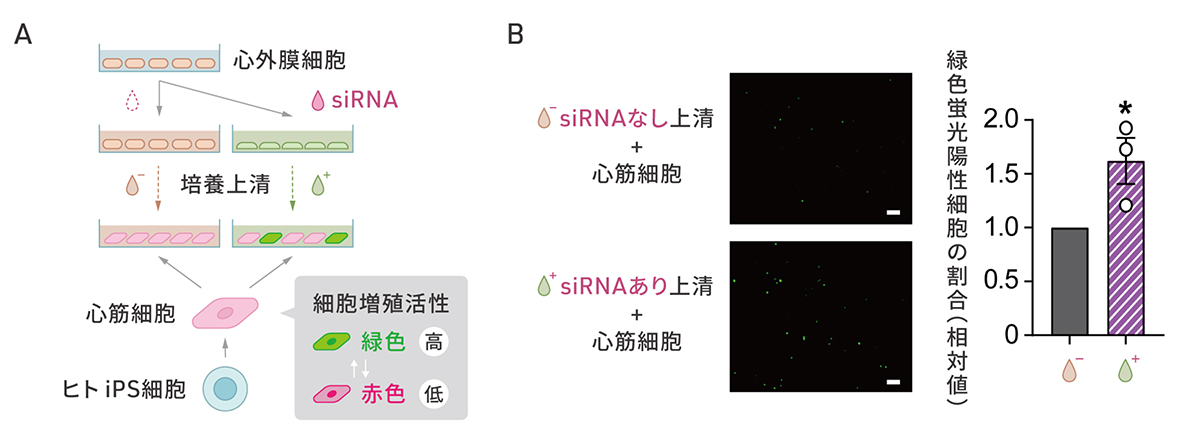
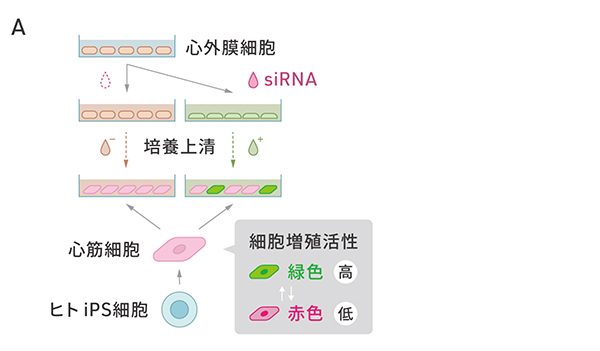
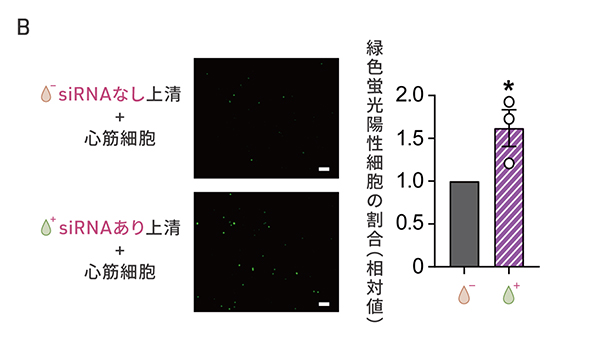
図4:SMAD3の発現を抑制した細胞の心筋細胞を増殖させる作用
A:心外膜細胞でSMAD3の発現を抑制した場合としない場合の培養上清が心筋細胞に与える効果の検証の概要図。細胞増殖が生じている細胞が緑色蛍光を発する心筋細胞を用いた。
B: SMAD3の発現を抑制しない場合の上清を添加した場合(画像上、グラフ左)に比べて、SMAD3の発現を抑制した場合の上清を添加した場合(画像下、グラフ右)で、緑色蛍光を発する心筋細胞の割合が増えている。スケールバー(白色)は100μm。
本研究では、ヒトiPS細胞から作製した心外膜細胞のSMAD3を減少させることで、心臓周皮細胞の前駆細胞の特徴をもつ細胞へと分化することを見出しました。さらに、SMAD3の減少により誘導された細胞は、生体由来の血管内皮細胞やヒトiPS細胞から作製した心筋細胞と相互作用し、それぞれ心臓の再生につながる作用を発揮しうることを確認しました。ヒトiPS細胞を用いて、さらに心外膜細胞の分子メカニズムを明らかにすることで、今後、新たなアプローチの心疾患の治療法にも応用可能な生物学的な知識基盤となることが期待されます。
- 論文名
SMAD3 mediates the specification of human induced pluripotent stem cell-derived epicardium into progenitors for the cardiac pericyte lineage - ジャーナル名
Stem Cell Reports - 著者
Yutaro Miyoshi1,3#, Antonio Lucena-Cacace1(研究当時),4(現在)*#, Yu Tian1,2, Yasuko Matsumura1, Kanae Tani1,2, Misato Nishikawa1, Megumi Narita1, Takeshi Kimura3, Koh Ono3, Yoshinori Yoshida1*
#:筆頭著者(共同)
*:責任著者(共同) - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院 医学研究科
- 京都大学大学院 医学研究科 循環器内科学
- 大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)
本研究は、下記機関より支援を受けて実施されました。
- Leducq Foundation(18CVD05)
- 日本学術振興会科研費(22K16137, 24K11267, 21H02912)
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム(JP19bm0104001, JP20bm0804022)
- 再生・細胞医療・遺伝子治療実現加速化プログラム(JP23bm1423011, JP23bm1323001)
- 医薬品等規制調和・評価研究事業(JP22mk0101189, JP220101241)
- 橋渡し研究プログラム(JP22ym0126091)
- iPS細胞研究基金
注1)心外膜
心臓の外表面を覆う膜。胎児期には心臓の細胞源になる。
注2)SMAD3
細胞内に存在し、上皮間葉転換におけるシグナル伝達を担うタンパク質。TGF-βというサイトカインを細胞が受け取った後、細胞内でリン酸化されたSMAD3が遺伝子発現を調整することなどを経て上皮間葉転換に関わる。
注3)心臓周皮細胞
心臓において血管壁を構成する血管内皮細胞を覆うように存在する細胞。周皮細胞は多くの器官に存在し、血管の脈管構造を安定化させたり、血管の形成(血管新生)を補助する。器官ごとに遺伝子発現などが異なる。
注4)上皮間葉転換
上皮細胞が間葉系細胞へと分化すること。臓器形成など発生の段階でよくみられる現象だが、成人の組織でも起こることがあり、組織の線維化や細胞のがん化に関わることが知られている。英語では、epithelial-to-mesenchymal transitionといい、EMTと略される。






















