
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年6月19日
新型コロナウイルスの翻訳阻害に耐性をもつ修飾mRNAの合成と排他的セレクタ遺伝子回路の構築
ポイント
- 新型コロナウイルス(SARS-CoV-2)の感染した細胞内でタンパク質合成(翻訳)を阻害するNsp1タンパク質に対して耐性をもつmRNAを合成した。
- mRNAにウイルスRNA由来の配列を取り入れ、ヌクレオシドに2つの化学修飾を付与することで、Nsp1タンパク質の翻訳抑制効果を回避することができた。
- Nsp1耐性のBarnase mRNAと過剰なNsp1感受性のBarstar mRNAを組み合わせることで、Nsp1タンパク質が存在するときにRNA分解による毒性を誘導する排他的セレクタ遺伝回路を構築した。
齊藤博英教授(京都大学iPS細胞研究所(CiRA)、東京大学定量生命科学研究所)、Malvin Leonardo Pardi大学院生(京都大学大学院医学研究科)らの研究グループは、新型コロナウイルスの翻訳抑制作用に対抗して安定的なタンパク質合成を可能とするmRNA注1)を合成しました。また、翻訳抑制を引き起こすNsp1注2)タンパク質に応答して細胞の選別が可能な「排他的セレクタ」の遺伝子回路を構築することに初めて成功しました。
外来遺伝子のゲノムへ挿入のリスクを伴わずに、遺伝子発現を誘導できるRNAスイッチは、生体内での状態に応じて働きを変える「人工遺伝子回路」を細胞内に構築する有望な材料として注目されています。特に人工的に化学修飾を付与した修飾mRNA(modRNA)注3)は、非修飾RNAのもつ免疫原性の課題を回避し、ウイルス感染の有無や細胞の状態に応じて治療薬の作用を切り替えることのできる、次世代のmRNA治療薬に役立つことが期待されています。
細胞内の状態に応じた遺伝子発現を実現する方法として、RNAと結合する特定のタンパク質によって遺伝子発現が制御されるタンパク質応答性RNAスイッチがあります。このようなRNAスイッチを複数組み合わせることによって、複雑な条件分岐をもつ人工遺伝子回路が構築でき、細胞の細かな状態に応じて、働きを変化させることができます。しかし、タンパク質応答性修飾mRNAスイッチの構築に適したRNA結合タンパク質とタンパク質結合RNA配列の組み合わせの数が限られており、mRNAベースの人工遺伝子回路を構築するうえでの課題となっていました。また、RNAスイッチでは、標的以外の遺伝子の働きだけを抑えることのできる「排他的セレクタシステム」が開発されていないことも課題となっていました。
本研究では、新型コロナウイルス(SARS-CoV-2)がもつ、宿主の細胞のタンパク質合成を阻害するNsp1タンパク質が細胞内に存在する状況でも、安定してタンパク質合成を誘導できる修飾mRNAを開発し、Nsp1応答性の排他的制御回路を構築しました。ウイルスRNA由来の5'非翻訳領域(5'UTR)注4)配列とヌクレオシドの修飾を組み合わせることで、Nsp1タンパク質のある細胞でも効率的に合成mRNAからタンパク質を産生させることに成功しました。
この有用性を実証するため、ヌクレオシド修飾の組み合わせを変えることでNsp1耐性/感受性を操作した2種類の修飾mRNAに、毒性タンパク質Barnaseと、その作用を打ち消す抗毒性タンパク質Barstarの遺伝子を組み込みました。Barstarは通常、Barnaseの毒性を中和しますが、SARS-CoV-2に感染した細胞で想定されるNsp1の存在下では、Barstarの翻訳が選択的に抑制されるため、Barnaseの作用が発現し、細胞内のタンパク質合成全体が停止します。この成果は、Nsp1による翻訳抑制に対して耐性をもつ修飾mRNAの開発と、それを活用したNsp1応答型の毒性制御システムの構築を意味しており、RNAベースのより複雑な遺伝子制御回路の設計に向けた新たな技術的基盤を提供するものです。
この研究成果は2025年6月6日に、国際学術誌「ACS Synthetic Biology」に掲載されました。
近年、修飾ヌクレオシドの発見により、様々な修飾mRNA(modRNA)を合成できるようになってきました。これらの修飾により非修飾のmRNAに起因する免疫反応を回避することで、外来遺伝子を導入するためのプラットフォームとしてmRNAが実用化されつつあります。これによって、ゲノムへの外来遺伝子の挿入リスクを回避しつつ、さまざまな入力因子に依存した複雑な生物学的応答を実行できるRNAベースの遺伝子回路の実現が期待されています。RNAベースの遺伝子回路の構築には、マイクロRNA(miRNA)やRNA結合タンパク質(RBP)といった生体分子が入力分子として利用されます。しかしながら、RNA結合タンパク質を用いた制御システムのほとんどは、入力分子とmRNAとの相互作用によってmRNAの発現を抑える「抑制型」の制御しか実現されていませんでした。つまり、入力の有無によってmRNA上の遺伝子の働きが"オフ"になる仕組みは存在していても、標的以外の遺伝子の発現を選択的に抑える「排他的セレクタ型」の仕組みは存在していませんでした。
新型コロナウイルス(SARS-CoV-2)は、宿主細胞の翻訳機構を阻害し、ウイルス由来のmRNAの翻訳を成立させる特異なメカニズムを持っています。この現象は、翻訳抑制因子であるnonstructural protein 1 (Nsp1)に起因します。Nsp1は、ウイルスRNAの翻訳開始領域に特有のRNA配列から形成される立体構造を認識し、ウイルスRNAの翻訳を可能にする一方で、宿主mRNAからの翻訳を選択的に抑制します。このため、Nsp1はmRNAによる「排他的セレクタ回路」を構築する新たな要素となる可能性が考えられます。しかし、Nsp1が修飾mRNAに対しても同様に機能するかどうかは、これまで明らかになっていませんでした。
1)SARS-CoV-2のNsp1に対する修飾ヌクレオシドの耐性の違い
はじめに、Nsp1タンパク質が修飾mRNAをどのように認識、分解するかを調べました。研究グループは、ウイルスRNAの5'末端側にある非翻訳領域5'UTR(sgUTR)をもち、細胞内に存在する化学修飾をもたない通常のヌクレオシド、またはシュードウリジン(Ψ)、N1-メチルシュードウリジン(m1Ψ)、5-メチルシトシン(m5C)などの各種の化学修飾を付与したヌクレオシドで構成されるmRNAを合成しました(図1A)。比較対象として、非ウイルス性5'UTR(nvUTR)をもち、同様の修飾または非修飾ヌクレオシドで構成される各種mRNAも合成しました。
これらのmRNAを細胞へ導入してNsp1を発現させたところ、ウイルスRNA由来5'UTR(sgUTR)をもつmRNAについて、シュードウリジン(Ψ)を含む修飾mRNA(sgUTR-modRNA)では、Nsp1に対する抵抗性は確認されず、Nsp1感受性があることがわかりました(図1B右、Ψ+CおよびΨ+m5C)。一方で、m1Ψとm5Cを含む修飾mRNAはどちらもNsp1抵抗性をもち、翻訳を誘導できることがわかりました(図1B右、U+m5Cおよびm1Ψ+C)。さらに、mRNAがm1Ψとm5Cをどちらも含む修飾mRNAが、Nsp1の翻訳抑制下で翻訳を維持するのに最も適していることも発見しました(図1B右、m1Ψ+m5C)。
対照的に、非ウイルス性の非翻訳領域をもつmRNA(nvUTR mRNA)では、構成するヌクレオシドの化学修飾の有無や種類によらず、Nsp1存在下で翻訳が抑制されました(図1B左)。以上の結果から、ウイルスRNA由来5'UTRをもち、m1Ψとm5Cを用いて合成した修飾mRNAを、Nsp1存在下でも翻訳活性をもつmRNAの基本的な設計として用いました。
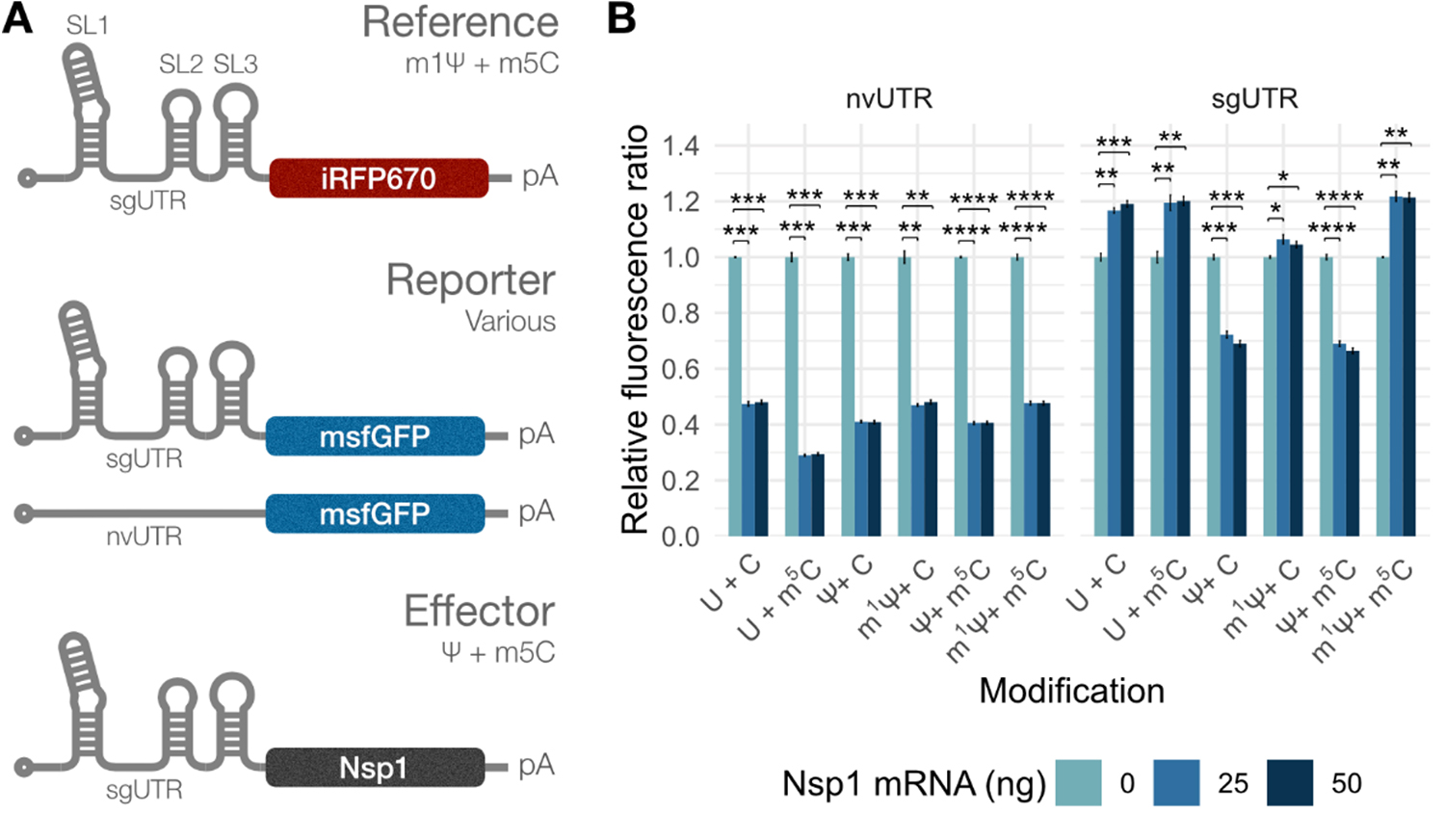
図1. ウイルスRNA由来5'UTR をもつsgUTR mRNAは、
ヌクレオシドの化学修飾によってNsp1抵抗性が異なる
A:レポーターmRNAの図解。
B:異なる修飾ヌクレオシドの組み合わせで合成したnvUTR/sgUTR-GFP mRNA、sgUTR-iRFP670 mRNA、および様々な量のnsp1 mRNAを共導入したA549細胞のGFP/iRFP670蛍光強度比の中央値。
有意水準: *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
2)Nsp1応答性排他的セレクタ遺伝子回路の構築
Nsp1耐性修飾mRNAの有用性を実証するため、Barnase(Bn)毒素の発現を誘導するNsp1耐性の修飾mRNAと、Barstar(Bs)抗毒素の発現を誘導するNsp1感受性の修飾mRNAを合成し、両者を同時に細胞に導入することでNsp1の有無に応じて働きを変える、Nsp1応答型の毒素-抗毒素系を構築しました。この回路では、通常の条件下ではBsがBnの毒性を中和します。一方で、Nsp1が存在する状態の細胞では、Bsの翻訳が選択的に抑制され、Bnの細胞毒性(RNA分解活性)が発揮されると予想されます。これにより、もともとNsp1タンパク質に耐性のあるウイルス由来のmRNAを含む細胞内のすべての翻訳活性が停止します(図2A)。
実際に、BnとBsによる毒素-抗毒素系を用いた場合のうち、Nsp1 mRNAを共導入した場合に、蛍光タンパク質のGFPの発現が阻害され、GFPによる蛍光強度比(毒素-抗毒素系:なし/あり)の値が高くなりました(図2B)。また、わずかなNsp1 mRNA量から容量依存的に蛍光強度比が変化することから、本システムがNsp1タンパク質を高感度に捉えていることがわかります。さらに、異なる複数の細胞株において安定して機能すること(頑健性)も実証しました。
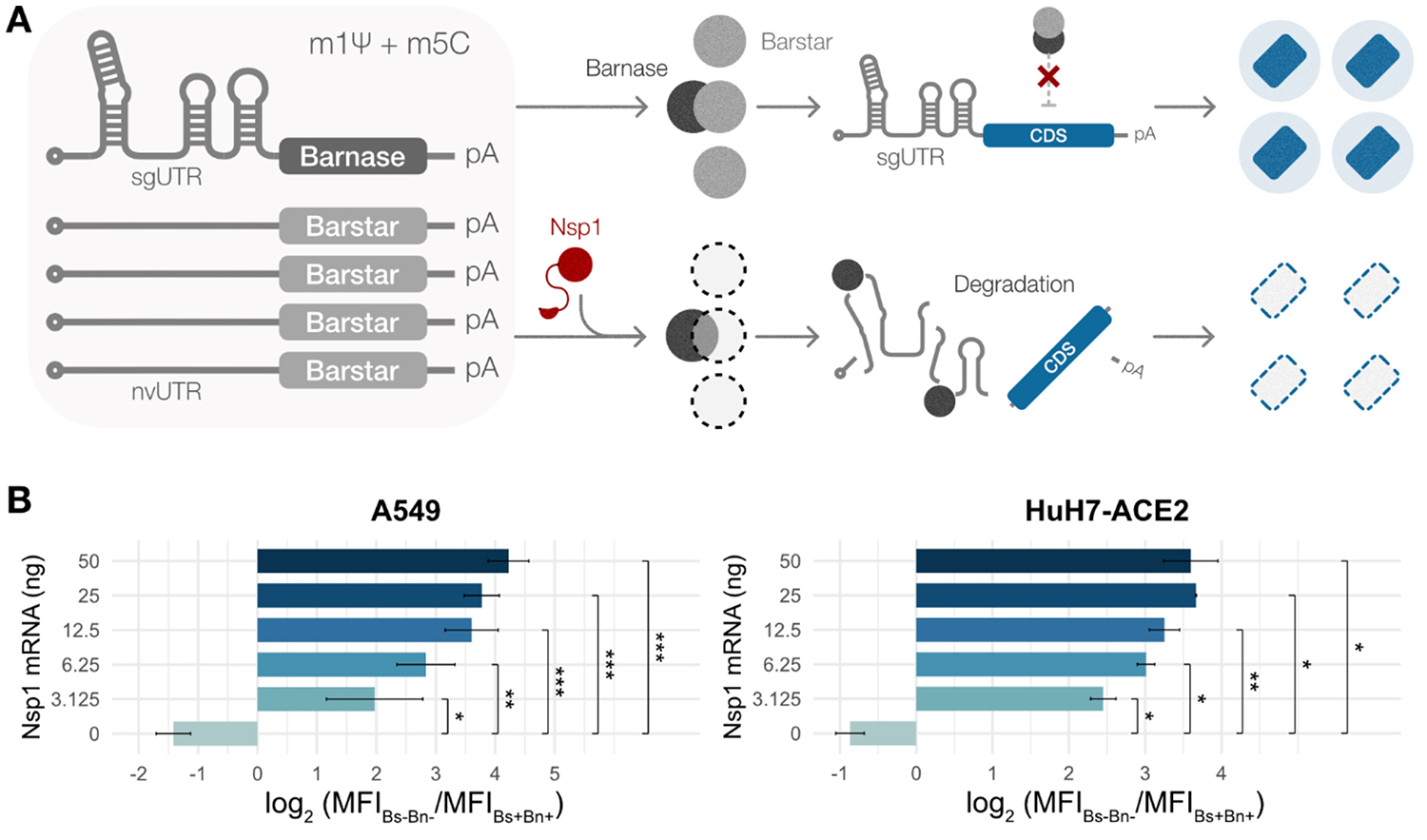
図2. Nsp1応答性Barnase-Barstar(Bn-Bs)mRNA系の特性解析
A:Nsp1応答性Bn-Bs mRNAシステムの図解。Nsp1が存在するとBarnase活性によりすべてのRNAが分解され翻訳が停止する。
B:A549細胞(左)とHuH-7-ACE2細胞(右)において、Nsp1 mRNAの量を変化させ、
Bs/Bn mRNA比を4:1にトランスフェクトした細胞の蛍光GFP強度比の中央値。
有意水準: *p < 0.05, **p < 0.01, ***p < 0.001
ウイルスの翻訳開始領域にみられるRNA配列にさまざまな修飾ヌクレオシドを組み込むと、翻訳抑制を誘導するNsp1タンパク質に対する感受性が大きく変化し、m5Cとm1Ψの2種類のヌクレオシド修飾の組み合わせによりNsp1耐性を強力に付与できることを明らかにしました。この修飾ヌクレオシドの組み合わせを用いてNsp1耐性修飾mRNAを合成し、Nsp1応答性の排他的セレクタ遺伝子回路を構築することができました。
-
本研究の重要性
本研究では、新型コロナウイルス(SARS-CoV-2)のNsp1タンパク質の活性を検出するシステムを確立しました。Nsp1タンパク質による翻訳阻害の仕組みは、新型コロナウイルスを含むベータコロナウイルスの系統で保存されていることから、コロナウイルスNsp1を介した翻訳を広く検出できる可能性が考えられます。さらに、Nsp1タンパク質のもつRNAとの相互作用の特性をmRNA技術に応用することで、一部の遺伝子を除いて遺伝子発現を不活性化できる「排他的セレクタ回路」を本研究で初めて構築し、より精巧な遺伝子回路を構築するための合成生物学ツールとして有用であることを実証しました。 -
社会的インパクト
感染初期に合成されるウイルスタンパク質を検出できるシステムの構築により、細胞内での感染状況の監視やウイルス増殖抑制が可能となり、研究・治療目的の感染指標となります。これは、より効果的な抗コロナウイルス治療薬の開発にも役立つと考えられます。さらに、mRNAの転写後調節を可能とする合成生物学ツールとして、本成果が加わることで、細胞内の状態に応じて機能するmRNAをベースとしたより精巧な治療技術の開発に寄与し、mRNAプラットフォームが、感染症予防だけでなく新たな治療薬にも広がっていく一助となることが期待されます。
また、パンデミックの主要原因から合成生物学的要素を開発することは、自然現象を公共の利益のために利用することによる基礎研究の重要性を示す例とも言えます。 -
今後の展望
今後は、本研究で開発した技術のさらなる改良に取り組むほか、他のウイルス由来のRNA相互作用や生物工学的手法を活用した人工遺伝子回路のセレクター系構築につなげることが期待されます。この新しいシステムは、遺伝子回路構築のための転写後制御ツールキットの拡張に貢献し、治療やその他の生物学的目的での利用の可能性を広げることが期待されます。
- 論文名
SARS-CoV-2 Nsp1-resistant modified RNA for the creation of Nsp1-responsive systems - ジャーナル名
ACS Synthetic Biology - 著者
Malvin Leonardo Pardi1,2, Kazuo Takayama1, Hirohide Saito1,2,3*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 東京大学定量生命科学研究所
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)(20H05626)
- 関西経済連合会
- 京都大学iPS細胞研究所山中伸弥研究室への新型コロナウイルス特別研究助成
注1)mRNA
メッセンジャーRNA。細胞内でタンパク質が合成される際にアミノ酸配列を指定する役割を持つ。DNA上の遺伝子情報はメッセンジャーRNAに転写された後メッセンジャーRNAからタンパク質へと翻訳され、細胞内で機能する。
注2)Non-structural protein 1(Nsp1)
SARS-CoV-2のタンパク質で、ウイルスRNAの翻訳を可能にする一方で、宿主細胞RNAの翻訳抑制因子として機能する。
注3)修飾mRNA(modRNA)
天然に存在するmRNAにはみられない化学修飾を施した合成mRNA。mRNAワクチンの主成分として最もよく知られているこの化学修飾は、細胞の免疫システムの活性化を抑制することにより、mRNAの効率的な翻訳を可能にする。
注4)5'非翻訳領域(5'UTR)
タンパク質をコードする領域の前にあるmRNAの非翻訳部分。遺伝子の発現速度を制御する配列特徴を含んでいる可能性がある。






















