
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月1日
新たなRNA技術「スプリットRNAスイッチ」の開発
―特定の細胞を標的とした遺伝子発現制御の正確性を大幅に向上―
ポイント
- RNAスイッチを複数利用して1つの遺伝子の発現制御を行う技術「スプリットRNAスイッチ」を開発した。
- メッセンジャーRNA(mRNA)の導入のみで、標的細胞を正確に識別し純化することや、細胞種特異的にゲノム編集を誘導することに成功した。
- 2種類以上の生体分子(マイクロRNA、タンパク質)の同時検出をmRNAの導入のみで実現した。
齊藤博英教授(京都大学iPS細胞研究所(CiRA)、東京大学定量生命科学研究所(IQB))、大野博久助教(CiRA)、阿部一樹大学院生(京都大学大学院医学研究科、東京大学IQB)らのグループは、細胞の状態に応じて遺伝子発現を誘導できるRNAスイッチ注1)の精度を高める技術の「スプリットRNAスイッチ」を新たに開発しました。本技術により、医療応用を含めた幅広い用途で、高精度で、より汎用性の高い遺伝子発現制御が可能となります。
iPS細胞はさまざまな細胞に分化する能力をもちますが、分化誘導では目的の細胞以外の細胞も含まれており、細胞種ごとの解析や特定の細胞の移植などのために、細胞を選別・純化する操作が必要となることがあります。
研究グループは、これまでに、遺伝子発現を制御する標的となる細胞に存在するmiRNAやタンパク質などの生体分子を認識して遺伝子発現を抑制するOFF型RNAスイッチ(CiRAニュース2015年5月22日)と、遺伝子発現を誘導するON型RNAスイッチ(CiRAニュース2022年1月6日)を開発しています。さらに、このRNAスイッチを用いて、細胞の種類によって培養皿上で選別を行うことに成功しています。
しかし、従来のON型のRNAスイッチでは、遺伝子発現を誘導する生体分子が存在しない細胞でも、RNAスイッチからタンパク質がある程度合成されてしまう「翻訳漏洩」注2)が起きることがわかっていました。特定の種類や状態の細胞に対して選別を行ったり、ゲノム編集を行う場合、目的外の細胞の残存や標的外の細胞のゲノム改変が起きてしまうと、安全性や品質に懸念が生じるため、翻訳漏洩は実用上の課題となっていました。
本研究では、タンパク質合成(翻訳)後にタンパク質同士が相互作用して機能するタンパク質をつくる「プロテインスプライシング」注3)という酵母で発見された生命現象をRNAスイッチ技術と組み合わせることで、「翻訳漏洩」の改善に取り組みました。その結果、標的とする細胞をより高精度に区別することに成功し、特定の細胞へのゲノム編集や細胞選別などに有用であることを示しました。
また、本技術は、複数のRNAスイッチから1つの出力(タンパク質合成)を得られるため、1つの生体分子で特異的に細胞種を特定することが困難な場合にも、複数の生体分子を認識するRNAスイッチを組み合わせることで細胞識別が可能となります。このことから、細胞特異的な遺伝子発現誘導の設計における汎用性を高め、RNAスイッチの応用の幅をさらに広げる技術としても役立つことが期待されます。
この研究成果は2025年7月1日(英国時間)に、国際科学誌「Nature Communications」でオンライン公開されました。
mRNAは、細胞内でゲノムを傷つけることなくタンパク質の合成を誘導させることができるツールとして注目されています。研究グループは、合成したmRNAを細胞内に導入し、細胞内に存在するタンパク質やマイクロRNA(miRNA)注4)と相互作用することで遺伝子発現を促進 (ON型)/抑制 (OFF型) するRNAスイッチ技術を多数開発しています。
遺伝子治療や再生医療など、特定の細胞でのみ遺伝子発現を誘導するためには、標的細胞のみに作用することや、目的外細胞を正確に区別することが安全性の観点から重要です。しかし、従来のON型のRNAスイッチ技術は、細胞内でRNAスイッチと反応するタンパク質やmiRNAが存在しない状況でも、遺伝子発現が成立してしまう「翻訳漏洩」がみられ、医療への応用のための課題となっていました。
そこで本研究では、翻訳漏洩を改善する新たなRNAスイッチの開発に取り組みました。この課題を克服するため、研究グループはプロテインスプライシングという酵母で最初に発見された生命現象に着目しました。プロテインスプライシングは、「インテイン」という特殊なタンパク質が自身を切り出し、残りの部分を再結合する反応です。
研究グループは、複数のRNAスイッチから作られる翻訳産物がプロテインスプライシングにより単一のタンパク質として機能し、目的の細胞でのみ活性型のタンパク質が作られる「スプリットRNAスイッチ」システムを構築しました。これにより、目的外の細胞では、翻訳漏洩した翻訳産物であるタンパク質断片が、不活性型タンパク質となり、翻訳漏洩の作用を無効化することに成功しました。
1)プロテインスプライシングを活用したスプリットRNAスイッチの設計
研究グループは、プロテインスプライシングという機構をRNAスイッチと組み合わせたスプリットRNAスイッチを考案しました(図1)。ベースとなるスプリットRNAスイッチでは、miRNAやタンパク質など、特定の生体分子(標的分子)を認識し遺伝子発現を誘導するON型RNAスイッチ(ONスイッチ)を2つ用います(上部)。スプリットRNAスイッチを構成する個別のRNAスイッチは、標的細胞で発現を誘導したいタンパク質(POI(Protein Of Interest)、目的タンパク質)を分割した断片を作る遺伝子をもち、miRNAに応答して発現します。タンパク質断片をコードするRNAスイッチ上の遺伝子配列には、それぞれ完全長タンパク質となるための接合部分に「インテイン」断片の配列を付加します。これによって、インテインの断片どうしが反応して2種類のタンパク質断片どうしを結合させるプロテインスプライシングが誘導されます(下部)。
それぞれのRNAスイッチから合成された目的タンパク質(POI)の断片が、単独では働きをもたないようにタンパク質を分割することにより、2つのRNAスイッチが両方とも作動した場合に初めて、活性型の目的タンパク質が合成されます。
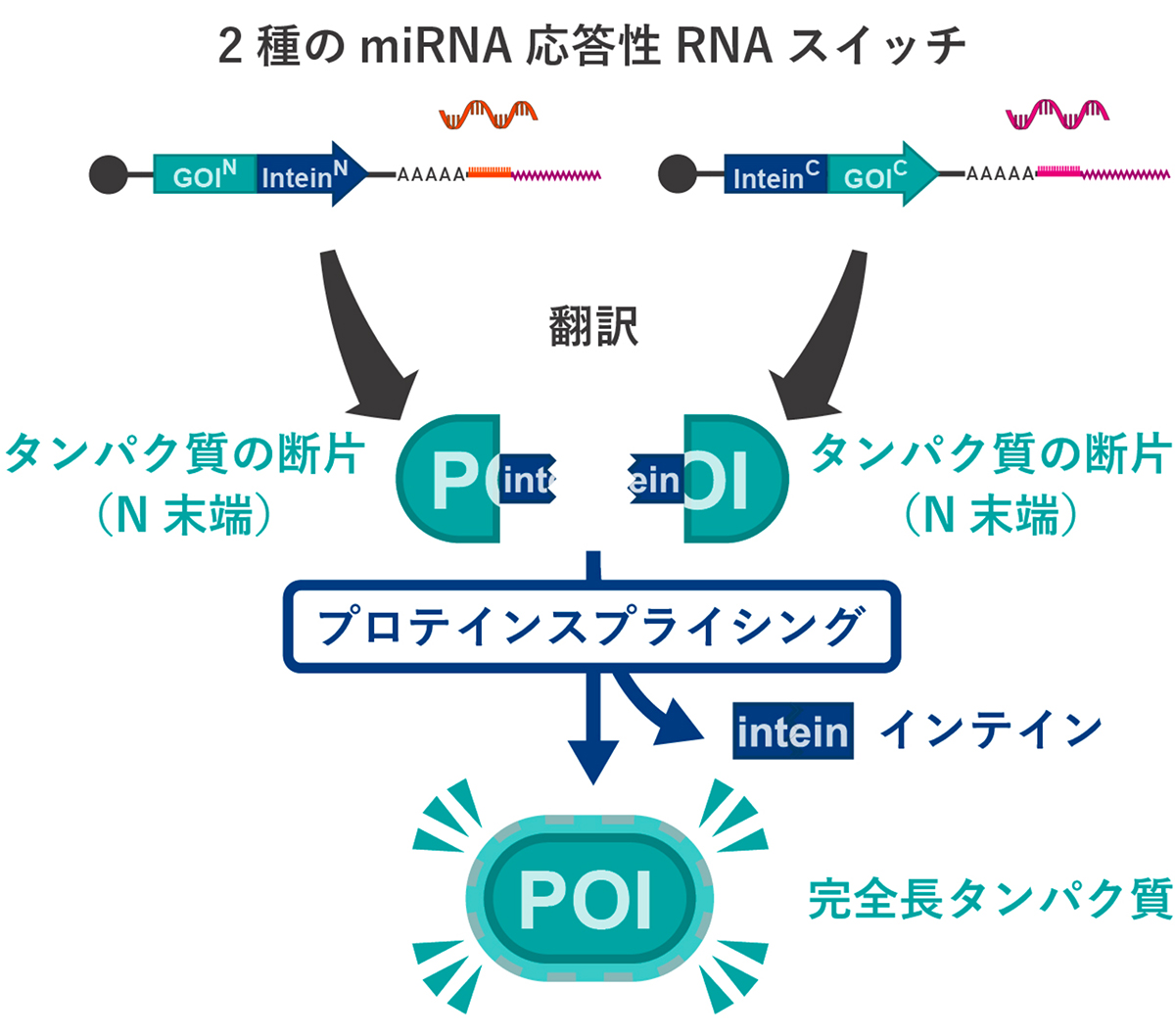
図1. プロテインスプライシングを活用したスプリットRNAスイッチ
2)標的分子がない細胞での「翻訳漏洩」を改善するスプリットRNAスイッチの構築
次に、スプリットRNAスイッチの仕組みを利用して、標的以外の細胞での翻訳漏洩を無効化し、標的細胞のみで機能的な活性をもつ目的タンパク質(POI)を誘導するシステムの構築に取り組みました。これを可能とするため、RNAスイッチが認識する生体分子が存在しないときに遺伝子発現を誘導する「OFF型RNAスイッチ(OFFスイッチ)」を利用します。研究グループは、OFFスイッチに、機能をもたないタンパク質断片とインテインの断片をつないだ遺伝子を組み込みました。
このOFF型RNAスイッチから作られるタンパク質断片(C末端側)と、結果1)で設計したONスイッチの一方から作られる正常なタンパク質断片(N末端側)は、インテインを介してプロテインスプライシングを引き起こし、機能的に不活性なタンパク質を作ります(図2A)。
翻訳漏洩が問題となるのは、RNAスイッチに結合する生体分子がない状態の「標的ではない細胞」です(図2A上)。この状態の細胞では、翻訳漏洩によりONスイッチから正常なタンパク質断片が合成されます。しかし、対照的に同条件で遺伝子発現が誘導されるOFFスイッチからは、変異型タンパク質断片が合成されます。この2つの断片が、共にインテイン断片をもつので、プロテインスプライシングによって結合して、機能的な活性をもたないタンパク質が作られます。この一連の反応により、標的外細胞での翻訳漏洩の無効化が実現します。
一方、RNAスイッチの認識する生体分子をもつ標的細胞では、生体分子を認識してOFFスイッチからの変異型タンパク質断片の合成が抑制されることにより、活性型の目的タンパク質(POI)が生成されます(図2A下)。
実際に、ON型とOFF型を組み合わせたスプリットRNAスイッチを細胞に導入した場合、標的の細胞に対して、標的ではない細胞で目的タンパク質(POI)の生成を有意に抑えることができました。
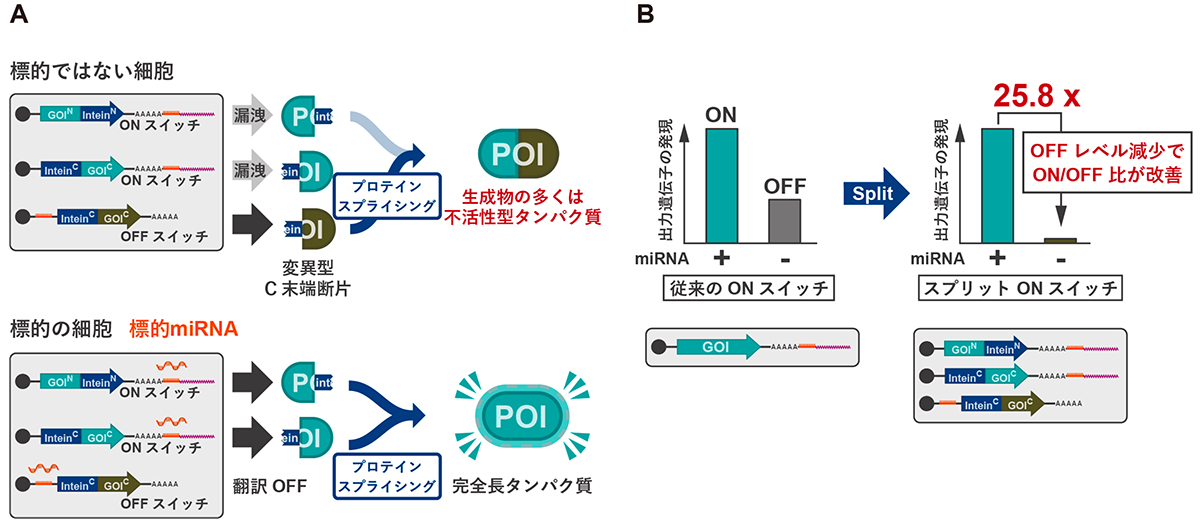
図2. 標的分子がない場合の翻訳漏洩を改善するスプリットRNAスイッチ
A:翻訳漏洩を改善するスプリットRNAスイッチの設計としくみ
B:AのスプリットRNAスイッチを細胞に導入した結果(右)、従来のRNAスイッチ(左)と比べて、RNAスイッチの認識する生体分子をもたない標的でない細胞(miRNA(-))で、活性型タンパク質の発現が抑えられた。
3)スプリットRNAスイッチを用いた細胞の選別
次に、結果2)で構築した翻訳漏洩を無効化するスプリットRNAスイッチシステムを用いて、複数種の細胞から特定の細胞のみを選別する実験を行いました。研究グループは、特定のmiRNA(miR-21-5p)を認識して、抗生物質に対する耐性を獲得するタンパク質(薬剤耐性タンパク質)の生成が誘導されるスプリットRNAスイッチを構築しました(図3上)。
miR-21-5pをもつ標的細胞では、OFFスイッチの変異型タンパク質断片の発現が抑制され、薬剤耐性タンパク質が誘導されます。その結果、抗生物質を添加したときに薬剤耐性タンパク質をもつ標的細胞が生き残ります。もし、翻訳漏洩があると、miR-21-5pをもたない標的以外の細胞でも薬剤耐性タンパク質が誘導されてしまいます。その結果、翻訳漏洩が原因となり、標的以外の細胞も生き残ってしまい標的細胞の効率的な選別ができなくなります。
miR-21-5pが存在するHeLa細胞(標的細胞)と、miR-21-5pが存在しないHEK293FT細胞(標的外細胞)の2種類の細胞を共培養し、標的細胞で薬剤耐性タンパク質の生成を誘導する従来型のON型スイッチとスプリットRNAスイッチの2種を比較しました。その結果、抗生物質を添加すると、スプリットRNAスイッチを導入した場合に標的細胞を効率よく選別できることが示されました(図3下)。
このシステムを応用することで、従来、iPS細胞から分化誘導して得られた複数種類の細胞からフローサイトメトリー注5)で選別していた過程を、培養皿で実現することが可能になります。
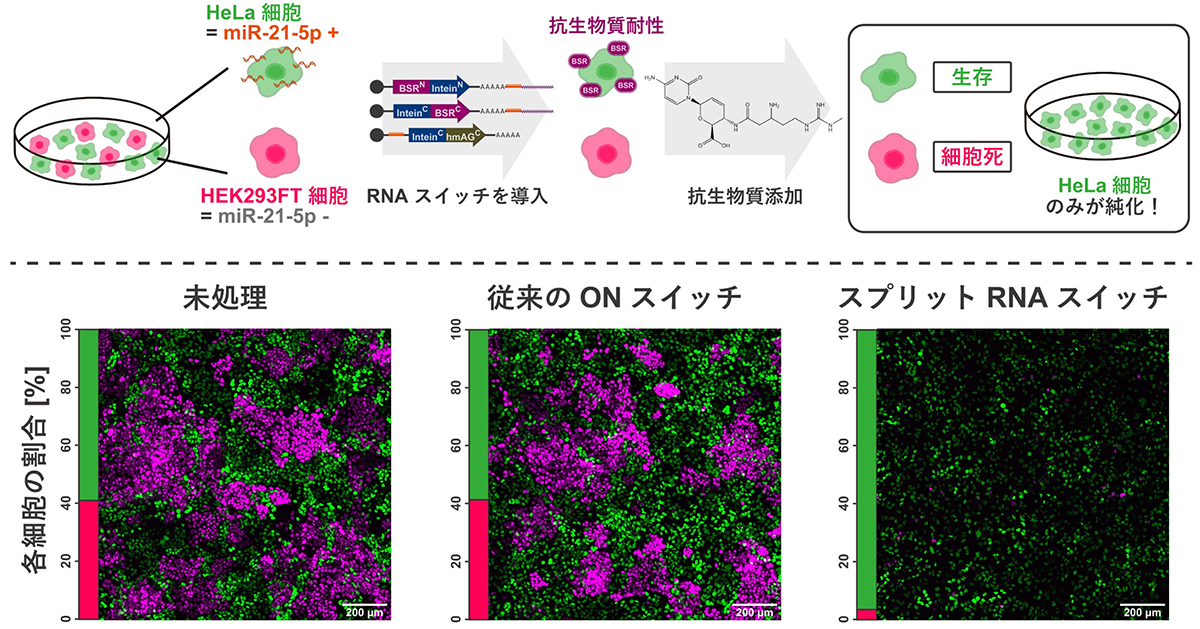
図3. スプリットRNAスイッチを用いた細胞の選別
4)スプリットRNAスイッチを用いた細胞種特異的なゲノム編集
次に、ゲノム編集に広く用いられているCas9タンパク質注6)を誘導するスプリットRNAスイッチを構築しました。Cas9はガイドRNAと呼ばれる短いRNAと共に、細胞核内のゲノムDNA上の特定の部位に移行し、DNAを切断します。ガイドRNAは、特定のゲノム配列を認識することで、ゲノム編集の部位を自由に設計することが可能です。
miR-21-5pを認識し、Cas9タンパク質の合成を誘導するスプリットRNAスイッチと、ゲノム上の変異遺伝子を認識するガイドRNAを細胞に共導入しました。その結果、従来のRNAスイッチと比較して、スプリットRNAスイッチでは、miR-21-5pが存在しない標的外細胞で誤ってゲノム編集が起きてしまう割合が非常に低く抑えられました。
遺伝子治療では、標的細胞で選択的に遺伝子の修復が誘導され、標的ではない細胞には影響を与えないことが、治療の安全性のために重要です。実験結果からスプリットRNAスイッチを用いることで、より正確に標的細胞に限定して遺伝子修復することが可能になると考えられます。
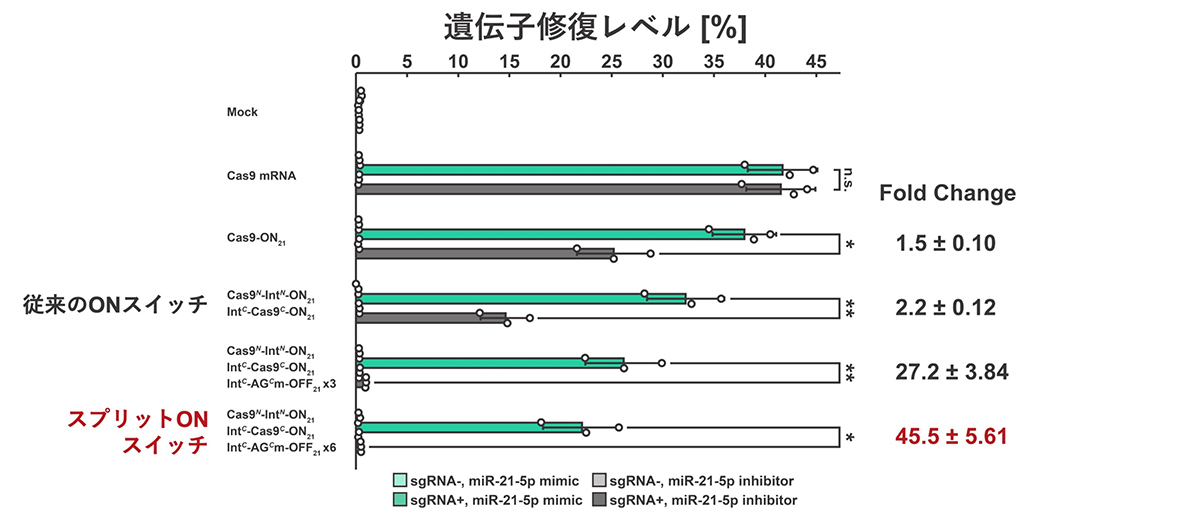
図4. スプリットRNAスイッチを用いた細胞種特異的なゲノム編集
5)細胞特異性の設計自由度を高める、複数の標的分子を認識する多入力システムの構築
これまでのRNAスイッチの多くは、標的細胞に特異的なmiRNAやタンパク質などの生体分子が前提となっています。しかし、実際には、複数種類の細胞群のうち目的の細胞で特異的に発現する単一の生体分子を同定することが難しい場合もあります。そこで、研究グループは、スプリットRNAスイッチを構成する各RNAスイッチが異なるmiRNAを認識し、その生体分子の有無の組み合わせによって目的タンパク質の合成が成立するシステムを考案しました(図5)。
実際に、2種類のmiRNA(miR-21とmiR-302)を認識して、目的タンパク質のN末端断片とC末端断片をコードするONスイッチの組み合わせを作り、さらに、翻訳漏洩の効果を抑えるため、それぞれのmiRNAを認識して、変異型タンパク質断片をコードする2種類のOFF型RNAスイッチを作りました。このスプリットRNAスイッチを、2種類の標的分子がともに存在する細胞、どちらか一方のみが存在する細胞、どちらも存在しない細胞の計4種類の状態の細胞に導入しました。その結果、標的分子が2種類とも存在する細胞においてのみ有意に目的タンパク質を生成するシステムであることが確認されました。
この方法を応用すると、ONスイッチとOFFスイッチの組み合わせを変えることで、生体分子Aが存在し、生体分子Bが存在しない細胞を標的細胞とすることなども可能となります。複数の標的分子(入力)を認識して、目的タンパク質(出力)を生成することのできる多入力システムは、細胞の選別や遺伝子編集を行う標的細胞の特異性をより柔軟に設計できる利点をもちます。
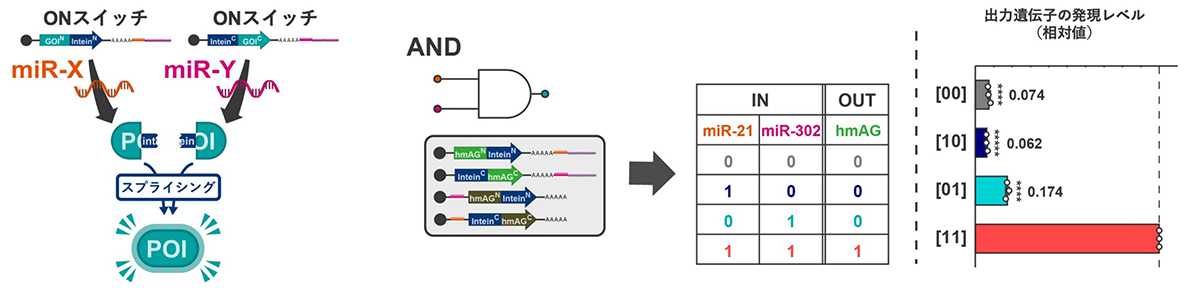
図5. 複数の標的分子を認識する多入力システムの構築
本研究では、プロテインスプライシングの仕組みを利用してRNAスイッチの翻訳漏洩を改善し、ゲノム編集や細胞選別に応用できることを示しました。今後、高い安全性の求められる遺伝子治療の技術開発や再生医療用の細胞製造に対して、RNAスイッチ技術を応用することに役立つ重要な成果です。また、複数のRNAスイッチを統合して、1つのタンパク質の合成(出力)を誘導できることから、複雑な条件設定のもとで動作する人工遺伝子回路の構築にも使える強力なツールとなることが期待されます。
- 論文名
Split RNA switch orchestrates pre- and post-translational control to enable cell type-specific gene expression - ジャーナル名
Nature Communications - 著者
Itsuki Abe1,2,3,4, Hirohisa Ohno1*, Megumi Mochizuki1, Karin Hayashi1, Hirohide Saito1,3*
*:共同責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院 医学研究科
- 東京大学定量生命科学研究所(IQB)
- 東京大学大学院 工学系研究科
本研究は、下記機関より支援を受けて実施されました。
-
日本学術振興会(JSPS)
- 科研費(JP20H05626, JP20H05701, JP20K12644, JP25H00970, JP25K03464)
- 特別研究員奨励費(JP25KJ1485)
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
「糖尿病根治を目指したMYCLによるリプログラミングを介した膵島再生医療の開発」- 再生・細胞医療・遺伝子治療実現加速化プログラム
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」
「次世代mRNAテクノロジーを活用した細胞・遺伝子治療技術の開発」 - 科学技術推進機構(JST)戦略的創造研究推進事業CREST(JPMJCR23B3)
- 京都大学2023年度いしずえ
- 公益財団法人稲盛財団 稲盛研究助成
- iPS細胞研究基金
注1)RNAスイッチ
特定の生体分子(マイクロRNAやタンパク質など)を認識し、遺伝子発現をON/OFFのように制御する人工的なRNA分子。
注2)翻訳漏洩
RNAスイッチによって遺伝子発現が抑制されている状態の細胞においても、完全に抑制されず、ある程度のタンパク質が合成されてしまう現象。
注3)プロテインスプライシング
独立した2つのタンパク質断片が、それぞれに含まれる「インテイン」という特殊なタンパク質断片を介して結合し、機能的な1つの完全長タンパク質になる生命現象。酵母で発見された。
注4)マイクロRNA(miRNA)
約22塩基の短いRNA分子で、遺伝子発現を抑制する機能をもつ。
注5)フローサイトメトリー
細胞にレーザー光を当て、散乱光や蛍光を検出することで、細胞の数や種類、特定の分子の発現などを解析・選別する技術。
注6)Cas9タンパク質
ゲノム編集技術CRISPR/Cas9システムにおいて、ガイドRNAと協調してDNAを切断する酵素タンパク質。






















