
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月11日
マウスモデルで細胞老化のメカニズムに迫る
老化細胞が周囲の細胞に与える影響
ポイント
- マウスモデルを用いて、生体内で老化細胞が周囲の細胞に及ぼす影響を明らかにした。
- 生体内における細胞老化は、組織や誘発する要因によって多様な反応を示すことを明らかにした。
- 本研究で開発したマウスモデルは、個体レベルでの老化研究に貢献することが期待される。
曽我部裕子研究員 (CiRA未来生命科学開拓部門、京都大学大学院医学研究科)、山田泰広教授(東京大学大学院医学系研究科)、山本拓也教授(CiRA未来生命科学開拓部門、京都大学ASHBi、理化学研究所AIP)らの研究グループは、細胞老化注1)が誘導された細胞(以下、老化細胞)が体内で周囲の細胞に与える影響について、その詳細なメカニズムを明らかにしました。
これまで、培養細胞を用いた研究では、老化細胞が分泌する物質(SASP:senescence-associated secretory phenotype注2))が周囲の正常細胞の細胞老化を誘導することが示唆されていました。しかし、体内の組織において、わずかな数の老化細胞がどのようにして全身の個体老化に寄与するのか、その詳細は明らかになっていませんでした。
本研究では、特定のシグナル伝達経路を人為的に活性化し、生体内で老化細胞を可視化・追跡できる新たなマウスモデルを開発しました。このモデルを用いて、細胞老化が個体の加齢現象と密接に関連していることを明らかにしました。さらに、細胞老化の様態は組織の種類や誘発因子によって異なること、同じ種類の細胞であっても多様な反応を示すことを発見しました。特に肝臓においては、マクロファージ注3)が分泌する炎症性サイトカイン(IL-1B)が周囲の細胞の細胞老化を促進すること示し、細胞老化の伝播メカニズムの一端を解明しました。
本研究で開発したマウスモデルは、生体内における細胞老化の動態を個体レベルで解析・操作できる強力なツールであり、細胞老化の基本原理の理解と、老化関連疾患に対する新たな治療戦略の基盤となることが期待されます。
この研究成果は2025年7月11日18:00(日本時間)に「Nature Aging」で公開されました。
細胞が、がん遺伝子の活性化、DNA損傷、複製ストレスなどさまざまなストレスを受けると、CDKN(サイクリン依存性キナーゼ阻害因子)注4)が蓄積し、不可逆的に細胞周期が停止する「細胞老化」が誘導されることが知られています。細胞老化は、損傷した細胞の増殖を防ぐ腫瘍抑制メカニズムとして機能する一方で、加齢に伴う多くの疾患にも関与していることが報告されています。また、発生初期の胚形成期においても、細胞老化に類似した現象が観察されており、細胞老化が単なる防御反応にとどまらず、多岐にわたる生物学的機能を持つことが示唆されています。
老化細胞は、主に転写因子NFκBシグナル注5)によって制御される「細胞老化随伴分泌現象(SASP)」と呼ばれる特徴的な状態を呈し、さまざまな生理活性物質を分泌します。これらの因子は、老化細胞自身の性質を変化させるだけでなく、周囲の細胞に対しても細胞老化を誘導する作用があることが知られています。SASPは、細胞の可塑性の向上、組織修復の促進、創傷治癒、免疫細胞による前がん細胞の監視など、多様な生物学的機能と関連することが報告されています。
しかし、加齢した個体の臓器内に存在する老化細胞はごくわずかであることから、その正確な同定と特徴の解明は困難でした。そのため、個体老化に伴う生理学的・病理学的変化と細胞老化との具体的な関係性を明らかにすることは、依然として大きな研究課題となっています。
本研究グループは、細胞老化に関与する2つの主要なシグナル伝達経路であるERKおよびp38 MAPK経路注6)を恒常的に活性化することにより細胞老化を生体内で誘導できる2種類の新しいマウスモデルを開発しました。このマウスモデルは、がん遺伝子誘発性細胞老化(OIS)およびストレス誘発性細胞老化(SIS)を可視化・追跡できる画期的なシステムです。この新たなマウスモデルを用いることで、老化細胞の特徴的な遺伝子発現パターンを生体内で詳細に解析することが可能となり、ヒトやマウスで観察される個体老化と類似した分子的特徴を再現することに成功しました。これらの成果は、個体老化における細胞老化の生理学的役割を理解する上で重要な示唆を提供するものであり、同時に、本マウスモデルが生体内における老化細胞の操作と理解を可能とする強力な研究基盤となることを示しています。
1)細胞老化モデルマウスの作製
これまでの研究で細胞老化への関与が報告されている2つの主要なシグナル伝達経路を活性化することで細胞老化を誘導できるマウスモデルを開発しました。具体的には、ERK経路を活性化する恒常活性化型MEK1ならびにp38経路を活性化する恒常活性化型MKK6をドキシサイクリン(Dox)依存的に発現する遺伝子改変マウスを作製しました。このマウスにDoxを投与すると、それぞれの恒常活性化型MEK1およびMKK6の発現が誘導され、それによりmCherry蛍光タンパクで標識された細胞において、細胞老化の指標であるCdkn1a(p21)の発現が確認されました。さらに注目すべきことに、それら恒常活性化型MEK1やMKK6を発現していない周囲の細胞(mCherry陰性)においても、Cdkn1a(p21)を発現している細胞が増加しました。これらの結果から、生体内でERK経路およびp38経路を介した細胞老化が誘導されるだけでなく、その影響が周囲の細胞にも波及し、2次的に細胞老化を引き起こすことが示されました。
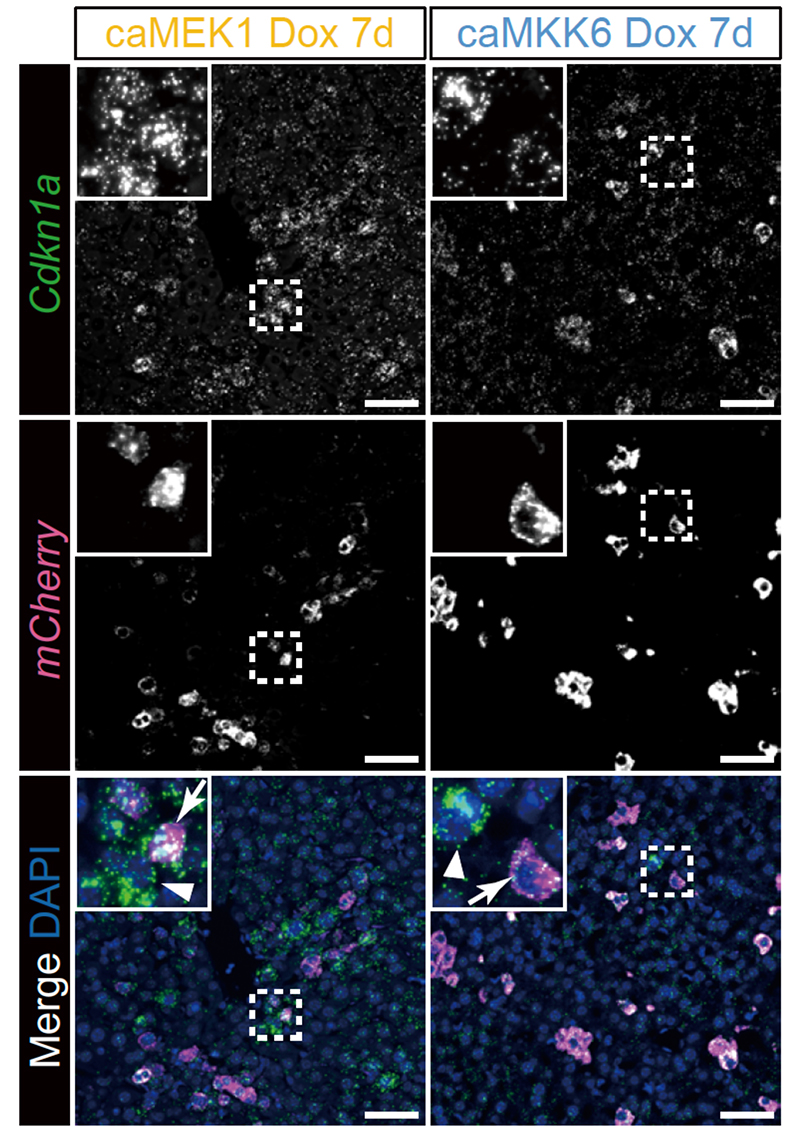
Fig.1 Dox処理後7日目の肝臓におけるRNA in situ解析
一次老化細胞と二次老化細胞を厳密に区別するため、これらマウスと二色標識の仕組みを組み合わせ、それぞれ細胞を細胞レベルで識別できる新たなマウスモデルを構築しました。このモデルでは、一次老化細胞をmCherry、二次老化細胞をGFPでそれぞれ標識することで、生体内における細胞老化の伝播過程を可視化・解析することができます。肝臓、大腸、マウス胎児線維芽細胞といった異なる細胞種において遺伝子発現を網羅的に調べた結果、細胞老化は組織の種類や誘発因子によってその反応様態が大きく異なることが明らかとなりました。さらに、肝細胞を対象としたシングルセルRNAシーケンシング解析(scRNA-seq)を実施したところ、同一の細胞種であっても、細胞老化状態にある細胞は一様ではなく、多様な遺伝子発現パターンを持つ複数の細胞集団から構成されていることが示唆されました。これらの結果は、細胞老化が一様なプロセスではなく、組織環境や細胞老化誘導の背景によって高度に多様化する現象であることを示唆します。
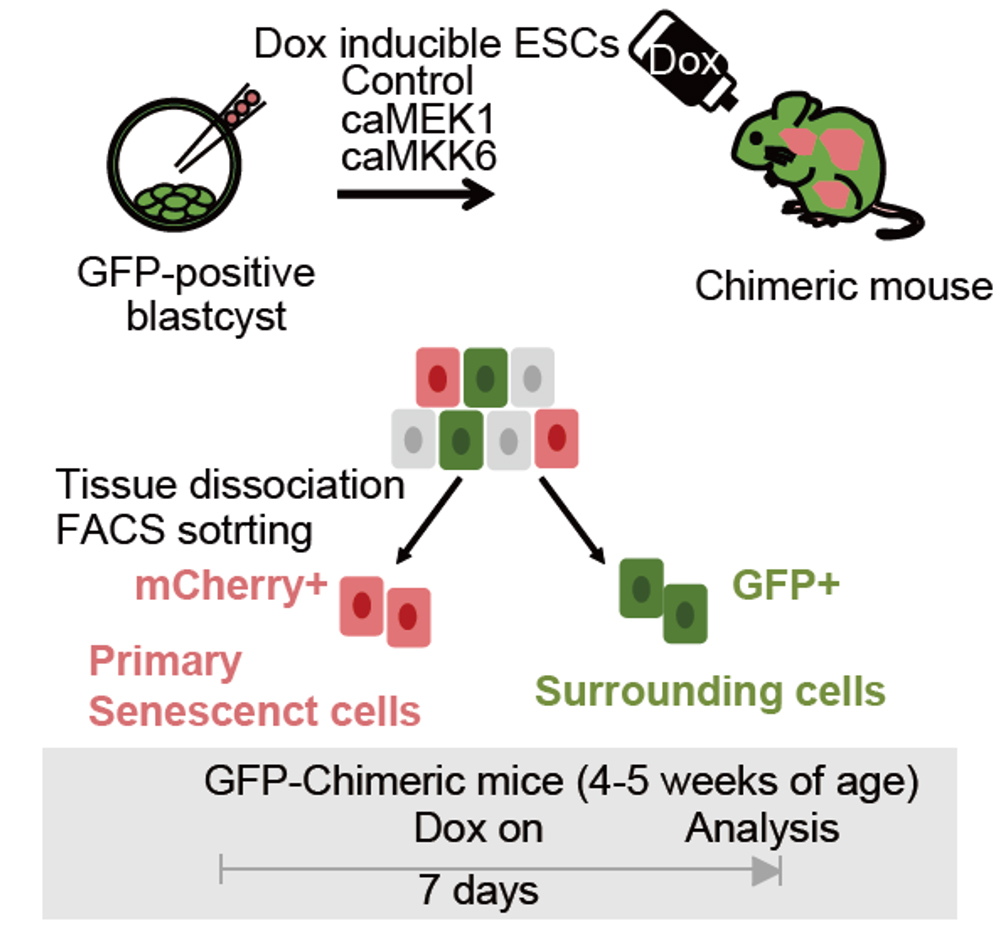
Fig.2 二色標識の概要
ドキシサイクリン(Dox)依存的に老化が誘導された一次老化細胞(mCherry陽性)と、その周囲で二次的に老化が誘導された二次老化細胞(GFP陽性)を、フローサイトメトリー(セルソーター)を用いてそれぞれ識別・分離することが可能なモデル。
2)細胞老化が肝臓の領域局在性を乱す
肝臓は肝細胞を中心とした肝小葉構造の集合体から構成されており、門脈側から中心静脈側にかけて異なる機能を担う「領域局在性(zonation)」を有していることが知られています。この領域は主に3つに分類され、periportal(PP)、mid-zone(Mid)、pericentral(PC)に区分されます。各領域はそれぞれ、Cyp2f2(PP)、Hamp(Mid)、Cyp2e1(PC)といった遺伝子の発現によって識別することが可能です。
ERK経路の活性化により細胞老化を促進すると、PC領域の特徴をもつ細胞が顕著に減少し、肝臓全体の領域局在性が乱れることが明らかとなりました。一方、p38経路の活性化による細胞老化誘導では、領域構造そのものは維持されていたものの、領域特異的遺伝子の発現が全体的に低下していることが確認されました。これらの結果から、細胞老化は肝臓の領域局在性に構造的・機能的な変化をもたらし、肝機能の低下に寄与する可能性が示唆されました。これは、臓器レベルでの機能不全が個体老化と密接に関係していることを裏付ける重要な知見です。
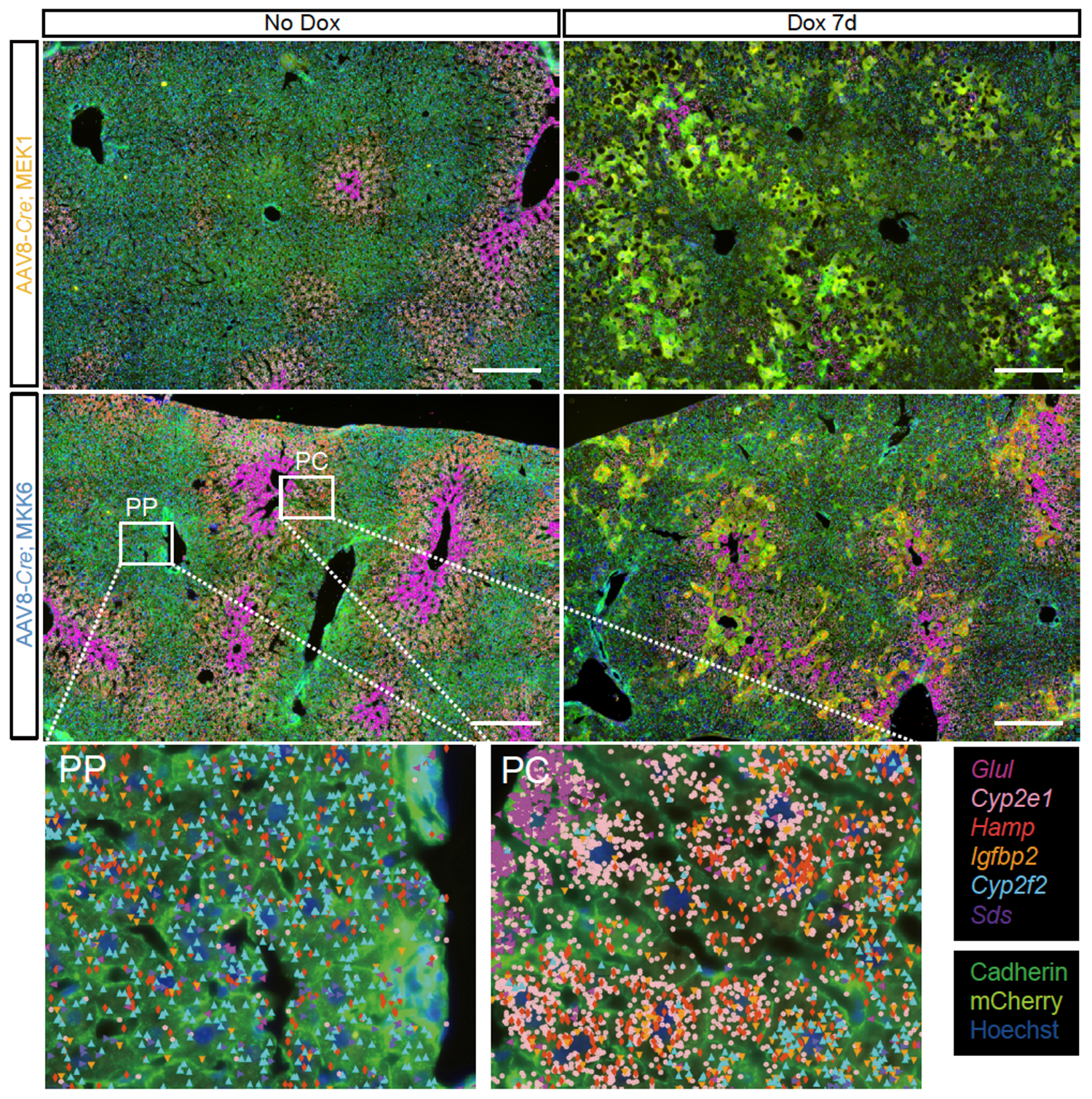
Fig.3 Hybridization-based in situ sequencing (HybISS)による肝臓の染色画像
3)二次細胞老化におけるIL-1シグナルの役割
次に、生体内で二次細胞老化を引き起こす分子メカニズムの解明に取り組みました。まず、GFPで標識された二次老化細胞の網羅的遺伝子発現のデータをもとに、上流のシグナル伝達経路の候補をバイオインフォマティクス的なアプローチで推定したところ、インターロイキン-1(IL-1)シグナル注7)が有力な候補として見つかりました。そこで、IL-1シグナルが実際に細胞老化に対して生理的な役割をもつかを検証しました。肝臓内のマクロファージの一種であるクッパー細胞は、IL1Bの主要な供給源として知られています。最近の研究では、高齢マウスでIL1Bを発現するクッパー細胞が増加していることが報告されています。
全身のマクロファージを選択的に枯渇させる薬剤(クロドロネートリポソーム)を投与したところ、細胞老化誘導マウスでIL1bの発現が有意に減少しました。これは、マクロファージがIL1Bの主要な供給源であることを強く示唆しています。加えて、IL1Bの受容体の働きを阻害する物質(IL1R1阻害剤)を投与すると、細胞老化の指標であるCdkn1aの発現が減少する傾向が見られました。これらの結果を統合すると、主にマクロファージに由来するIL1Bを介したIL-1シグナル伝達が、周囲の細胞における二次細胞老化の誘導に寄与していることが強く示唆されました。
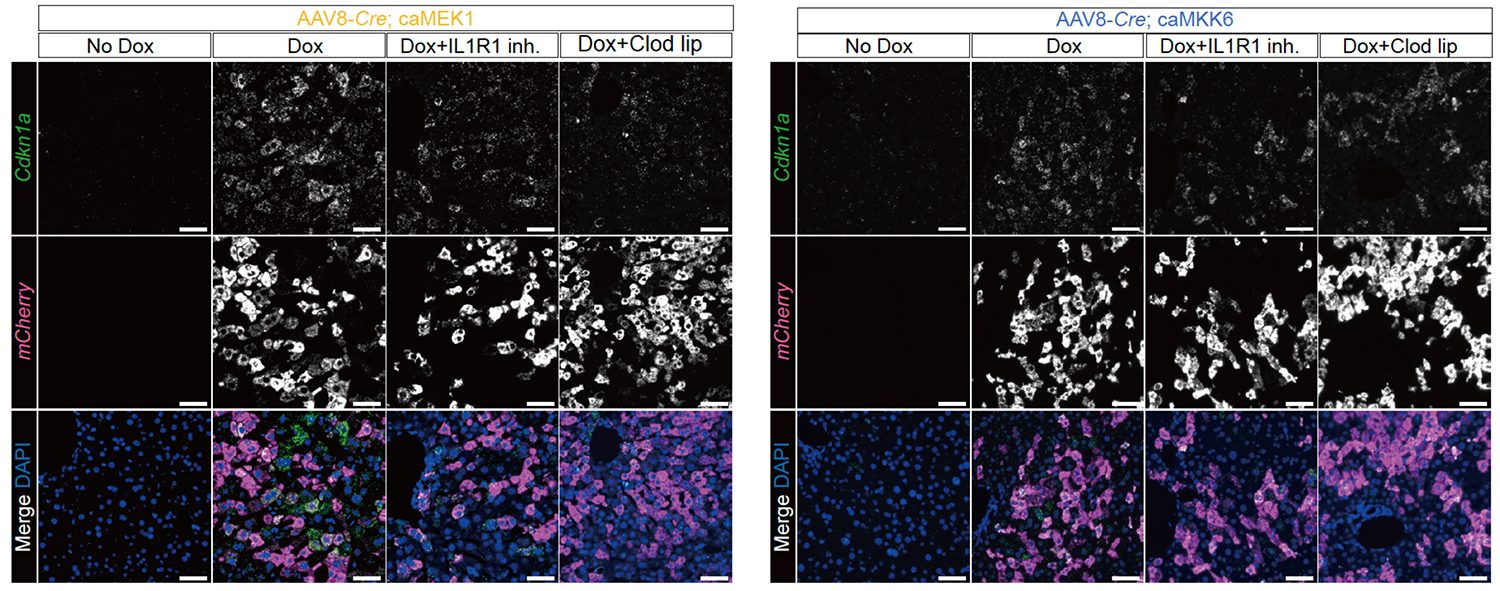
Fig.4 in situ RNA発現解析画像
MEK1とMKK6のいずれのモデルにおいても、IL1B受容体の阻害剤(IL1R1 inh.)およびクロドロネートリポソーム(Clod lip)により、細胞老化の指標であるCdkn1aの発現が低下した。
この研究では、一次老化細胞および二次老化細胞の生体内における特徴を、一細胞レベルの分解能ではじめて明らかにしました。これにより、老化細胞が生体組織内でどのように機能し、周囲の細胞にどのような影響を及ぼすのかという、これまで不明であった重要な問いに対する新たな知見をもたらしました。本成果は、細胞老化や個体老化の解明に向けた研究さらには老化関連疾患に対する新たな治療戦略の構築に貢献する基盤的な成果です。加えて、本研究で開発したマウスモデルは、個体レベルでの細胞老化現象を精緻に解析・操作するための強力なツールとして、今後の老化研究を大きく加速させることが期待されます。
- 論文名
Characterizing primary and secondary senescence in vivo - ジャーナル名
Nature Aging - 著者
Yuko Sogabe1,2, Hirofumi Shibata1,7, Mio Kabata1, Akito Tanaka1, Kanae Mitsunaga1, Kazunori Sunadome1,3, May Nakajima-Koyama1, Michitada Hirano4, Eisuke Nishida5, Knut Woltjen1, Hiroshi Seno2, Yasuhiro Yamada4*, Takuya Yamamoto1,3,6*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院 医学研究科
- 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)
- 東京大学大学院 医学系研究科
- 理化学研究所 生命機能科学研究センター(BDR)
- 理化学研究所 革新知能統合研究センター(AIP)
- (現職)岐阜大学大学院 医学系研究科
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
- AMED-CREST(JP17gm1110004, JP22gm1310002, JP21gm1310011)
- 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点(JP22bm0104001)
- 再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究中核拠点(JP23bm1323001)
- JP22bm1223002, JP22ama221201, JP22gm1110004, JP22zf0127008, JP223fa62700, and JP24bm1123053
-
科学技術振興機構(JST)
- CREST(JPMJCR2023)
- FOREST(JPMJFR206C)
-
日本学術振興会(JSPS)
- A3Foresight Program (JPJSA3F20230001)
- 科研費(23H05485, 23H00407)
注1)細胞老化
様々なストレスを受けた細胞が分裂を不可逆的に停止し、SASP因子注2)を分泌するようになる現象。がん抑制や組織修復などの働きを持つ一方で、様々な病気の原因にもなると考えられている。
注2)SASP(細胞老化随伴分泌現象:Senescence-Associated Secretory Phenotype)
老化細胞が分泌する様々な物質の総称。これらの物質は、炎症を引き起こしたり、周囲の細胞の細胞老化を促進したりするなど、多様な影響を体に与えることが知られている。
注3)マクロファージ
体内に存在する免疫細胞の一種で、「食べる細胞」とも呼ばれる。ウイルスや細菌などの異物を排除したり、細胞の残骸を処理したり、炎症反応に関わったりする。
注4)CDKN(サイクリン依存性キナーゼ阻害因子:Cyclin-Dependent Kinase Inhibitor)
細胞が増えすぎるのを防ぐ働きを持つタンパク質の一種で、細胞老化の重要な指標となる。
注5)NFκbシグナル
細胞内での情報伝達経路の一つで、炎症反応や免疫応答、細胞の生存などに深く関わっている。SASPの分泌を調節する重要な役割も担っている。
注6)ERKおよびp38 MAPK経路
細胞の増殖、分化、ストレス応答など、様々な細胞の活動を制御する細胞内の情報伝達経路。
注7)IL-1シグナル
免疫反応や炎症反応に関わる情報伝達経路。IL1B(インターロイキン-1ベータ)は炎症性サイトカイン(細胞間の情報伝達物質)の一種で、IL1R1はそのIL1Bを受け取る細胞側の受容体。






















