
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2014年2月14日
ヒトiPS細胞から血小板を安定的に大量に供給する方法を開発
中村壮研究員(京都大学CiRA)、江藤浩之教授(京都大学CiRA)らの研究グループは、ヒトiPS細胞から自己複製が可能な巨核球を誘導することに成功し、大量に血小板を生産する方法を確立しました。
これまでにもiPS細胞から血小板をつくることはできていましたが、輸血に必要なスケールで血小板を生産するのは困難でした。今回は血小板を生み出す細胞である巨核球に着目し、これまでよりも大きなスケールで、医療現場で使用できる量の血小板を生産することを可能としました。
この研究成果は2014年2月13日正午(米国東部時間)に米国科学誌「Cell Stem Cell」で公開されました。
ポイント
- 従来の方法では、iPS細胞から輸血に必要な血小板注1量の100分の1程度しか作れなかった。
- 生体外で自己複製し凍結保存が可能な不死化巨核球注2を誘導する方法を確立した。
- 巨核球をストックすることで血小板製剤の供給を安定化できる。
血小板は止血に重要な役割を果たす血液細胞で、巨核球という細胞から分離することで生み出され、血液の中を循環しながら、止血で利用されるか一定の寿命で崩壊します。
自ら分裂することはできないので、常に巨核球から作られ、必要量が補充されています。現在、深刻な貧血および出血素因をもたらすような血液疾患の患者さんは、献血による血液製剤を用いた輸血に頼らざるを得ない状況です。
しかし、献血ドナーの数は少子高齢化等もあり、減少しています。厚生労働省の統計によると、2027年には我が国の必要な輸血製剤の20%はドナー不足に伴い供給できないと発表されています。
特に血小板は機能を維持するために室温で保存する必要があり、採血後4日間しか有効期間がありません。そのため、必要なときに必要な量の血小板を供給することが困難です。こうした状況を改善するためには、ドナーに依存しないで血小板などの血液製剤を生産する仕組みが必要です。
江藤教授らのグループは2010年に皮膚細胞由来のiPS細胞から培養皿上で血小板が生産できることを発表しました。しかし1回の輸血では患者さん1人につき2000〜3000億個もの血小板が必要ですが、これまでの方法では、10億個程度しか生産できませんでした。そこで今回は血小板前駆細胞である巨核球に着目し、長期間にわたって自己複製することができる巨核球の誘導を試みました。
1) ほぼ無限に複製できる巨核球の作製
これまでの研究で、c-MYCを働かせることで、血小板の生産量を増やすことができることが分かっていました。本研究ではさらに造血幹細胞の細胞分裂に重要な働きをするBMI1やアポトーシスを抑制するBCL-XLという遺伝子を利用することで、5ヶ月以上自己複製可能な巨核球をiPS細胞から誘導することが出来ました。
具体的には、iPS/ES細胞から2週間かけて誘導した造血前駆細胞注3に2種類の遺伝子(c-MYCとBMI1)を導入し、さらに2〜3週間後に1つの遺伝子(BCL-XL)を追加で働かせることで、ほぼ無限に複製できる巨核球を作製することに成功しました(Fig. 1)。
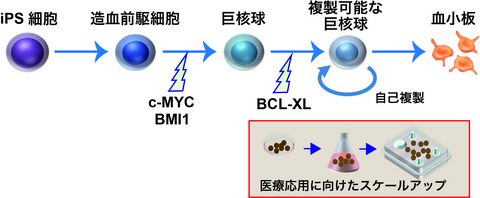
Fig. 1 複製可能な巨核球の作製方法
2) 自己複製できる巨核球を成熟させて血小板を生産
巨核球で強制的に働かせていた3つの遺伝子の働きを止めると、およそ5日後には巨核球が成熟し、血小板を生産しました(Fig.2)。
この方法では直径10cmの培養皿(10mLの培養液)で巨核球を培養し、1ccあたり200〜400万個の血小板ができました。
つまり、25〜50Lの培養液を用いれば輸血に必要な1000億個の血小板を5日以内に用意できることになります。
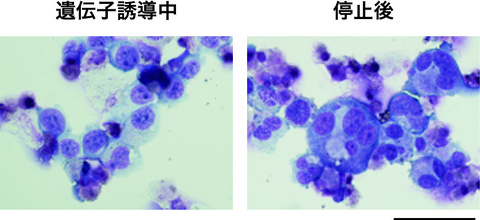
Fig. 2 倍数体化注4し成熟した、不死化された細胞株由来の巨核球
3つの遺伝子を発現中の巨核球(左)と遺伝子の発現誘導を止めて成熟した巨核球(右)。
ギムザ染色。図中のバーは50μmを示す。
3) 生産した血小板の機能評価
今回の方法で生産した血小板はトロンビン注5の存在下で凝集するなど(Fig. 3)、基本的な血小板の機能を持っていました。
ヒトから採血した直後の血小板と比べると反応が弱かったものの、保存した血小板やiPS細胞から直接誘導する方法で作成した血小板と比較すると強い反応を示しました。
従って、今回の方法で生産した血小板は十分に機能すると考えられます。

Fig. 3 トロンビン添加で凝集した血小板
従来のiPS細胞から血小板を生産する方法では、輸血に必要な1000億個もの血小板を生産するためにはヒトiPS細胞が70億個程度必要で、最終的に血小板を得るまでに26日程度必要でした。
しかし今回の方法では、250億個の自己複製する巨核球前駆細胞を使用して5日で血小板を得ることができます。培養する装置も、実験室レベルのシャーレ(10mL)からバッグ(1〜500L)にすることで複雑な設備を使わずに大量に培養することが出来ます。
このシステムにより、日本人に多いHLA型のiPS細胞から血小板製剤を生産するための巨核球のストックや、ドナーが見つかりにくいHLA型やその他の特殊な血小板型(HPA型)の患者さんへの血小板製剤の安定供給が可能となります。
今回、研究グループは将来の臨床研究、臨床試験を考慮した巨核球細胞の製造方法を決定したことになります。また、本研究では複数の巨核球を不死化する方法を比較し、より安全な製造方法を見つけました。
このシステムを用いた臨床研究を平成27〜28年に計画しており、最終的には臨床試験を経て10年後の実用化を目指しています。
- 論文名
"Expandable megakaryocyte cell lines enable clinically-applicable generation of platelets from human induced pluripotent stem cells" - ジャーナル名
Cell Stem Cell - 著者
Sou Nakamura1, Naoya Takayama1, Shinji Hirata1, Hideya Seo1, Hiroshi Endo1, Kiyosumi Ochi1, Ken-ichi Fujita1, Tomo Koike1, Ken-ichi Harimoto1, Takeaki Dohda1, Akira Watanabe1, Keisuke Okita1, Nobuyasu Takahashi2, Akira Sawaguchi2, Shinya Yamanaka1, Hiromitsu Nakauchi3, Satoshi Nishimura4,5 and Koji Eto1,3 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 宮崎大学医学部
- 東京大学医科学研究所
- 東京大学医学系研究科
- 自治医科大学分子病態治療研究センター
本研究は、下記機関より資金的支援を受けて実施されました。
- JST A-STEP
- JST CREST
- 文部科学省 再生医療の実現化プロジェクト
- 文部科学省、JST 再生医療の実現化ハイウェイ
- 文部科学省 科学研究費補助金 基盤研究B
- 厚生労働省 医薬品等審査迅速化事業費補助金
- 内閣府 最先端研究開発支援プログラム(FIRST)
注1) 血小板
止血に重要な役割を果たす核のない直径2〜3μmの血液細胞で、巨核球から分離して作られる。トロンビン等の作用で凝集する性質がある。
注2) 巨核球
造血幹細胞から作られる細胞で、血小板を生み出す細胞。巨核球は成熟すると核分裂はするが細胞分裂はしないという特殊な分裂を行い、大型で多核の細胞になる。
注3) 造血前駆細胞
血液のあらゆる細胞に分化する多分化能と自己複製能をもった造血幹細胞の子孫となる細胞。本論文中では血小板や赤血球などの細胞の元になる細胞を指している。
注4) 倍数体化
一つの細胞のなかで、2倍・3倍と通常よりも多く染色体が含まれる状態になること。
注5) トロンビン
血液凝固因子の一種。血小板を凝集させる機能がある。






















