
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2017年3月16日
簡便に細胞の分化を継続的に可視化する技術を開発
ポイント
- 細胞内には、細胞種によって異なる活性をもつマイクロRNA(miRNA)注1が存在する。
- 細胞内のmiRNA活性に反応するDNAを非ウイルス性のベクター注2を用いてiPS細胞に導入し、その細胞の状態を可視化できる技術を開発した。
- 生きたiPS細胞が分化していく過程をリアルタイムで可視化できた。
- 心筋細胞で特異的活性の高いmiRNAを利用することで、iPS細胞から分化した細胞群から心筋細胞を選別できた。
中西秀之特定研究員(京都大学CiRA未来生命開拓部門)、齊藤博英教授(京都大学CiRA同部門)らの研究グループは、CiRA吉田善紀准教授(未来生命開拓部門)らとの共同研究により、細胞の分化を継続的に可視化する、簡便で低コストな技術を開発しました。
細胞内には、細胞種によって異なる活性をもつmiRNAが存在し、細胞のマーカーとしての利用が有望視されています。研究グループは、ヒト多能性幹細胞で高い活性を示すmiRNAに反応するDNA配列と、目印となる蛍光タンパク質を作る遺伝子をピギーバックトランスポゾン注3あるいはエピソーマルプラスミド注4を用いて、iPS細胞に導入しました。蛍光強度を調べることで、対象となるmiRNAの活性、ひいては細胞の状態を可視化することが可能となり、例えば、iPS細胞が他の細胞に分化していく様子を継続的に調べることができるようになりました。また、心筋細胞で活性が高いmiRNAに反応するDNA配列を同様にiPS細胞に導入することにより、そのiPS細胞から分化した心筋細胞を、それ以外の細胞から選別することにも成功しました。
本技術により、細胞状態の変化を継続的に調べることができるようになりました。今後、効率的な分化条件等の検討など基礎研究への応用や、目的の細胞を選別して創薬研究などに役立てるといった応用が期待されます。
この研究成果は2017年3月2日にオランダ科学誌「Biomaterials」でオンライン公開されました。
miRNAは、タンパク質をコードしていないRNAの1つで、メッセンジャーRNA(mRNA)注5からタンパク質への翻訳を抑制する働きがあります。様々な種類のmiRNAが細胞内に存在しますが、その細胞種によってよく働いている(活性が高い)miRNAの種類は異なります。そのため、細胞内のmiRNA活性を調べることで細胞状態を知るための、細胞のマーカーとしての活用が有用視されています。
多様な細胞に変化する能力をもつiPS細胞から、目的の細胞に分化させたとき、その細胞集団の中に分化しきれていない細胞や目的以外の細胞が混在していることがあります。きちんと目的の細胞を選別するために、細胞の分化状態を可視化する技術が求められております。しかしながら、これまで細胞が生きたままの状態で、ウイルスを用いることなくmiRNA活性を継続的に調べる手法は確立されていませんでした。
1. 細胞内のmiRNA活性に応じて細胞の状態を可視化できる技術を開発した。
まず研究グループは、iPS細胞内で活性の高いmiRNAに着目しました。そのmiRNAの配列に相補的で、miRNAを認識できるDNAと、目印となる蛍光タンパク質をつくる遺伝子が並んだDNA配列を作製しました。その配列を、ピギーバックトランスポゾンあるいはエピソーマルプラスミドといったベクターを用いて、iPS細胞に導入しました。iPS細胞に導入されたDNA配列は、細胞内でmRNAに転写されます。mRNA上のmiRNAを認識する配列に、iPS細胞内で活性のあるmiRNAが結合すると、蛍光タンパク質への翻訳や抑制されるため、蛍光タンパク質が作られず、検知できる蛍光強度は弱くなります。
また、iPS細胞から分化した細胞にも、iPS細胞に導入されたDNA配列はそのまま受け継がれます。分化細胞では、対象のmiRNA(iPS細胞にて活性の高いmiRNA)の活性は低いため、そのmiRNAに応答するmRNAには結合せず、蛍光タンパク質が作られ、蛍光強度が強くなります。
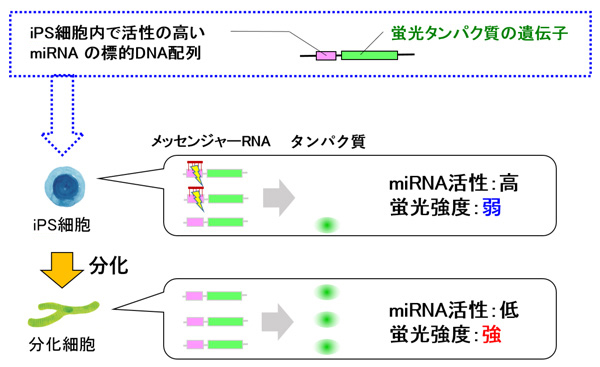
図1.今回開発した技術の概要
2. 生きたiPS細胞が分化していく過程をリアルタイムで可視化できた。
前項1. で作製したしくみによって、分化の過程を可視化できるかを調べるため、iPS細胞が未分化性を維持し増殖するために必須の因子であるbFGFを除いた培養液で、前項1.で作製したiPS細胞を培養し、自発的な分化を促しました。そして、bFGF除去後6~11日目に、細胞が発する蛍光強度を蛍光顕微鏡で観察し、分化の様子を調べました。すると、iPS細胞からあまり分化が進んでいない段階では蛍光強度が弱かったものの、bFGF除去後、徐々に蛍光強度が強くなっていき、iPS細胞が分化していく様子を継続的に観察することができました。本実験により、細胞内のmiRNA活性にもとづいて、細胞の分化が継続的に可視化できることを示しました。
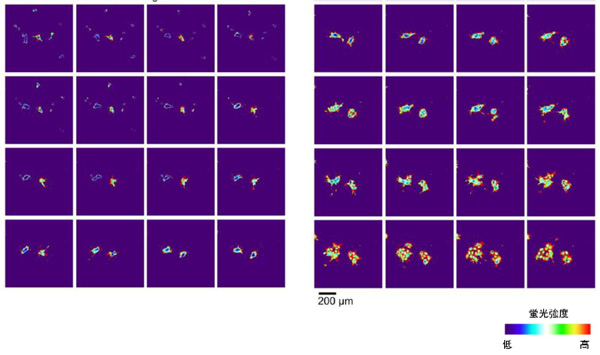
図2.iPS細胞から分化の様子を捉えたタイムラプス画像
培養液中のbFGF除去後6~11日、iPS細胞が分化していく状態を
3時間ごとに蛍光顕微鏡で観察した。
3. iPS細胞から分化した細胞群から心筋細胞を選別できた。
今度は、iPS細胞の代わりに心筋細胞で活性の高いmiRNAを認識するDNAと蛍光遺伝子をiPS細胞に導入しました。そのiPS細胞を心筋細胞に誘導し、蛍光強度の違いを利用して心筋細胞とそれ以外を選別しました。すると、心筋細胞に選別された90%以上の細胞が、心筋細胞のマーカーであるcTNT(心筋トロポニン)遺伝子を発現していました。一方、心筋以外の細胞でcTNT遺伝子を発現しているのは、5%以下でした。この結果から、miRNA活性に基づいて、目的の細胞を選別できることが示されました。
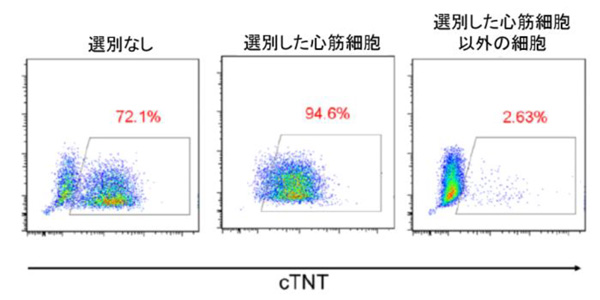
図3. iPS細胞から分化させた心筋細胞の選別
縦軸は蛍光強度の強さを、横軸はcTNT(心筋トロポニン)遺伝子の発現の強さを示す。
数値は、それぞれの細胞集団中で、cTNT遺伝子を発現している細胞の割合を示す。
本研究では、生きた細胞の分化を継続的に可視化でき、目的の分化細胞の選別も可能にする技術を新たに開発することに成功しました。この技術は、遺伝子を一度導入するだけで継続的に細胞の状態を可視化できるため、簡便かつ低コストです。また、遺伝子導入に用いたベクターはいずれも非ウイルス性のものなので、ウイルスの封じ込めに必要な設備が不要で広汎な研究施設で使用できます。本技術は、今後、細胞の分化条件検討などの基礎研究や、創薬研究などにおける目的細胞の選別などに貢献できると期待されます。
- 論文名
"Monitoring and visualizing microRNA dynamics during live cell differentiation using microRNA-responsive non-viral reporter vectors" - ジャーナル名
Biomaterials - 著者
Hideyuki Nakanishi, Kenji Miki, Kaoru R. Komatsu, Masayuki Umeda, Megumi Mochizuki, Azusa Inagaki, Yoshinori Yoshida, Hirohide Saito - 著者の所属機関
京都大学iPS細胞研究所
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 「基盤研究S」
- 日本学術振興会 特別研究員制度
- キヤノン財団
- 公益財団法人 上原記念生命科学財団
- 公益財団法人 中谷医工計測技術振興財団
- iPS細胞研究基金
注1) マイクロRNA(miRNA)
20~30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNAと結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注2) ベクター
目的の細胞に特定の遺伝子を導入するために使われる遺伝子の運び屋のこと。
注3) ピギーバックトランスポゾン
トランスポゾンとは、転移酵素の働きによってゲノム上の位置をランダムに移動する配列のこと。今回の研究でベクターに用いたピギーバックトランスポゾンは蛾由来であるが、蛾の細胞だけなく、マウスやヒトを含むほ乳類の細胞でも高い転移活性をもつ。ピギーバックベクターを利用して遺伝子を細胞に導入すると、変異ウイルスの発生リスクやウイルスを抗原とする免疫応答を回避できる。
注4) エピソーマルプラスミド
ベクターとして用いられる環状DNA。宿主DNA(染色体)の中に遺伝子を入り込ませずに細胞内で自律的に増殖する。
注5) メッセンジャーRNA(mRNA)
DNAの持っている遺伝情報(遺伝子配列)から転写され、合成されるRNA。このmRNAの配列に従って、アミノ酸が連結されてタンパク質が合成される。






















