
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2018年8月7日
ヒト多能性幹細胞から3次元脊髄組織の分化誘導に成功
ポイント
- ヒトiPS/ES細胞から3次元の脊髄組織を分化誘導する条件を確立した。
- 分化誘導した3次元脊髄組織は、適切な背側化因子および腹側化因子を添加することで、分化領域を背側、中間、および腹側に変えることができた。
- ヒト由来の細胞を用いてより生体に近い条件での脊髄組織分化誘導は、将来的に脊髄関連疾患における病態解析や疾患モデルなどへの応用が期待される。
小倉健紀大学院生(京都大学CiRA臨床応用研究部門・京都大学大学院医学研究科脳神経外科学)、坂口秀哉日本学術振興会特別研究員PD(京都大学CiRA同部門)髙橋淳教授(京都大学CiRA同部門)らの研究グループは、ヒトiPS/ES細胞から3次元の脊髄組織を分化誘導することに成功しました。
近年、多能性幹細胞からの3次元組織分化誘導はオルガノイド注1)という呼称で知られるようになり、多くの神経領域が3次元組織として分化誘導できることが報告されてきましたが、これまで、ヒトiPS/ES細胞を用いて、3次元で脊髄組織を分化誘導する方法は確立されていませんでした。今回の研究では、脊髄の発生過程をin vitro注2)で模倣する方法論によって、ヒトiPS/ES細胞から3次元脊髄組織を分化誘導する方法を確立しました。今回確立した方法は、脊髄組織内における神経回路形成に関連した研究や、ヒト胚発生初期の段階で異常をきたす遺伝性脊髄疾患の病態の解析、疾患モデルの作製だけでなく、筋肉や脳といった生体内で脊髄が関わっている他の組織とのネットワークの形成に関わる研究にも活用できると期待されます。
本研究成果は、2018年7月30日に英国科学誌「Development」でオンライン公開されました。
脊髄は、筋肉へ運動の指令を出したり、痛みや熱などの感覚信号を脳へ伝達するといった重要な役割を果たすことで知られ、疾患による脊髄の機能障害は麻痺や知覚異常などを引き起こします。脊髄は発生学的には、神経管と呼ばれる発生初期に形成される神経の元になる組織の尾側に形成されます。管状の構造として形成された神経管は領域を決定する因子を分泌するオーガナイザー注3)が最背側と最腹側にそれぞれ形成されることで、背腹軸のパターンが形成されることが知られ、オーガナイザーから分泌される因子の濃淡によって、背側脊髄注4)は6つの前駆細胞ドメイン(領域)に、腹側脊髄注5)は5つの前駆細胞ドメインに分割されます。このように、脊髄はその発生過程において複雑でダイナミックな領域の構築が行われ、様々な情報の伝達に寄与できる高度な回路の形成が達成されます。
近年、多能性幹細胞から目的の細胞に分化誘導する技術が進歩したことにより、3次元での生体と同じような構造を保った組織への分化誘導が可能となってきており、このような組織はオルガノイドと呼ばれます。3次元の構造を保った状態での分化誘導手法は、これまでの比較的単純な条件による分化誘導では達成できなかった複雑な領域の分化誘導を可能とすると考えられ、次世代の再生医療のトピックの一つとして注目されています。神経組織においては、大脳、神経網膜、海馬、脈絡叢、小脳、視床下部、下垂体などが3次元組織として分化誘導できることが報告されており、例えば大脳の分化誘導は小脳症などの疾患モデリングに応用されることが期待されます。しかし脊髄に関してはこれまで、3次元の組織としての分化誘導は全くなされていなかったため、本研究グループはヒトiPS/ES細胞を用いて3次元での脊髄分化誘導を試みました。
1) ヒトiPS/ES細胞からの背側脊髄の3次元分化誘導条件の確立
研究グループはこれまでに報告されている脊髄運動ニューロンの分化誘導条件と、マウスおよびヒトの多能性幹細胞から中枢神経系を3次元で効率よく誘導する方法として知られる無血清立体浮遊培養法(SFEBq法)注6)を組み合わせて、発生学的な脊髄の分化をin vitroで再現するという戦略で、3次元脊髄分化誘導法の創出に取り組みました。脊髄運動ニューロンの分化誘導条件には多くのシグナル調整因子が含まれていることから、彼らはまず、因子を除去することで、脊髄運動ニューロンに限局しない広い領域の分化誘導が可能となるのではとの仮説を元に新たな分化誘導条件を模索し、3次元での背側脊髄のマーカーを発現する神経組織を分化誘導する培養条件を同定しました(図1)。この条件で誘導された組織には、培養15日目にPax6+/Pax7+の背側脊髄に存在する前駆細胞の神経上皮が見られ、その中にはより背側領域に相当するPax6+/Pax7+/Olig3+のpd1-3を分化誘導する領域とより腹側に位置するPax6+/Pax7+/Olig3-の領域を認めました。さらにPax6+/Pax7+/Olig3+の上皮に連続して、Lmx1a+のroof plateと呼ばれる背側領域のオーガナイザーに相当する領域を認めました。これらの領域は連続上皮の中に生体と同じような順序で形成されており、今回設定した分化誘導条件では、背側脊髄領域が生体に近い形で分化誘導されていることが示唆され、この分化誘導条件を3-DiSC(3 dimensional spinal cord induction)法と名付けました。
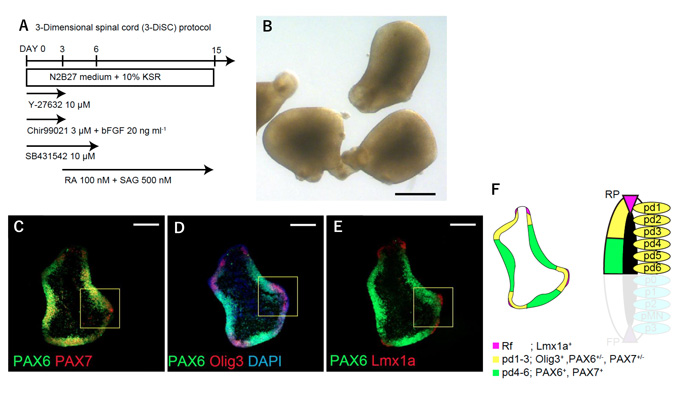
図1:背側脊髄組織の分化誘導
A:背側脊髄組織を分化誘導するプロトコール(3-DiSC法)。
B:3-DiSC法で分化誘導された組織の位相差顕微鏡像。
C-E:3-DiSC法で分化誘導された組織の免疫染色像。Lmx1a+のroof plate領域、PAX6+/PAX7+/Olig3+のpd1-3領域、PAX6+/PAX7+/Olig3-のpd4-6領域を含む背側脊髄領域が3次元で分化誘導されている。
F:C-Eの模式図。図中のスケールバーはB:500μm、C-E:200μm。
次に、このオーガナイザー領域を伴う3次元構造がどのように形成されるのかをみるため、免疫染色による評価を時系列で行いました(図2)。興味深いことに分化誘導開始後3日目までは細胞凝集塊であったものが、分化誘導開始後6日目には、Pax6+/Sox1+/Sox2+の神経上皮構造が外部からの刺激を受けることなく自己組織化的に形成されていました。培養9日目には神経上皮の一部が突起様の構造を呈し、この突起部分に一致してLmx1aの発現を認め、突起構造がroof plateに相当すると考えられました。Lmx1a陽性部分とその周辺に一致して、BMPシグナルの下流マーカーであるphospho smad 1/5やMSX1/2、またWnt1の発現が免疫染色で見られ、まさにLmx1a+のroof plateに相当する部分がオーガナイザーとして機能していることが示唆されました。以上より、今回見出した3-DiSC法によって、オーガナイザーを含む背側脊髄領域が自己組織化的に形成されることが示されました。
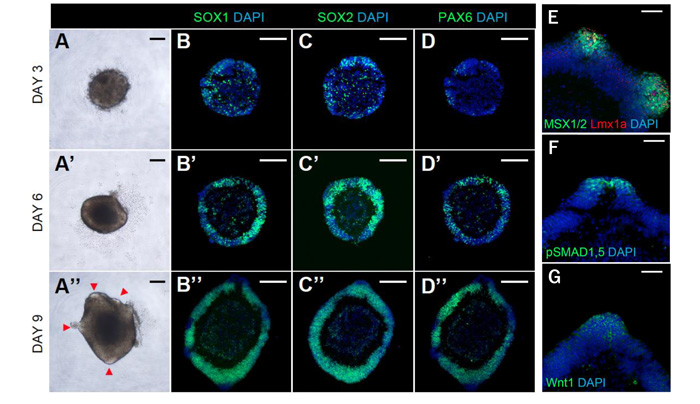
図2:3-DiSC法による分化誘導初期の時系列神経マーカー発現パターンと、背側オーガナイザーからのパターニングシグナルの分泌
A-A'':培養3−9日の細胞凝集塊の位相差顕微鏡像。培養9日目では突起様の構造が確認出来る(赤色矢頭)。
B-D'':培養3-9日における神経前駆細胞マーカーの時系列発現パターン。培養3日目までは散在性に確認出来る各マーカーの発現パターンは、培養6日目で細胞凝集塊の外側に上皮様構造として見られ、培養9日目には上皮様構造がほぼ完成している。
E-G:培養9日目に見られる突起様構造の周辺には、BMPシグナルの下流マーカーであるMSX1/2やpSMAD1,5、またWnt1の発現が見られ、この突起様構造の部分がオーガナイザーとして働いていることが示唆される。
図中のスケールバーはA-D'':200μm、E-G:50μm。
2) 発生学的知見に基づいた脊髄の誘導領域の調節
発生過程においては腹側にもfloor plateと呼ばれるオーガナイザーが存在し、Sonic hedgehogのシグナルを分泌することで腹側の領域を決定しています。3-DiSC法で誘導した組織は背側領域のみが形成されていましたが、より背側もしくは腹側の分化誘導ができないかと考え、研究チームは次に、背側化因子であるBMP4や腹側化因子であるSonic hedgehogのシグナルを適切な時期に添加することで、背側・中間・腹側の脊髄を分化誘導できる条件を探りました(図3)。3-DiSC法で分化誘導した脊髄組織からは、脊髄介在ニューロンのdl1-4に相当する神経のマーカー発現が広く見られ、これは背側脊髄の広い領域が分化誘導されていることを示しています。しかし、培養15日目よりBMP4を添加して培養を続けると、dl1の割合が有意に上昇し、dl3-4については3-DiSC法よりも有意に減少していました。これは、脊髄神経前駆細胞を背側化因子で処理することで、誘導された神経領域がより背側化されていることを示しています。
次に研究グループは、腹側化因子のSonic hedgehogシグナルを増強するSAGという化合物を培養3日目より添加して、3-DiSC法で分化誘導した背側脊髄組織を腹側化することを試みました。腹側化の指標として、背側・中間・腹側脊髄領域に発現するマーカーをqPCRにて定量評価した結果、SAGを50 nMの濃度で添加した時には中間脊髄領域に発現が見られるDbx1/Dbx2の発現が有意に上昇していましたが、腹側脊髄に発現するマーカーであるNkx6.1やOlig2、FOXA2の発現上昇は認められなかった一方で、SAGを500 nMの高濃度で添加すると、Dbx1/Dbx2の発現上昇は認められない代わりに、Nkx6.1/Olig2/FOXA2の有意な発現上昇が認められました。これらのマーカー発現について、免疫染色にて詳細に評価したところ、SAG 50 nM添加群では中間領域の3次元脊髄組織が分化誘導され、SAG 500 nM添加群では、腹側領域の3次元腹側脊髄組織が生体と同じような構造を持って分化誘導されていることがわかりました。これらの結果は3-DiSC法で分化誘導した背側脊髄組織が濃度依存的にSonic hedgehogシグナルによって腹側化されることを示していました。
SAG 50 nM群ではp2領域が誘導されることがわかりましたが、生体においてはこの領域からV2aおよびV2bニューロンが生み出されます。V2aニューロンはNotchシグナルの阻害、V2bニューロンはNotchシグナルの増強によって分化促進されることが知られており、近年、V2aニューロンは脊髄損傷への細胞治療などへの応用が期待され、注目を集めています。そこで研究グループは次に、3-DiSC法+SAG 50 nMで生み出された神経にNotchシグナルを阻害することでV2aニューロンが効率的に産生されないかを評価しました。3-DiSC法+SAG 50 nMの条件下では、Lhx1やPax2陽性細胞が多く含まれ、V0-V1領域が主に誘導されていることが示唆されましたが、Chx10陽性のV2aニューロンとGATA3陽性のV2bニューロンも認められ、V2ニューロンの中では、V2a: 70%、V2b: 30%程度の割合でした。ここにNotch阻害剤であるDAPTを培養15日目より10日間添加すると、DAPT添加群ではV2ニューロンのほとんどすべてがChx10陽性のV2aニューロンになりました。このことから、3-DiSC法で誘導した組織を適切に領域化因子で処理することで、目的の神経細胞を多く取るような条件設定も可能であることが示唆されました。
以上の結果より、3-DiSC法で分化誘導した背側脊髄組織は、背側化因子・腹側化因子によってそれぞれ、背側・腹側への領域化が可能で、これまでに報告されている脊髄の分化誘導方法とは異なり、生体の脊髄発生過程まで再現していることが示されました。
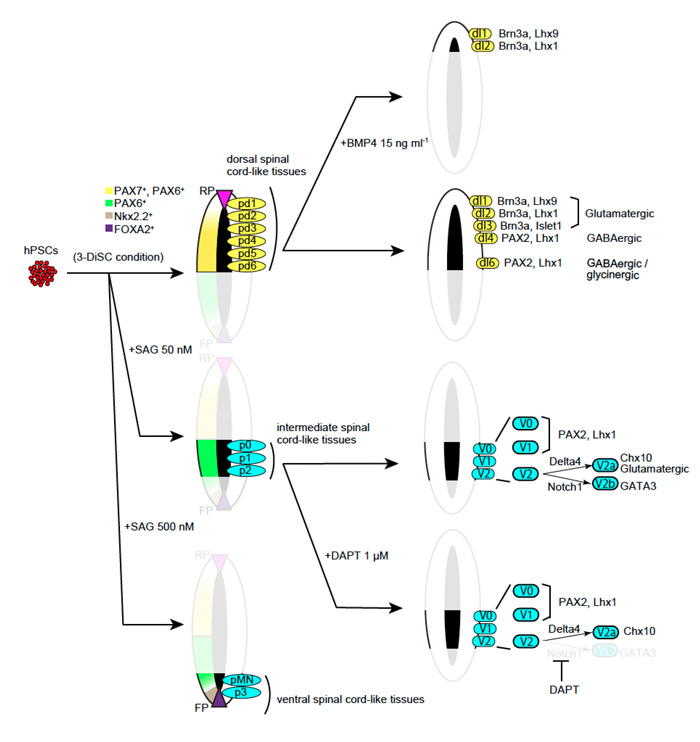
図3:背側・中間・腹側脊髄の分化誘導条件のまとめ
3-DiSC法ではdI1-6を含む広い背側脊髄組織が誘導されるが、BMP4添加によって背側化されるとdI1-2が主に誘導される。SAG 50 nMのよる腹側化はp0-2の中間脊髄領域を誘導し、そこにDAPTを添加するとV2aニューロンが主に誘導される。SAG 500 nMによる強い腹側化はfloor plate-p3-pMNの腹側脊髄領域を誘導する。
3)分化誘導した脊髄組織からは、生体と同じように、誘導した脊髄領域によって異なった脊髄神経が産生される。
最後に研究チームは、得られた神経細胞の単細胞でのマーカー発現解析を行うために3-DiSC法、3-DiSC法+SAG 50 nM、3-DiSC法+SAG 500 nMの3つの条件のサンプルを分散培養し、免疫染色による評価を行いました(図4)。この結果、3-DiSC法のサンプルからはVglut2+/Islet1+のdI1-2、Vglut2+/Islet1+/Brn3a+のdI3、GABA+/Pax2+のdI4またはdI6に相当する神経細胞が、3-DiSC法+SAG 50 nMからは、Vglut2+/Chx10+のV2a interneuron、Calbindin+/MafB+のV1 Renshaw interneuron、GABA+/Foxp2+のnon-Renshaw V1 interneuronが、そして3-DiSC法+SAG 500 nMからは、ChAT+/Islet1+/Hb9+の脊髄運動ニューロンが産生されていることを、各ニューロンのマーカー発現パターンから示しました。これらの結果から、今回分化誘導した脊髄組織からは、それぞれの分化誘導領域に応じて、相当する脊髄神経が産生されることが示されました。
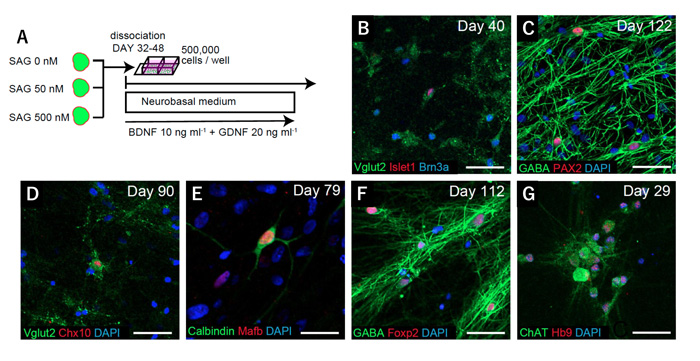
図4:分化誘導した脊髄組織の分散培養による、領域別神経細胞の分化誘導の確認
A:分散培養の模式図。
B-C:3-DiSC法による組織の分散培養では、Vglut2+/Islet1+のdI1-2、Vglut2+/Islet1+/Brn3a+のdI3、GABA+/Pax2+のdI4またはdI6に相当する神経細胞の出現が確認出来る。
D-F:3-DiSC法+SAG 50 nMでは、Vglut2+/Chx10+のV2a interneuron、Calbindin+/MafB+のV1 Renshaw interneuron、GABA+/Foxp2+のnon-Renshaw V1 interneuronが確認出来る。
G:3-DiSC法+SAG 500 nMでは、ChAT+/Islet1+/Hb9+の脊髄運動ニューロンの分化誘導が確認出来る。
図中のスケールバーはB-D, F-G:50μm、E:25μm。
本研究では、ヒト多能性幹細胞から3次元脊髄組織への分化誘導を報告しました。誘導した組織は発生学的な背景を反映したマーカー発現や構造を有しており、ヒト脊髄の発生過程を模倣していると考えられます。この成果は、将来的には脊髄の疾患モデル作成やヒトにおける脊髄発生異常のメカニズム解明に寄与するだけでなく、大脳や筋肉などの他の部位とのつながりを研究室レベルで構築するための技術としても有用と考えられます。
- 論文名
Three-dimensional induction of dorsal, intermediate and ventral spinal cord tissues from human pluripotent stem cells - ジャーナル名
Development -
著者
Takenori Ogura1,2,*, Hideya Sakaguchi1,*,‡, Susumu Miyamoto2, Jun Takahashi1,2,‡
* 筆頭著者
‡ 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)臨床応用研究部門
- 京都大学大学院医学研究科脳神経外科学
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患・組織別実用化研究拠点A」
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 基盤研究 (B) (17H04302)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 若手研究 (18K15046)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 研究活動スタート支援 (16H06897)
注1)オルガノイド
多能性幹細胞から分化誘導された3次元組織で、生体でみられるような構造や機能を保持しているもの。神経領域では、大脳、神経網膜、小脳、海馬、中脳などの領域が報告されており、神経以外では、腎臓、胃、肝臓、腸管などのオルガノイドが報告されている。いずれも将来的な疾患モデリングや創薬スクリーニングへの応用が期待されている。
注2)in vitro
実験条件をあらかじめ決めた試験管内のような環境条件で行う実験を示す用語。
注3)オーガナイザー
個体発生において様々なシグナルを出すことで領域を形成する元になる部分をオーガナイザーと呼ぶ。神経領域にも多くのオーガナイザーがあることが知られるが、脊髄においては最背側脊髄領域に位置するroof plateと、最腹側脊髄領域に見られるfloor plateが知られている。
注4)背側脊髄
脊髄の背側の領域で、ここから分化誘導される神経細胞は主に感覚信号の処理に関わるとされる。
注5)腹側脊髄
脊髄の腹側の領域で、ここから分化誘導される神経細胞は主に運動の処理に関わるとされる。
注6)無血清立体浮遊培養法(SFEBq法)
ES細胞などの多能性幹細胞を酵素によりバラバラに分散し、それを3,000-9,000個程度の細胞の塊に再凝集させ、この細胞凝集塊を、血清や転写因子などの神経分化阻害効果のある成分を含まない培養液に浮遊させて培養することで、3次元で神経組織への分化誘導を可能とする、神経分化誘導法の一つ。理化学研究所 笹井芳樹研究室によって確立された。






















