
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2019年3月19日
iPS細胞によりセッケル症候群の病態を再現
ポイント
- 小頭症・低身長などを示す希少疾患セッケル症候群について、ATR遺伝子に変異を有する患者さんの細胞からiPS細胞モデルを構築した。
- ATR遺伝子の特定の変異により、細胞種特異的スプライシング注1)が起こることがわかった。
- 神経前駆細胞ではスプライシングの異常の程度が大きく、紡錘体形成異常の増加や核の配列の乱れが生じていた。
- スプライシング制御薬を作用させることで、神経系の表現型の回復に成功した。
市島ホセ大学院生(京都大学CiRA臨床応用研究部門、大学院医学研究科)、齋藤潤准教授(京都大学CiRA同部門)らの研究グループは、希少先天性疾患のセッケル症候群(Seckel syndrome: SS)において、特定の遺伝子の変異によって細胞に生じる影響を新たに同定し、変異によってもたらされる神経系への障害を回復させる可能性のある化合物の選定に成功しました。
この研究成果は、2019年3月8日に日本人類遺伝学会が発行した英文科学誌「Journal of Human Genetics」に掲載されました。
SSは小頭症、成長遅滞、精神遅滞といった症状を呈する希少な疾患です。SSの原因と考えられる遺伝子変異として、DNA修復関連遺伝子や中心体制御遺伝子の変異が多く報告されています。その中でも、一本鎖DNA切断やDNA複製ストレスに対する応答を司るATR遺伝子の変異がこれまで複数同定されてきました。ATR遺伝子は遺伝情報であるDNAの堅牢性を防御するために重要な調節因子であり、全ての細胞で発現しています。SSと関連しているATR遺伝子変異は完全な欠損型のものではなく、ATRタンパク質の働きを低下させる低形質(hypomorphic)なものです。
本研究では、ATR c.2101 A>G変異を持つ患者さんの細胞を用いて解析を行いました。この遺伝子変異は患者さん由来線維芽細胞において、エキソン9注2)のスプライシング異常を引き起こすことが既に知られています。
SSにおける小頭症の主因は,神経前駆細胞(neural progenitor cells:NPCs)が分裂障害を起こし枯渇することであると考えられています。一方、患者さん由来の神経系の細胞におけるATR遺伝子変異の影響を検証した報告例はありません。SS患者さんから神経系の細胞を、特に増殖能のあるNPCsを回収することが難しいため、ATR c.2101 A>G変異を有するSS患者さんの細胞よりiPS細胞(SS-iPS細胞)を樹立し、神経系への分化誘導法を用いて解析を行いました。
(1) ATR遺伝子の変異による細胞種特異的なスプライシング異常の解明
まず、SS-iPS細胞株の2株を神経へ分化誘導し、神経前駆細胞マーカーであるPAX6やネスチンを発現しているSS-iPS細胞株由来NPCs(SS-NPCs)を作製しました(図1 a)。次に、SS-iPS細胞株とSS-NPCsを用いてATR遺伝子のエキソン9のスプライシングパターンを解析したところ、iPS細胞の状態では、神経前駆細胞に分化した状態に比べて、スプライシング異常が軽減されていることがわかりました(図1 b)。SS-NPCsにおけるスプライシング異常は、神経分化誘導の初期段階から現れていました。
さらに、細胞種ごとのスプライシング異常の程度を比較するため、SS-iPS細胞株を胚体内胚葉細胞と血球前駆細胞へ分化誘導し(図1 c, d)、スプライシングパターンを解析しました。すると、SS株由来胚体内胚葉細胞において、スプライシング異常がiPS細胞と同様に軽減されていました。一方、血球前駆細胞ではスプライシング異常が見られました。
ATR遺伝子のエキソン9スキッピングアイソフォーム注3)に対する正常アイソフォームの比をそれぞれの細胞種で比較したところ、NPCsにおいてその比が最も低かったことから、スプライシング異常による影響は神経系細胞において比較的大きいことが予想されます(図1 e)。
これらのデータを合わせると、ATR c.2101 A>G変異は細胞種特異的なスプライシングを呈し、神経系への強い影響を裏付ける結果になりました。この結果は、SS患者さん由来の神経系の細胞におけるATR遺伝子のふるまいを確認した初の成果になります。
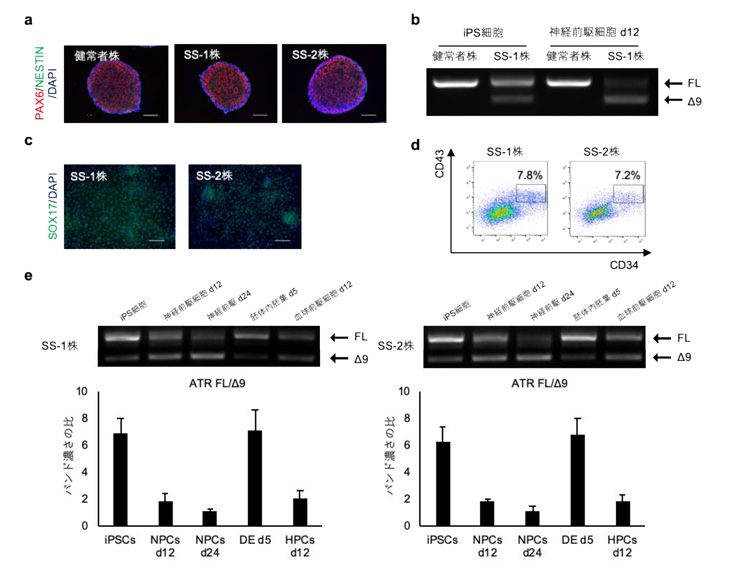
図1 ATR c.2101 A>G変異が細胞種特異的スプライシングを示す。
a. 神経前駆細胞が豊富にあるニューロスフェアの断面図。
赤:PAX6、緑:ネスチンタンパク質
b. SS-iPS細胞およびSS-NPCsのATRエキソン9のスプライシング解析。
FL:正常アイソフォーム、Δ9:エキソン9スキッピングアイソフォーム
c. SS-iPS細胞から分化誘導した胚体内胚葉。
緑:SOX17タンパク質
d. SS-iPS細胞から分化誘導した血球前駆細胞のフローサイトメトリー解析。
CD34、CD43両陽性細胞の分化誘導を確認した。
e. SS-iPS細胞およびその分化細胞におけるATRエキソン9のスプライシング解析。
(2) ATR遺伝子変異によって生じる神経系細胞における障害の解析
ATR遺伝子変異をもつ神経系細胞において、エキソン9のスプライシング異常の一端が解明されましたが、さらに、それが細胞学的にどのような障害をもたらすのか詳細に解析しました。
まず、可能な限り遺伝的背景を揃えた厳密な比較を行うために、CRISPR/Cas9技術を用いて、SS-iPS細胞株のATR遺伝子変異のみを修復しました。遺伝子変異を修復した株(cSS-iPS細胞株)では、iPS細胞の状態および神経前駆細胞に分化させた状態において、スプライシング異常が完全に回復していました。
次に、NPCsにおけるATR c.2101 A>G変異の影響を調べるために、SS-NPCsのATR活性の程度を検証しました。ATRは、細胞分裂期にDNA複製が阻害された(複製ストレスが生じた)場合に、それに応答して活性化することが知られています。そこで、薬剤を用いて複製ストレスを誘発し、ATRの下流に位置する因子のCHK1がリン酸化を受けるレベルを検証しました。すると、SS-NPCsでは、複製ストレスを与えてもCHK1リン酸化活性が上がらず、ATRが活性化していないことが示唆されました(図2 a)。
また、ATRには中心体を制御する働きが知られているため、細胞が正しく増殖する際にできる構造体である紡錘体の形成能を確認しました。紡錘体は二極性に形成され、細胞分裂を支えますが、極の数が増減したり、極の大きさが不均一になったりすると分裂がうまく行われなくなる可能性があります。実際にSS-NPCsの分裂を検証したところ、cSS-iPS細胞株由来NPCsや健常者株NPCsと比較して、異常な紡錘体形成の割合が上昇していました(図2 b, c)。特に、三つ以上の極を示す紡錘体が形成された割合が高く、ATRの中心体の数を調節する機能との関連が示唆されました。
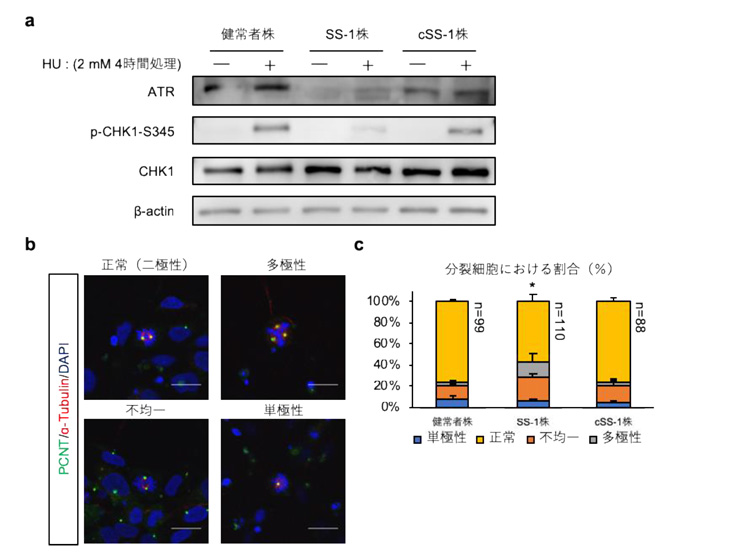
図2 SS-iPS細胞株由来神経前駆細胞の細胞学的表現型
a. 神経前駆細胞でのATRのCHK1リン酸化活性の検証。
HU:ヒドロキシウレアによる複製ストレス誘発の有無、ATR:ATRタンパク質の量、
p-CHK1-S345:リン酸化したCHK1の量、 CHK1:CHK1の量、 β-actin:β-actinの量(補正用コントロール)
b. 分裂紡錘体の形態的分類。
緑:PCNT(中心体構成タンパク質で紡錘体極に局在する)、赤:α-チューブリン(微小管関連タンパク質で紡錘体微小管に局在し、染色体分配を調節する)、青:DAPI(DNAを染色し、染色体の位置を示す)
c. 分裂中の神経前駆細胞における各紡錘体形態の割合。
SS-NPCsにおいて異常形成の割合が増加していた。
(3) スプライシング異常に伴う神経系の表現型を回復する化合物の同定
最後に、スプライシング異常とそれに伴う神経系の表現型を薬物により軽減できるかを検討しました。この実験では、RNAのスプライシングを調節する制御薬に着目しました。いくつかの化合物のうち、CLK1阻害剤であるTG003がSS-NPCsにおいてエキソン9のスキッピングを抑えることがわかりました(図3 a, b)。さらに、TG003の処理によってSS-NPCsに見られるATRのタンパク質の量の低下が回復し、ATRのリン酸化活性が上昇しました(図3 c)。さらに、紡錘体形成異常の頻度もTG003処理によって低下しました(図3 d)。
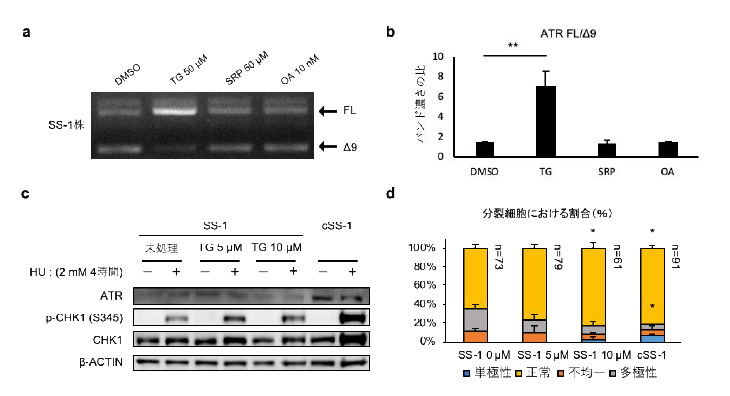
図3 CLK1阻害剤によるATRエキソン9のスプライシング異常の回復
a. スプライシング制御薬の影響の検証。TG003がスプライシング異常を矯正することが示された。
DMSO:対照群、TG:TG003、SRP:SRPIN340、OA:Okadaic acid、FL:正常アイソフォーム、Δ9:エキソン9スキッピングアイソフォーム
b. スプライシング制御薬を添加した場合のSS-iPS細胞株由来神経前駆細胞におけるエキソン9スキッピングアイソフォームに対する正常アイソフォームの比。
c. TG003によるATRのリン酸化活性障害の回復。
HU:ヒドロキシウレアによる複製ストレス誘発の有無、ATR:ATRタンパク質の量、 p-CHK1-S345:リン酸化したCHK1の量、 CHK1:CHK1の量、 β-actin:β-actinの量(補正用コントロール)
d. TG003による紡錘体形成異常の緩和。(TG003の処理濃度を株名横に記載)
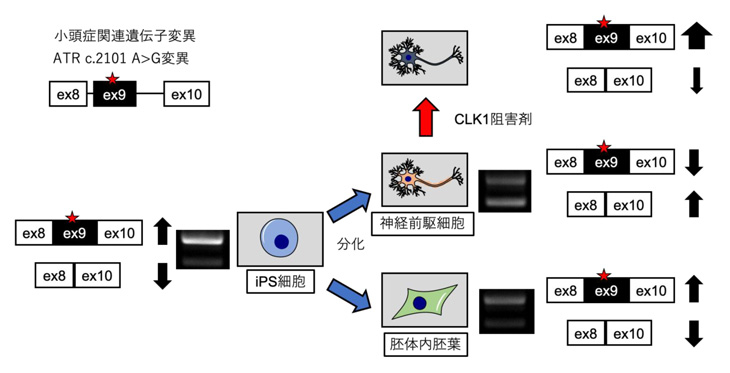
図4 セッケル症候群患者さん特異的iPS細胞を用いた本研究の成果
(星印:ATR c.2101 A>G変異の位置、黒矢印:各アイソフォームの変動、ex:エキソン)
本研究では、SS-iPS細胞株モデルを用いることで、ATR c.2101 A>G変異によってSS-NPCsにおいて細胞種特異的スプライシングが起こること、およびスプライシング異常がSS-NPCsの分裂に及ぼす作用を明らかにしました。また、これらの表現型は、SS-NPCsにスプライシング制御薬を用いることで緩和されました。
現在までに、複数のATR遺伝子変異とスプライシング異常との関連が示唆されてきましたが、実際に患者さんの神経系の細胞を観察した例はありませんでした。今後、さまざまな分化段階や神経系細胞のサブタイプでの解析により、SSの詳細な病態解明に繋がると考えられます。
- 論文名
"Verification and rectification of cell type-specific splicing of a Seckel syndrome-associated ATR mutation using iPS cell model." - ジャーナル名
Journal of Human Genetics - 著者
Jose Ichisima1*, Naoya M. Suzuki1, Bumpei Samata1, Tomonari Awaya2, Jun Takahashi1, Masatoshi Hagiwara2, Tatsutoshi Nakahata1,3 & Megumu K. Saito1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所 臨床応用研究部門
- 京都大学大学院医学研究科 生体構造医学講座 形態形成機構学教室
- 京都大学 iPS細胞研究所 基盤技術研究部門
本研究は、下記機関より資金的支援を受けて実施されました。
-
日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
疾患特異的iPS細胞の利活用促進・難病研究加速プログラム - 日本学術振興会
注1)スプライシング
遺伝子情報の元となるDNAからRNAが転写される際に、タンパク質合成に使われる配列であるエキソンをつなぎ合わせる過程。この過程に障害が起こると、タンパク質翻訳に必要な情報の不足や余分な情報の追加により病気につながることがある。
注2)エキソン
主にタンパク質合成に必要な配列が含まれるmRNAの構成単位である。
注3)アイソフォーム
異なるエキソンの組み合わせで構成されるmRNAのタイプ。






















