
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2020年6月26日
DNAメチル化酵素DNMT3AおよびDNMT3Bの特異的機能の発見 -哺乳類の発生過程やがん発症のメカニズム解明に貢献-
山田 泰広(東京大学医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野 教授)
山本 拓也(京都大学iPS細胞研究所(CiRA)未来生命科学開拓部門/京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)准教授)
八木 正樹(ハーバード大学 リサーチフェロー、元東京大学医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野 助教)
蒲田 未央(京都大学iPS細胞研究所(CiRA)未来生命科学開拓部門 特定職員)
- DNAメチル化(注1)の異常は、がん発生の原因に大きくかかわっている。研究グループは、DNA低メチル化ES細胞(注2)を用いた実験により、世界で初めてDNAメチル化酵素DNMT3AとDNMT3B(注3)の特異的標的部位の同定に成功し、哺乳類の発生過程でのDNAメチル化制御機構の一端を明らかにした。
- DNMT3Aは分化関連遺伝子を、DNMT3BはX染色体遺伝子を特異的にメチル化することを明らかにした。またDNMT3遺伝子に変異を有するがん・疾患に特徴的なDNAメチル化異常部位を同定した。
- 本研究成果により、DNAメチル化異常を有するがん・疾患の発症メカニズムがより詳細に解明され、同種のがんに対する新規治療戦略の確立に貢献することが期待される。
DNAのメチル化は哺乳類の個体発生に必須であり、その異常は白血病などのがん発生の原因となることが知られています。八木正樹 研究員(ハーバード大学、元東京大学医科学研究所)、蒲田未央 特定職員(京都大学iPS細胞研究所(CiRA))、山本拓也 准教授(京都大学iPS細胞研究所(CiRA)、同高等研究院ヒト生物学高等研究拠点(ASHBi))、山田泰広 教授(東京大学医科学研究所)らの研究グループは、多能性幹細胞(注4)における遺伝子破壊技術と網羅的なDNAメチル化解析技術を組み合わせることにより、DNAメチル化酵素であるDNMT3Aと DNMT3Bの特異的な標的部位の同定に世界で初めて成功しました。また個体発生過程において、DNMT3Aは分化関連遺伝子を、DNMT3BはX染色体遺伝子を特異的に制御していることが分かりました。
さらに本研究で同定したDNMT3の特異的標的遺伝子は、DNMT3遺伝子に変異を持つがんや疾患においてもメチル化に異常があることが分かりました。本研究成果は、哺乳類の発生過程でのDNAメチル化制御機構の一端の解明に繋がり、さらにはDNAメチル化異常を有するがん・疾患の発症メカニズムの解明や新規治療戦略の確立に貢献できる可能性があります。
遺伝子発現調節を司るDNAメチル化によるエピゲノム制御(注5)は、細胞分化や個体発生など様々な生命現象に重要であり、エピゲノム制御の破綻はがん・疾患の発症に関与することが報告されています。また以前、山田泰広教授らの研究グループは、DNAメチル化が多能性幹細胞の品質維持に重要であることを示しています(Yagi et al., Nature 2017, Yagi et al., Stem Cell Reports 2019)。
哺乳類発生においてDNAメチル化は、着床前に大部分が消去され、着床後の分化過程でDNAメチル化酵素DNMT3AとDNMT3Bによって獲得されます。DNMT3A、DNMT3Bのノックアウトマウス(注6)はそれぞれ早期致死であることから、DNAメチル化酵素は哺乳類個体の発生に必須であることが示唆されていました。しかし、これまでにDNMT3AとDNMT3Bの機能の違いは分かっていませんでした。そこで、本研究では、DNMT3AとDNMT3Bの標的遺伝子の違いを探索することで、DNAメチル化による発生メカニズムの解明、さらにはDNAメチル化異常によるがん・疾患の発症機構を明らかにすることを目指しました。
これまでに、山田泰広教授らの研究グループは、ゲノム情報は正常であるものの大部分がDNA メチル化されていないマウスES細胞の樹立方法を見出していました(Yagi et al., Nature 2017)が、今回、このDNA低メチル化ES細胞を用いて、生体内(In vivo)の発生で起こるDNAメチル化獲得プロセスを試験管内(In vitro)の分化過程で再現しました。遺伝子破壊技術とDNAメチル化解析を組み合わせることで、発生過程におけるDNMT3AとDNMT3Bの特異的標的部位の同定が可能になると仮定し、研究を行いました。独自に樹立したこのES細胞から、DNMT3AとDNMT3Bの欠損株を作製し、分化誘導後の体細胞のDNAメチル化状態を網羅的に調べました(図1)。
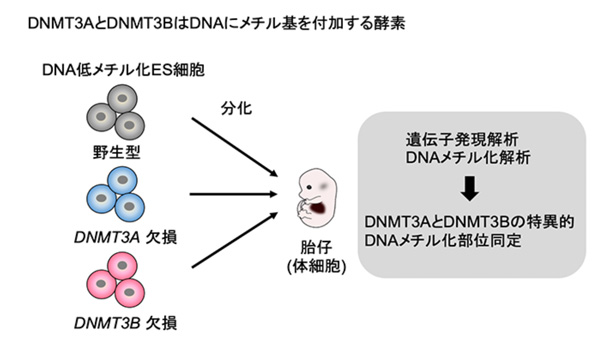
図1. DNMT3AとDNMT3Bの特異的標的部位同定のためのアプローチ
その結果、DNMT3AとDNMT3Bの特異的標的部位を同定することに成功しました。 DNMT3Aは分化関連遺伝子を、DNMT3BはX染色体遺伝子を特異的にメチル化するという、より詳細な仕組みを突き止めることにも成功しました。野生型、DNMT3A欠損、DNMT3B欠損の状態の遺伝子において、それぞれの体細胞におけるDNAメチル化の状態を比較解析したところ、これまでの報告と同様、多くの遺伝子はDNMT3A、DNMT3B両方によって制御されました。一方で、発生に重要な分化関連遺伝子(注7:例: Hox, Tbx, Cbx, Fox遺伝子群など)はDNMT3Aによって、X染色体遺伝子(注8)はDNMT3Bによって特異的にメチル化の制御を受けることが分かりました(図2)。また、DNMT3A、DNMT3BのDNA上への結合能力の違いがそれら遺伝子の機能の違いを生み出すことを発見しました。
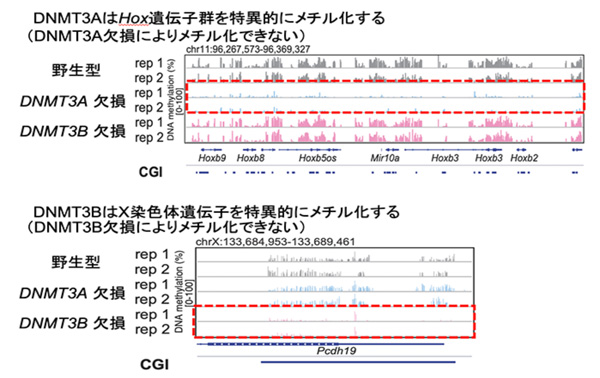
図2. DNMT3AとDNMT3Bの特異的標的遺伝子の例
加えて本研究では、DNMT3変異を有するがん・疾患に特徴的な新規DNAメチル化異常の詳細な仕組みも明らかにすることができました。がんや疾患において、しばしばDNAメチル化異常が報告されています。本研究で同定したDNMT3により特異的にDNAメチル化を受ける遺伝子に着目し、DNMT3変異を有するがんや疾患のDNAメチル化状態を詳細に解析しました。その結果、DNMT3Aの機能欠損変異を有するAML(急性骨髄性白血病)患者、DNMT3Bの機能欠損変異を有するICF症候群(immunodeficiency - centromeric instability - facial anomalies syndrome,注9)患者において、DNMT3によって特異的にDNAメチル化を受ける遺伝子のメチル化レベルは、変異のない同患者と比して有意に低いことが分かりました。これによって、DNMT3変異を有するがん・疾患における新規のDNAメチル化異常の部位を同定することができました(図3)。
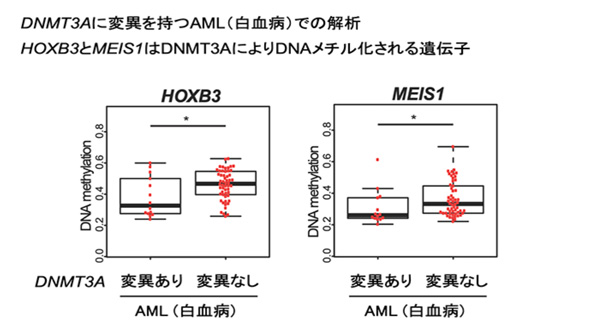
図3. DNMT3変異を有するがん・疾患の新規DNAメチル化異常の例
結論として、本研究では、DNA低メチル化ES細胞を用いることで、これまで不明であった哺乳類の発生過程でのDNMT3AとDNMT3Bの標的遺伝子の同定に、世界で初めて成功しました。DNMT3Aは発生に重要な多くの分化関連遺伝子を、DNMT3BはX染色体遺伝子を特異的にメチル化していることが明らかとなり、DNMT3遺伝子は発生やX染色体不活化(注10)の制御に重要な役割を果たすことが示唆されました(図4)。
DNMT3変異を有するがん・疾患に特徴的なDNAメチル化異常を発見した本研究成果は、DNAメチル化による哺乳類発生メカニズムの一端の解明に繋がり、DNAメチル化異常によるがん・疾患の発症メカニズムの解明や新たな治療法開発にも貢献できることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」、次世代がん医療創生研究事業(P-CREATE)、および日本学術振興会 (JSPS) 科学研究費助成事業の研究助成により実施しました。
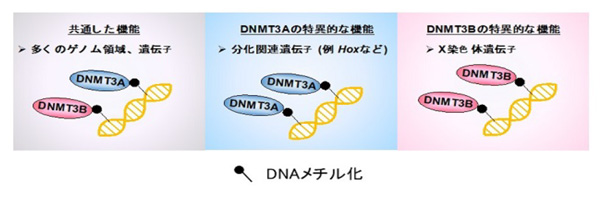
図4. 本研究のまとめ 〜DNMT3AとDNMT3Bの特異的制御遺伝子の同定〜
- 論文名
Identification of distinct loci for de novo DNA methylation by DNMT3A and DNMT3B during mammalian development - 雑誌名
Nature Communications(6月24日オンライン版) - 著者
Masaki Yagi#, Mio Kabata#, Akito Tanaka, Tomoyo Ukai, Sho Ohta, Kazuhiko Nakabayashi, Masahito Shimizu, Kenichiro Hata, Alexander Meissner, Takuya Yamamoto*, Yasuhiro Yamada*
(#:共同第一著者、 *:共同責任著者) - DOI番号:10.1038/s41467-020-16989-w
(注1) DNAメチル化
DNAの中の主にCG配列の部分においてメチル基が付加される化学反応。メチル基が付加されるCG配列は細胞の種類によって異なり、遺伝子の発現量と相関する。哺乳類の個体発生に必須で、その異常は白血病などのがん発生の原因となることが知られている。
(注2) DNA低メチル化ES細胞
DNAメチル化をほとんど持たない胚性幹細胞(ES細胞)。通常、ES細胞のDNAは高度にメチル化されている。研究グループは、特殊な化合物の存在下で樹立したES細胞は大部分のDNAメチル化を失っていることを見出している(Yagi et al., Nature 2017)。
(注3) DNAメチル化酵素DNMT3A、DNMT3B
DNAにメチル基を付加する酵素のことを指し、DNMT3AとDNMT3Bが代表的なメチル化酵素として知られている。
(注4) 多能性幹細胞
ほぼ無限に増殖することができ、様々な細胞へと分化する能力を有する細胞を指す。代表的な多能性幹細胞として、iPS細胞(人工多能性幹細胞)やES細胞(胚性幹細胞)が挙げられる。
(注5) エピゲノム制御
DNAの塩基配列の変化を伴わずに、遺伝子発現を制御する機構であり、発生に重要な役割を果たす。DNAメチル化やヒストン修飾は代表的なエピゲノム制御として知られている。
(注6) ノックアウトマウス
全身の細胞で特定の遺伝子の機能を破壊したマウス。
(注7) 分化関連遺伝子
発生に重要な役割を果たす転写因子(遺伝子)を指し、主にDNAメチル化とヒストン修飾により発現制御を受ける。
(注8) X染色体遺伝子
哺乳類の性染色体の一つであるX染色体上の遺伝子を指す。
(注9) ICF症候群(immunodeficiency - centromeric instability - facial anomalies syndrome )
免疫不全や顔貌異常を伴う先天性疾患でDNAメチル化酵素DNMT3Bに遺伝子変異がみられる。
(注10) X染色体不活化
雄では1本、雌では2本のX染色体が存在する。X染色体遺伝子の発現量を雌雄間で等価にするために、雌のX染色体の2本のうち1本が着床後に不活化される現象を指す。
Yagi M, Kishigami S, Tanaka A, Semi K, Mizutani E, Wakayama S, Wakayama T, *Yamamoto T, *Yamada Y.
Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation.Nature. 2017 Aug 10;548(7666):224-227.
Yagi M, Kabata M, Ukai T, Ohta S, Tanaka A, Shimada Y, Sugimoto M, Araki K, Okita K, Woltjen K, Hochedlinger K, *Yamamoto T, *Yamada Y.
De novo DNA methylation at imprinted loci during reprogramming into naive and primed pluripotency.Stem Cell Reports. 2019 May 14;12(5):1113-1128. doi: 10.1016/j.stemcr.2019.04.008






















