
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2021年1月18日
動物由来の成分を含まないより安全な製法でiPS細胞から大量の再生T細胞を培養する方法の開発 〜T細胞を使ったがん免疫療法での利用も〜
ポイント
- フィーダー細胞注1)や牛の血清など、動物由来成分を使わずにT細胞へと分化させる系を確立した。
- SDF1αとp38阻害剤を組み合わせることで、T細胞への分化効率が高くなった。
- iPS細胞ストック注2)から作製したT細胞で抗原注3)特異的な攻撃能力が確認された。
入口 翔一 研究員(CiRA増殖分化機構研究部門、T-CiRAプログラム)、安井 裕 元研究員(CiRA同部門)、河合 洋平 研究員(CiRA 同部門、T-CiRAプログラム)、金子 新 教授
(CiRA 同部門、T-CiRAプログラム)らの研究グループはヒトiPS細胞から、効率良くかつ大量にT細胞を生産する方法を開発しました。
T細胞を使った免疫療法を広く利用するためには、使用するT細胞の供給源として、予めT細胞を作製して保存しておく方法も考えられます。これまでのT細胞へと分化させる方法ではフィーダー細胞を使う必要があり、医療用のT細胞を大量に作製することは困難でした。研究グループはフィーダー細胞を使わずに大量にT細胞を得る方法を開発しました。がん細胞を認識するT細胞から作ったiPS細胞を用いて、この方法でT細胞を再生すると、もとのT細胞と同じがん細胞を認識する能力があることも確認できました。また、再生したT細胞にリンパ球性白血病細胞に高発現している抗原を認識するキメラ抗原受容体(CAR)を導入すると、リンパ球性白血病細胞に対する抗腫瘍効果を付与できる事も確認できました。このシステムは医療用のT細胞を大量に生産することや、ヒトのT細胞分化に関する研究にも利用できると期待されます。
この研究成果は2021年1月18日(日本時間)に「Nature Communications」で公開されました。
がんの治療法としてCAR-T細胞療法が、米国をはじめ日本でも承認され、治療として使われるようになったことにより、T細胞を使った免疫療法はより幅広い疾患に対して利用できると期待され、開発が進んでいます。こうしたT細胞を使った免疫療法を広く利用できるものにするためには、予めT細胞を作製し保存しておくことも一つの方法です。
iPS細胞技術をつかうことで、T細胞を予め作製しておくことはできます。しかし、T細胞への分化効率が低いこと、大量生産ができないことが課題となっていました。T細胞への分化誘導の過程には、各段階でフィーダー細胞を使う必要がありました。臨床応用するにあたっては、ウイルス汚染がない安全性の確保された細胞を使う必要があり、非常に高額となる、あるいは入手できない場合もありました。
そこで研究グループは、臨床応用に適した条件で、ヒトiPS細胞から高効率かつ大規模にT細胞を作製する方法の開発に取り組みました。
1) T細胞分化培養条件の最適化
iPS細胞からT細胞へと分化させる段階を4つの段階に分け、各段階でマウスの細胞を使うかわりに、タンパク質や化合物などを利用して、分化させる方法を開発しました。さらに、大量のT細胞を安定して得るために、T細胞が成熟する場所である胸腺の細胞で、重要な役割を果たすと考えられる因子(SDF1α、p38阻害剤)を培養液中に追加しました。すると、SDF1αおよびp38阻害剤を追加した時に最も多くのT細胞を得ることができました。
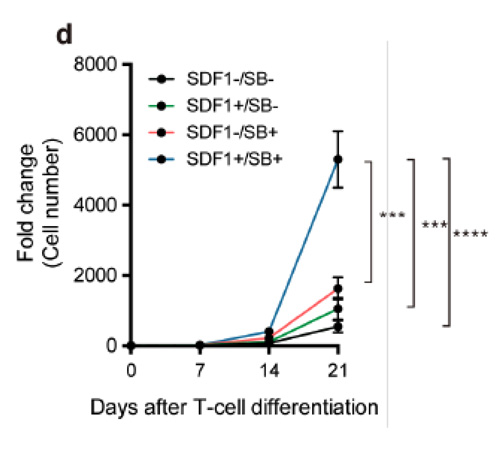
Fig.1 T細胞へと分化する細胞数
SDF1αおよびp38阻害剤(SB203580)を添加した場合、
分化誘導から21日目に細胞数が飛躍的に増加する。
2) 作製したT細胞は正しく機能する
iPS細胞にWilms tumor 1(WT1)を認識するT細胞受容体の遺伝子を導入した細胞から、確立した方法を用いてT細胞を作製しました。免疫不全マウスにWT1発現細胞を投与し、作製したT細胞(WT1-iCD8αβT)を移植したところ、移植しなかった場合(HBSS)と比べて、がんの増大を抑制し、生存期間も長くなりました。つまり、がんを認識して攻撃する機能を持っていることが確認できました。
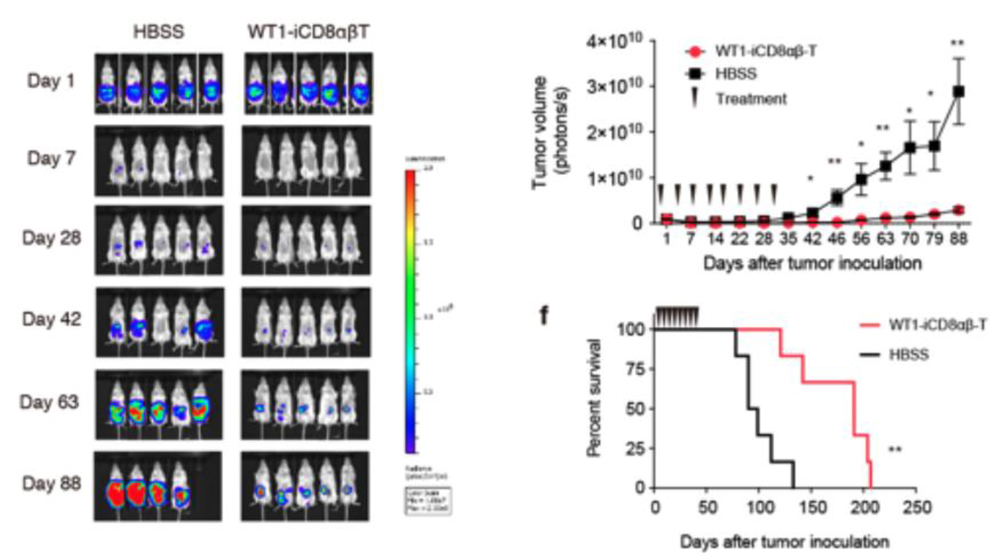
Fig.2 T細胞の機能評価
左 図:マウス体内の腫瘍のサイズ
右上図:左図の腫瘍のサイズを計測したもの
右下図:移植後のマウスの生存曲線
3)再生T細胞はCART細胞作製の原材料となりうる
今回確立した手法で作製した再生T細胞がCART細胞作製の原材料となりうるか検証するため、再生T細胞にCAR-T療法で使用されているCD19タンパク質を認識するキメラ抗原受容体を遺伝子導入して、iCART細胞を作製し、その抗腫瘍効果を評価しました。急性リンパ球性白血病細胞株を予め移植した免疫不全マウスにiCART細胞を投与したところ、iCART細胞を投与した個体は顕著な延命効果を認めました。本手法で作製した再生T細胞はCAR-T細胞の作製する際の原材料にもなりうる事が確認できました。
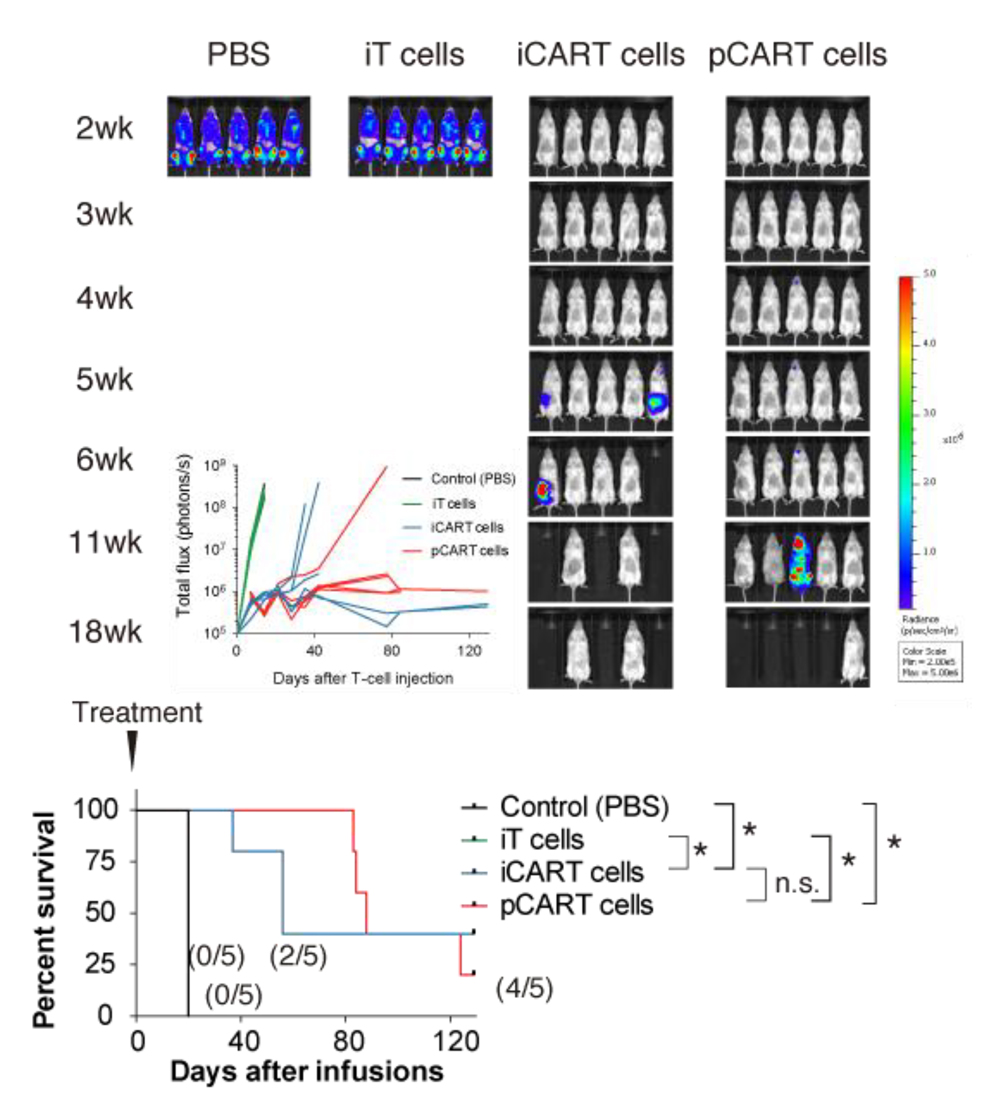
Fig.3 iCART細胞の抗腫瘍効果
上図:マウス体内の腫瘍サイズ
下図:移植後のマウスの生存曲線
iPS細胞を維持培養する段階からT細胞を増殖させる段階まで、フィーダー細胞を使わない条件で実施したことで、T細胞の大量培養をすることができるようになりました。さらに、SDF1αとp38阻害剤をT細胞への分化段階で同時に添加したところ、T細胞への分化が促進されました。こうして再生されたT細胞は、T細胞として標的を認識して攻撃する機能を持っていることが確認できました。このシステムは医療用の多数の再生T細胞を生産することや、ヒトのT細胞分化の研究にも利用できると考えられます。
- 論文名
A clinically applicable and scalable method to regenerate T-cells from iPSCs for off-the-shelf T-cell immunotherapy - ジャーナル名
Nature Communications - 著者
Shoichi Iriguchi1,2,*, Yutaka Yasui1,*, Yohei Kawai1,2,*, Suguru Arima2,3, Mihoko Kunitomo2,3,
Takayuki Sato2,3, Tatsuki Ueda1, Atsutaka Minagawa1,2, Yuta Mishima1,2, Nariaki Yanagawa1,2,
Yuji Baba2,3, Yasuyuki Miyake1,2, Kazuhide Nakayama2,3, Maiko Takiguchi2,3, Tokuyuki Shinohara2,3,
Tetsuya Nakatsura4, Masaki Yasukawa5, Yoshiaki Kassai2,3, Akira Hayashi2,3, and Shin Kaneko1,2,**
* 筆頭著者
**責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA共同研究プログラム(T-CiRA)
- 武田薬品工業株式会社T-CiRAディスカバリー
- 国立がん研究センター 先端医療開発センター
- 愛媛大学大学院医学系研究科
本研究は、下記機関より支援を受けて実施されました。
- 文部科学省 科研費(23591413, 15H04655, 15J05263, 26293357, 18K16085)
-
国立研究開発法人 日本医療研究開発機構(AMED)
次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)
再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点 - T-CiRA
- 武田薬品工業株式会社
- サイアス株式会社
注1) フィーダー細胞
目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞。通常は薬剤処理によって分裂できないように処理されている。iPS細胞を培養する際には、マウス胎仔由来の線維芽細胞などがフィーダー細胞として用いられることがある。
注2) iPS細胞ストック
免疫拒絶反応が起きにくい細胞を、健康なボランティアの方から提供していただき、作製した医療用のiPS細胞。iPS細胞研究財団から提供されている。
注3)抗原
生体内に入ると免疫系を刺激して、特異的な反応を誘発させる物質の総称。






















