
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2021年3月12日
CRISPR-Cas9がヒト細胞内のRNAで阻害されてしまう現象を発見し、iPS細胞での効率的な相同組み換えゲノム編集技術を実現
ポイント
- 細胞内のRNAがCRISPR-Cas9注1)タンパク質とガイドRNA(sgRNA)の結合を阻害することを発見。
- 従来使われていた、細胞内でCas9を強制発現させる手法よりも、あらかじめCas9タンパク質とsgRNAを複合体形成させておく手法によって、より効率的にゲノム編集ができる仕組みを解明。
- 電気穿孔法注2)によるCas9/gRNA複合体導入条件の最適化により、iPS細胞内での相同組換え注3)を介したゲノム編集効率を向上。薬剤選択を使わなくても、両アレルの単一塩基変異を一度に修復したり、loxP配列注4)を挿入したり、HLA-C1グループをHLA-C2グループ注5)に書き替えたりすることに成功した。
CRISPR-Cas9システムと鋳型一本鎖DNA(ssODN)を用いることにより、iPS細胞等での一塩基変換が可能となってきましたが、両アレルの同時改変や、loxP配列のような少し長めの配列を挿入する手法は効率が悪いという課題を抱えていました。
鍵田明宏 元大学院生(CiRA臨床応用研究部門)、Mandy Lung 教務補佐員(CiRA同部門)、徐 淮耕 元特定研究員(CiRA同部門)、Peter Gee 元特定研究員(CiRA同部門)、堀田秋津 講師(CiRA同部門)らの研究グループは、Cas9がヒト細胞内で働く際、細胞内のRNAがCas9のsgRNAへの結合を阻害することで、Cas9の酵素活性を下げてしまうことを明らかにしました。この細胞由来RNAによる阻害を防ぐため、Cas9とsgRNAを事前に複合体を形成させてから細胞に導入すると、Cas9をベクターから強制発現させる手法と比較して、高いゲノム編集効率を示しました。また、iPS細胞にCas9やsgRNA、鋳型ssODNを導入する際に用いる電気穿孔法の条件を検討することで、薬剤選択を用いることなく、両アレルにおける単一塩基の書き換え効率が最大70%、Cre/loxP組み換え反応におけるloxP配列の挿入効率が最大40%まで向上しました。さらにHLA遺伝子においてHLA-C1/C1アレルをC1/C2アレルに書き換えることにも成功しました。
この研究成果は2021年3月11日(日本時間)に「Stem Cell Reports」で公開されました。
CRISPR-Cas9システムを用いたゲノム編集技術の進歩により、患者さん由来iPS細胞において病原変異を修復したり、健常人由来iPS細胞に特定の変異を導入したりすることで、遺伝子の機能解析や病態再現を行うことが可能になっています。ヒトの病原変異の半数以上は一塩基多型(SNP) 注6) であるとの報告もあり、iPS細胞を用いた疾患研究においてSNPを導入する技術は重要です。CRISRP-Cas9でゲノムを切断した部位に鋳型ssODNを用いることで、相同組み換えによるDNA修復を誘導し、一塩基レベルの正確なゲノム編集が可能になります。しかし、ssODNを用いたゲノム編集は効率が悪く、父親由来アレルと母親由来アレルの両方の一塩基変異を一度に修復したり、loxPサイトのような長め(34塩基)の配列を挿入したりすることは困難でした。
CRISPR-Cas9およびsgRNAを細胞内へ導入する方法には様々なものがありますが、最近では特に、Cas9タンパク質とgRNAの複合体をリボ核タンパク質(RNP)として送達する方法の効率が良いとして多く使用されています。しかし、なぜRNP導入方法だと効率が良いのか、解明されていませんでした。そこで本研究グループは、複数のCas9導入方法を調査した結果、Cas9タンパク質とgRNAの複合体を導入する方法では、Cas9タンパク質の細胞内量が他と比較して低いにも関わらず、高いゲノム編集効率を示す事を見出しました。一方、Cas9タンパク質とgRNAを別々に細胞内に導入すると、ゲノム編集効率が大きく低下したことから、Cas9とgRNAを予め混合して複合体を形成しておくことが重要であることも分かりました。
1) Cas9タンパク質がsgRNAに結合する際の細胞内RNAによる干渉
研究グループはまず、ヒト細胞内のどの因子がCas9の切断活性に影響を与えているか調べるため、試験管内でCas9タンパク質の切断活性を測定しました。その結果、sgRNAと複合体を形成する前のCas9に細胞内RNAを加えると切断活性が減少することがわかりました(図1)。一方、同様の条件下で細胞由来ゲノムDNAもしくは細胞由来タンパク質を添加しても、切断活性の阻害は見られませんでした。つまり、細胞内のCas9タンパク質が細胞由来のRNAと先に出会うと、gRNAとの結合が阻害されてゲノム編集効率が低下してしまうため、Cas9タンパク質とgRNAを予め混合しておくことが重要であることが明らかとなりました。
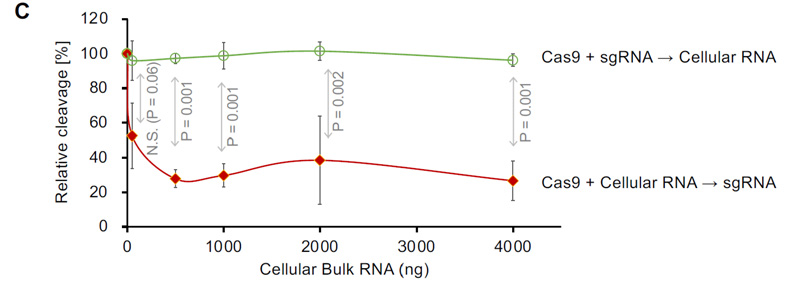
図1 試験管内でCas9タンパク質に細胞内のRNAを加えてから15分後にsgRNAを加えた場合(赤線)と、sgRNAを加えてから15分後に細胞由来RNAを加えた場合(緑線)のCas9の切断活性の比較。
横軸は加えたRNA量、横軸は相対切断活性を示す。
2) 三好型ミオパチー患者さん由来iPS細胞におけるDysfelin(DYSF)遺伝子の両アレル修復
次に、iPS細胞でのRNP法を用いたゲノム編集を高めるために、電気穿孔法の条件検討を行いました。4D-NucleofectorとMaxCyteという二種類の電気穿孔法を用いて、疾患に関連する一塩基変異を修復する効率を比較しました。
筋ジストロフィーの一種である三好型ミオパチーは、Dysfelin(DYSF)遺伝子の変異が原因のであることが知られています。我々が対象とした患者さんにおいては、DYSF遺伝子の両アレルにナンセンス変異注7)をもっているため、この両アレルの点変異修復を試みました。Cas9タンパク質とgRNAを混合し、鋳型ssODNと共に患者さん由来iPS細胞に導入した結果、MaxCyte電気穿孔法を用いることで、67から73%と非常に高い一塩基修復効率を示しました。この細胞からサブクローンを複数樹立して解析すると、45株中33株(73.3%)で、両アレルのナンセンス変異が修復されていることがわかりました。
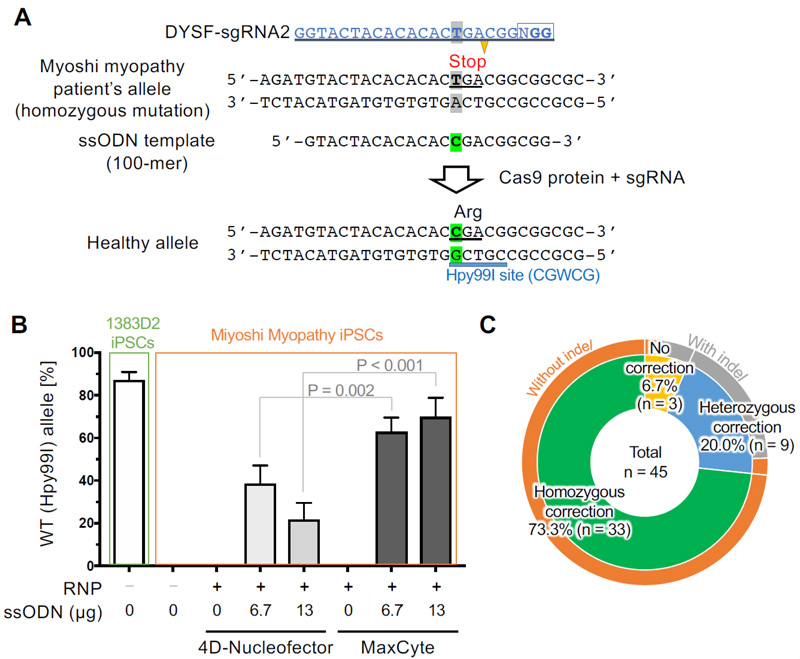
図2 三好型ミオパチー患者さん由来のiPS細胞における変異修復。
(A) 用いた三好型ミオパチー患者さん由来iPS細胞では、Dysferlin遺伝子の29番エクソンにナンセンス突然変異がある。この変異Tを塩基Cに書き換えると、ナンセンス変異が修復され、かつ制限酵素Hpy99Iで切断できるようになるため、修復効率を簡便に検出できる。
(B) 4D-NucleofectorとMaxCyteを用いたDYSF遺伝子変異修復効率比較。Hpy99Iで切断し、切断された割合を定量することで修復効率を算出している。
(C) MaxCyteを用いて修復した患者さん由来iPS細胞のサブクローンにおける修復結果のパイチャート。両アレル修復(緑色)、片アレル修復(青色)、修復なし(黄色)で修復結果が示され、挿入欠失の有無を橙色と灰色で区別している。
3) loxP配列の挿入
loxP配列をゲノム上の二箇所に同じ向きで挿入すると、Creリコンビナーゼという酵素を働かせることにより、その間の領域を大きく削除することができます。CRISPR-Cas9では誘導できないような巨大な欠失も誘導できるため、遺伝子工学の分野では古くから用いられてきましたが、loxP配列は比較的長さがある(34塩基)ため、ゲノム編集技術を用いても、薬剤選択を用いた選択をしない限り、ゲノム上の狙った位置へ挿入することは困難でした。我々は上記で検討した条件を用いて、loxP配列を含む鋳型ssODNを設計し、ジストロフィン遺伝子領域への挿入を試みました。その結果、薬剤選択を用いなくても、14.3%および40%の効率で、loxP配列を二箇所にそれぞれ挿入することに成功しました。

図3 loxP配列の挿入実験
(A) ジストロフィン遺伝子のエクソン45付近に一つ目のloxP配列、エクソン55下流に二つ目のloxP配列を挿入。
(B) 一つ目のloxP配列を挿入したiPS細胞サブクローンのシーケンス解析結果。20株中、8株でloxP配列が挿入されていた。
(C) 二つ目のloxP配列を挿入したiPS細胞サブクローンのシーケンス解析結果。解析した14株中、2株で欠損のないloxP配列が挿入されていた。
4) HLA-C1/C1ハプロタイプをもつiPS細胞のHLA-C1/C2ハプロタイプへの書き換え
iPS細胞由来細胞を用いた細胞治療において、他家移植でも免疫拒絶を受けないようにするためには、HLA型が一致することが重要です。CiRAおよびiPS細胞研究財団では、HLAホモiPS細胞やゲノム編集によるHLA編集iPS細胞を製造して備蓄するプロジェクトを進めています。しかしHLA-Cをホモ接合体で持つ細胞や、ゲノム編集でHLA-Cを片アレルしか持たない細胞は、HLA-C1/C2ヘテロ接合体を持つレシピエントの免疫細胞の1つであるNK細胞によって攻撃される恐れが報告されています。これは、NK細部の持つKIRと呼ばれる受容体とHLA-CのC1またはC2アレルの不一致によるものです(図3(A))。HLA-C1とC2の違いは、HLA-Cタンパク質の77番目と80番目の二箇所のアミノ酸の違いによることが分かっているため、研究グループはゲノム編集を用いることで、HLA-C1/C1をHLA-C1/C2アレルへと変換することを試みました(図3(B))。その結果、目的の書き換えが起きたクローンを得ることができました(図3(C), (D))。それぞれのアレルの導入効率は24%および28%でした。
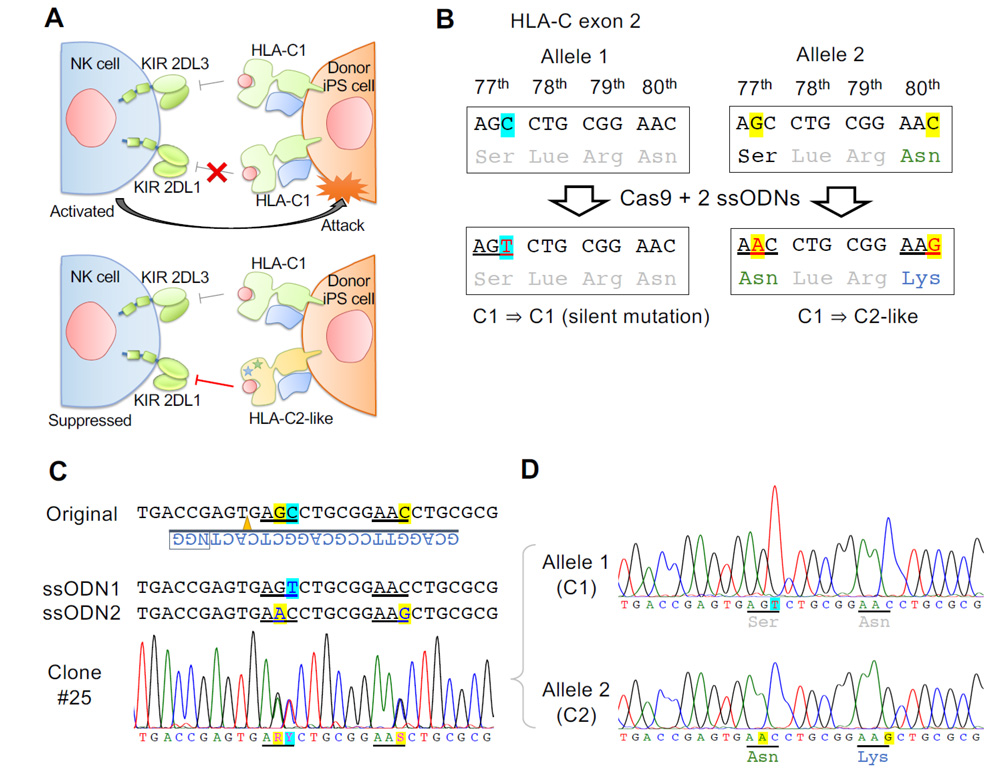
図4 HLA-C1/C1アレルを有するiPS細胞をHLA-C1/C2アレルへ置換
(A) HLA-C1/C2ヘテロ接合体を有するドナーのNK細胞は、KIR-2DL3とKIR 2DL1受容体を発現し、それらはHLA-C1およびC2の抑制性の受容体である。ここにHLA-C1/C1ホモ接合体のiPS細胞が移植されると、HLA-C2とKIR 2DL1の組み合わせの抑制性のシグナルが機能しないため、移植先のNK細胞に攻撃される恐れがある。
(B) HLA-C1とC2のアミノ酸は77番目と80番目が異なる。2つの一本鎖オリゴDNAはそれぞれCas9の再切断の抑制、C1のC2様配列への書き換えを担う。
(C) Cas9とsgRNA、鋳型ssODNを導入後、目的の書き換えが行われた株のシーケンス結果。
(D) 目的の株のHLA-C1とC2アレルの配列。
本研究により、iPS細胞においてCas9とsgRNAを事前に複合体を形成させることで、細胞内のRNAによるCas9の活性阻害を防ぐことができることが明らかになりました。また、電気穿孔法条件の最適化により、鋳型ssODNを用いた遺伝子導入を非常に高い効率で実現することに成功しました。本研究により、iPS細胞における標的部位の正確かつ高効率な編集が可能になり、疾患解析や再生医療への応用が加速することが期待されます。
- 論文名
Efficient ssODN-Mediated Targeting by Avoiding Cellular Inhibitory RNAs through Precomplexed CRISPR-Cas9/sgRNA Ribonucleoprotein - ジャーナル名
Stem Cell Reports - 著者
Akihiro Kagita1*, Mandy S.Y. Lungi1*, Huaigeng Xu1*, Yuto Kita1, Noriko Sasakawa1, Takahiro Iguchi1, Miyuki Ono1, Xiou H. Wang1, Peter Gee1, Akitsu Hotta1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
本研究は、下記機関より資金的支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)
注1) CRISPR-Casシステム
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)という塩基配列とCas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。ゲノム編集技術の一つ。
注2) 電気穿孔法
数百ボルトの短い電気パルスを使って、DNAやRNAなどの高分子を細胞内に導入する手法。エレクトロポレーションとも呼ばれる。
注3) 相同組換え
相同組換えとは、DNAの塩基配列が同一の領域(相同部位)で起こる組換え。二本鎖のDNAには、切断や変異が起こっても相補鎖を元に修復する機能が備わっており、これらの性質を応用して目的の場所の遺伝情報を変える技術。
注4) loxP配列
バクテリオファージ(細菌の細胞中に存在するウイルス)が持つ34塩基の配列で、Creリコンビナーゼという酵素の作用により、細菌のゲノムへとファージゲノムが挿入される際に使用される。loxP配列が同方向に二つ存在する所でCreリコンビナーゼを働かせると、二つのloxP配列間で組み換えが起こり、間に巨大なDNA配列があっても、欠失を誘導することができる。
注5) HLA-C1およびHLA-C2
HLAとはヒトの主要組織適合遺伝子複合体(MHC)であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する際に用いられる。また、ヒトの免疫(抗原提示)で重要な分子として働く。HLAの型(ハプロタイプ)は非常に多様で、A座(HLA-A)、B座(HLA-B)、C座(HLA-C)などと呼ばれる遺伝子座から作られるタンパク質の組み合わせで構成されており、各HLAタンパク質に数十種類以上の型があるため、あわせて数万通りの組み合わせがある。そしてHLA-C座の場合、HLA-C*01, HLA-C*04, HLA-C*07などの型があり、これらの型はさらにHLA-C1グループ(HLA-C*01やHLA-C*07など)と
HLA-C2グループ(HLA-C*04など)に分類される。父親アレルと母親アレルが同じHLA-C1グループのHLA-C型(例: 父親からHLA-C*01、母親からHLA-C*07)であればHLA-C1/C1となり、別々のHLA-CグループのHLA-C型(例: 父親からHLA-C*01、母親からHLA-C*04)であれば、HLA-C1/C2となる。
注6) 一塩基多型 (SNP)
ヒトがもつ塩基対のうち、人種や個人によって異なる領域があり、そのうち1塩基だけが別の塩基に置換されているもの。個人の体質や薬剤応答性、疾患リスクなどに関与しているものもある。
注7) ナンセンス変異
タンパク質を合成(翻訳)する時のアミノ酸情報(コドン)が終止コドンとなる変異。タンパク質合成が途中で終了してしまう。






















