
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2021年7月27日
ポリジメチルシロキサン製マイクロ流体デバイスを用いた肝臓チップの創薬応用
ポイント
- ポリジメチルシロキサン注1)製マイクロ流体デバイス注2)に対する薬物収着が、薬物のS+logD値注3)と相関することを見出した。
- ポリジメチルシロキサン製マイクロ流体デバイスで培養した肝細胞が、ポリスチレン注4)製プレートで培養したヒト肝細胞と同程度の機能を有していることを確認した。
マイクロ流体デバイスに肝臓構成細胞を搭載したLiver-on-a-chip(肝臓チップ)は、肝機能の一部を再現できるモデルとして、創薬応用が期待されています。多くのマイクロ流体デバイスはポリジメチルシロキサン(PDMS)というシリコーンエラストマー注5)を素材として作製されます。PDMSは疎水性(水に溶けにくい性質)が高く、低分子化合物を収着しやすいことが報告されていますが、実際にどのような薬物がPDMSに収着するか十分には調べられていませんでした。
そこで、出口清香(CiRA増殖分化機構研究部門 高山和雄研究室・大学院生)、鳥澤勇介(元・京都大学大学院工学研究科・特定准教授)、高山和雄(CiRA増殖分化機構研究部門・講師)らの研究グループは、PDMS製マイクロ流体デバイスにおける薬物収着を予測する方法の開発を試みるとともに、PDMS製マイクロ流体デバイスを用いて作製した肝臓チップを用いてどのような薬物応答試験が実施できるか検討しました。
その結果、PDMS製マイクロ流体デバイスへの低分子化合物の収着率は、低分子化合物の分配係数(S+logD)と相関することを見出しました。また、PDMS製マイクロ流体デバイスを用いて作製した肝臓チップを用いて、S+logD値の低い(約2以下)低分子化合物に対する肝細胞の反応を観察できることを確認しました。
この研究成果は2021年7月20日に「ACS Biomaterials Science & Engineering」でオンライン公開されました。
Organ-on-a-chipは、マイクロ流体デバイス上で細胞を培養し、臓器機能の一部をin vitro(生体外)で再現できる技術です。Liver-on-a-chip(肝臓チップ)とは、マイクロ流体デバイスに肝細胞および非実質細胞(肝細胞以外の細胞)などの肝臓構成細胞を搭載した肝臓モデルです。肝臓チップでは、生体内の三次元的な動的環境を再現した条件で肝臓構成細胞を培養できます。ディッシュやマルチウェルプレート上で二次元的に培養した肝臓構成細胞と比べて、肝臓チップはより高次な肝機能を獲得できるため、肝疾患研究や薬物代謝試験、薬物毒性試験などへの応用が期待されています。
ポリジメチルシロキサン(PDMS)は、シリコーンエラストマーの一種で、マイクロ流体デバイスの素材として長年にわたって使用されています。PDMSは加工しやすく、微細な流路構造の作製に適した素材です。また、PDMSは弾性が高いため、細胞に臓器運動様の収縮刺激を負荷するためのデバイスとしても活用されています。しかし、PDMSは疎水性が高いため、低分子化合物が収着しやすいことが懸念されているものの、実際にどのような低分子化合物が吸着するか定量的に評価した研究は十分に行われていませんでした。
本研究では、肝機能評価に使用される低分子化合物のPDMSへの収着率を評価し、収着率と相関するパラメータ探索を行いました。また、PDMS製マイクロ流体デバイス(PDMS製デバイス)を用いて作製した肝臓チップで、どのような薬物応答試験が実施できるか検討しました。
1) PDMS製マイクロ流体デバイスで培養したヒト肝細胞は、ポリスチレン(PS)製マルチウェルプレート(複数のくぼみのある皿)で培養したヒト肝細胞と同等の機能を有する
PDMS製デバイスとして、上下二つの流路が多孔質のポリエチレンテレフタレート(PET)注6)膜により仕切られたマイクロ流体デバイスを使用しました(図1A)。PDMS製デバイスおよびポリスチレン製マルチウェルプレート(PS製プレート)にヒト肝細胞を播種したところ、どちらの器材においても、肝細胞は肝マーカーであるアルブミンおよびHNF4α、CK8/18を高発現していました(図1B)。ヒト肝細胞から分泌される培養上清中アルブミン量に関しても、PDMS製デバイスおよびPS製プレートの間に差はありませんでした。以上の結果から、PDMS製デバイスで培養した肝細胞は、PS製プレートで培養した肝細胞と同程度の機能を有していることが分かりました。
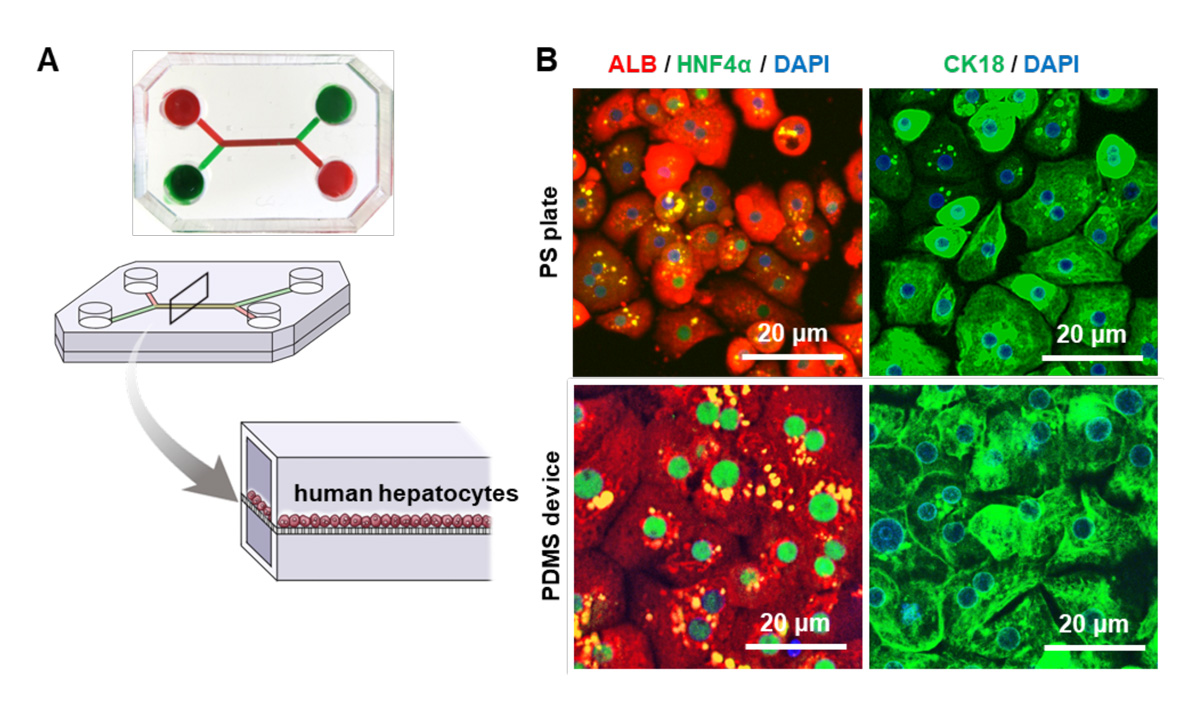
(図1A)マイクロ流体デバイスの構造。PET膜で仕切られた上下二つの流路を持つ。
(図1B)PDMS製デバイスおよびPS製プレートで培養したヒト肝細胞におけるアルブミン(赤)、HNF4α(緑)、CK8/18(緑)の免疫染色結果。DAPI(青)で核染色を実施。
2) PDMS製マイクロ流体デバイスにおける低分子化合物の収着試験
次に、肝臓における薬物代謝酵素注7)活性およびトランスポーター注8)活性の評価に使用される12種類の低分子化合物がPDMS製デバイスに収着するかどうか評価しました。PDMS製デバイスに対する収着率は低分子化合物の種類によって大きく異なることが分かりました。低分子化合物の一種であるミダゾラム(midazolam)、ブフラロール(bufralol)、シクロスポリンA(cyclosporine A)、ベラパミル(verapamil)のPDMS製デバイスに対する収着率は、それぞれ92.9%、71.7%、71.4%、99.6%であり、PDMS製デバイスに収着しやすいことが確認されました(図2)。
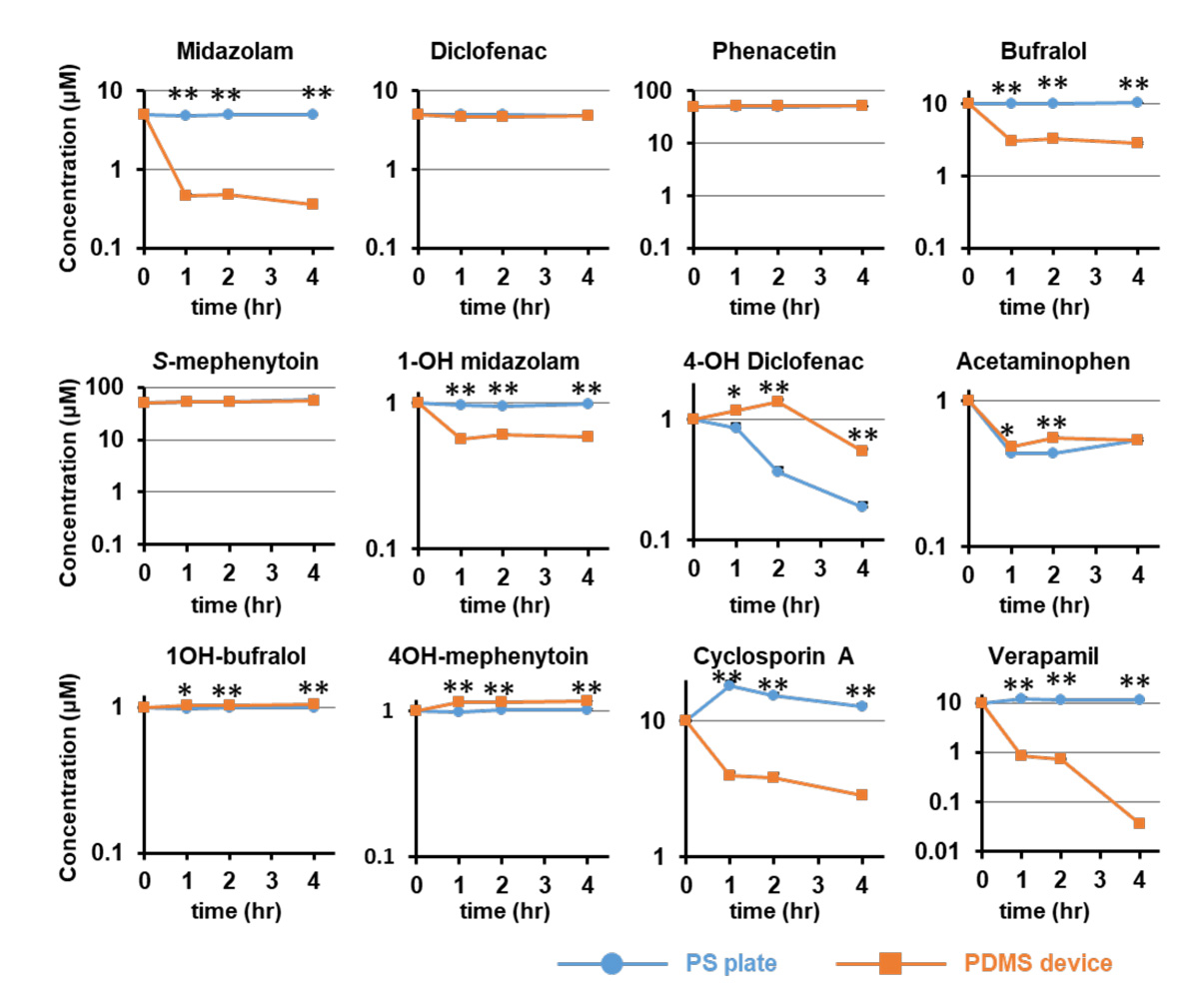
(図2) 各低分子化合物を含む培地をPDMS製デバイスまたはPS製プレートに添加し、1、2、4時間後に上清を回収し、培地中の化合物濃度を測定した。
3) PDMS製マイクロ流体デバイスにおける低分子化合物の収着率は、化合物のS+logD値と高い相関関係にある
PDMS製デバイスに収着されやすい低分子化合物を事前に予測する指標を探すため、低分子化合物の収着率と化合物の物理化学的特性との相関を求めました(図3)。6種類の物理化学的特性のうちS+logD値が、低分子化合物の収着率と最も高い相関を示しました(R2=0.76)。この結果から、低分子化合物のS+logD値を調べることで、その低分子化合物がPDMS製デバイスに収着されやすいかどうかを事前に予測できることが示唆されました。
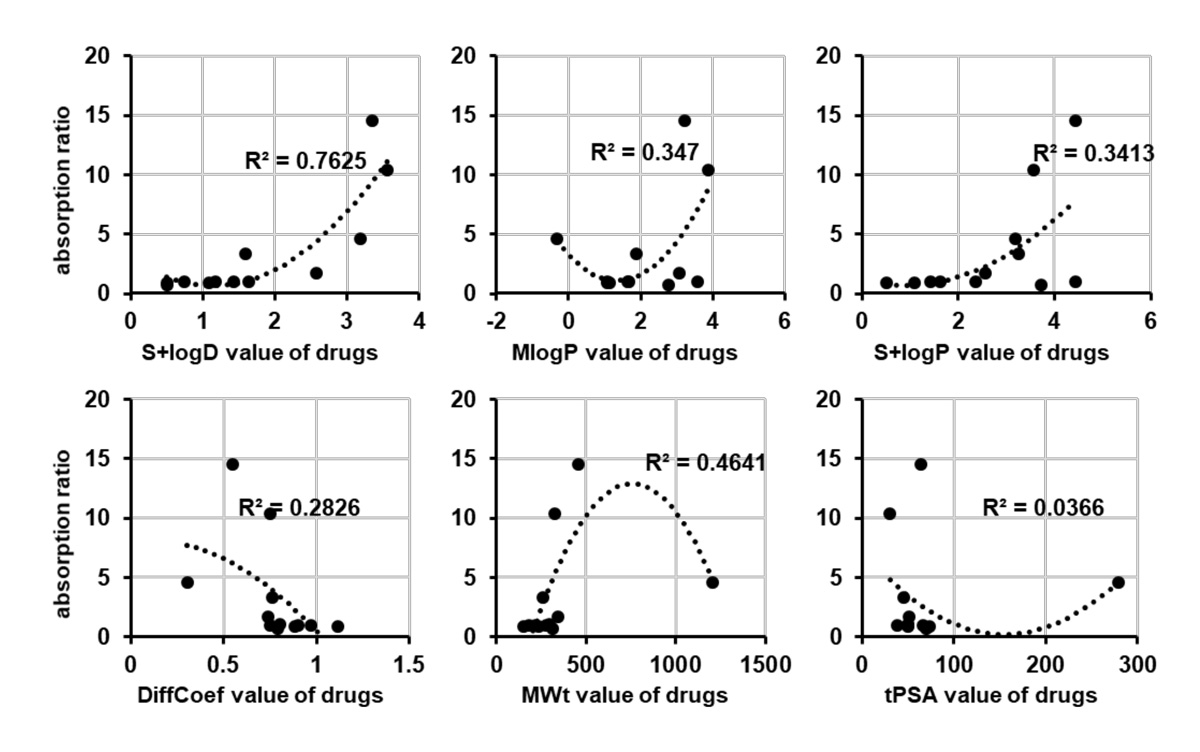
(図3)PS製プレートと比較した際のPDMS製デバイスへの収着率を算出し、低分子化合物の物理化学的特性(分配係数(MLogP、S+LogP、S+logD)、拡散係数注9)(DiffCoef)、分子量(MWt)、トポロジカル極性表面積注10)(tPSA))との相関係数を算出した。
4) PDMS製デバイスで培養したヒト肝細胞における薬物代謝酵素活性の評価
PDMS製デバイスで培養したヒト肝細胞において、低分子化合物を用いた薬物代謝酵素活性の評価が実施可能か検討しました。ここでは、薬物代謝酵素であるCYP注11)3A4の基質であるミダゾラムあるいはCYP2D6の基質であるブフラロールを作用し、代謝物の生成量を測定しました。図2の検討結果より、ミダゾラムおよびブフラロールはPDMS製デバイスに収着しやすい低分子化合物であることが分かっています。そのため、PDMS製デバイスで培養した肝細胞では、1-水酸化ミダゾラム(1'-hydroxymidazolam;CYP3A4によるミダゾラム代謝物)および1-水酸化ブフラロール(1'-hydroxybufralol;CYP2D6によるブフラロール代謝物)生成量は、PS製プレートで培養した肝細胞と比較して有意に少ないことが分かりました。しかし、代謝物生成量を培地中の基質濃度で除した値は、PDMS製デバイスおよびPS製プレートの間で同程度でした(図4)。この結果から、PDMS製デバイスで培養した肝細胞において、低分子化合物を用いた薬物代謝酵素活性の評価を行う場合は、低分子化合物の収着率を加味して解析を行う必要があると考察されます。
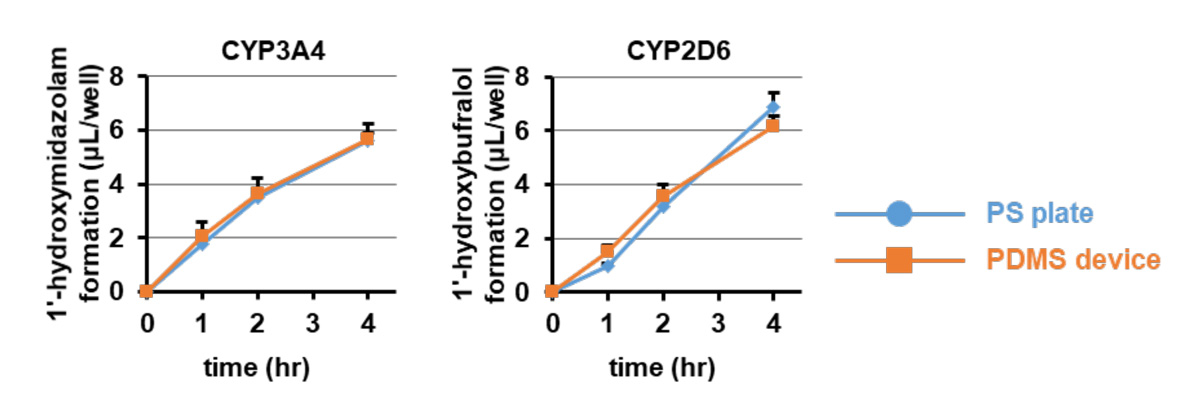
(図4)PDMS製デバイスおよびPS製プレートで培養した肝細胞にCYP3A4の基質であるミダゾラムまたはCYP2D6の基質であるブフラロールを作用し、1、2、4時間後に上清を回収し、各代謝物(1-水酸化ミダゾラムおよび1-水酸化ブフラロール)の生成量を高速液体クロマトグラフ質量分析計(HPLC-MS/MS)により測定した。
5) PDMS製デバイスで培養したヒト肝細胞における組換えタンパク質に対する細胞応答能の評価
最後に、PDMS製デバイスおよびPS製プレートで培養した肝細胞における組換えタンパク質注12)に対する細胞応答を比較しました。本研究では組換えタンパク質として、肝線維化注13)を促進する増殖因子であるtransforming growth factor-β1(TGF-β1)注14)を使用しました。PDMS製デバイスおよびPS製プレートにおいて、TGF-β1を添加し、上清中の残存量をELISA注15)により測定したところ、PDMS製デバイスの方が高値を示したことから、PDMS製デバイスにTGF-β1は吸着されにくいことが分かりました(図5A)。また、どちらの器材で培養したヒト肝細胞においても、肝線維化マーカーであるACTA2、COL1A1、TIMP1の遺伝子発現量は上昇しました(図5B)。以上の結果から、PDMS製デバイスで培養したヒト肝細胞は、PS製プレートで培養した肝細胞と同様に、TGF-β1に対する細胞応答を評価可能であることを確認しました。
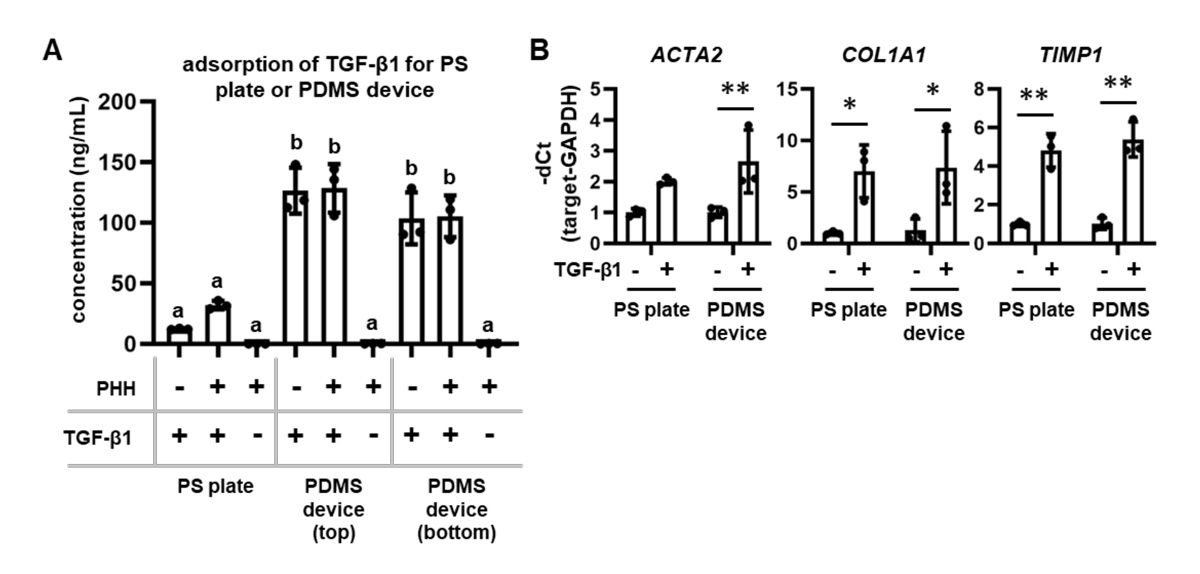
PDMS製デバイスおよびPS製プレートで培養したヒト肝細胞にTGF-β1を添加し、
(図5A)上清中TGF-β1濃度をELISAにより測定した。
(図5B)線維化マーカーであるACTA2、COL1A1、TIMP1の遺伝子発現量を測定した。
本研究では、PDMS製デバイスに対する低分子化合物の収着率が、低分子化合物のS+logD値と相関することを見出しました。さらに、PDMS製デバイスで培養したヒト肝細胞は、PS製プレートで培養したヒト肝細胞と同等の肝機能を有しており、低分子化合物の吸着率を加味することで正確な薬物応答試験を実施できることを確認しました。本研究成果は、PDMS製デバイスによる肝臓チップを利用した創薬研究に貢献することが期待されます。
- 論文名
Usability of polydimethylsiloxane-based microfluidic devices in pharmaceutical research using human hepatocytes - ジャーナル名
ACS Biomaterials Science & Engineering - 著者
Sayaka Deguchi1,2*, Masahiro Tsuda3, Kaori Kosugi1,4, Ayaka Sakamoto1, Natsumi Mimura1,
Ryosuke Negoro5, Emi Sano1, Takuro Nobe1,4, Kazuya Maeda6, Hiroyuki Kusuhara6,
Hiroyuki Mizuguchi2, Fumiyoshi Yamashita3, Yu-suke Torisawa4**, Kazuo Takayama1**
*:筆頭著者
**:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 大阪大学大学院薬学研究科
- 京都大学大学院薬学研究科
- 京都大学大学院工学研究科
- 立命館大学薬学部
- 東京大学大学院薬学系研究科
本研究は、下記機関より資金的支援を受けて実施されました。
- 京都大学iPS細胞研究基金
-
国立研究開発法人日本医療研究開発機構(AMED)
再生医療・遺伝子治療の産業化に向けた基盤技術開発事業
再生医療技術を応用した創薬支援基盤技術の開発
注1) ポリジメチルシロキサン
マイクロ流体デバイス作製に汎用されているシリコーンの一種。PDMSと呼ばれる。
注2) マイクロ流体デバイス
自在に幅と深さを設計した微小流路を持つ細胞培養用デバイス。
注3) S+logD値
水/オクタノール分配係数(化合物の疎水性を表す指標)の一種。分配係数の中でも、溶媒のpHに依存する化合物の解離性を考慮した値。
注4) ポリスチレン
プラスチック樹脂。スチロール樹脂とも呼ばれる。細胞培養のためのディッシュやマルチウェルプレートの素材として広く使用されている。
注5) シリコーンエラストマー
シリコーンゴムの一種。シリコーンゴムは熱硬化性樹脂であり、架橋反応を促進する化合物を加えて加熱することでエラストマーになる。
注6) ポリエチレンテレフタレート(PET)
ポリエステルの一種。薬物透過試験などで使用される多孔質膜の素材として汎用されている。
注7) 薬物代謝酵素
薬物などの異物の代謝(分解・排出しやすくするなど)を行う酵素。
注8) トランスポーター
薬物やその代謝物等の輸送に関与するタンパク質。
注9) 拡散係数
媒質中での粒子の拡散の速さを表す比例定数。
注10) トポロジカル極性表面積
分子表面のうち極性を帯びている部分の面積で、医薬品化学において薬物の細胞膜透過性の評価等に使用される指標。
注11) CYP
シトクロムP450(Cytochrome P450)。肝臓において高発現する薬物代謝酵素の一種。
注12) 組換えタンパク質
アミノ酸配列が分かっているタンパク質を、遺伝子組換え技術により大腸菌や動物細胞などの宿主細胞に発現させて、精製したもの。
注13) 肝線維化
継続的な損傷により肝臓に過剰な細胞外基質(細胞外に分泌される成分)などがみられる状態。重症化すると肝硬変に至ることもある。
注14) TGF-β1
トランスフォーミング増殖因子-β1(transforming growth factor-β1)。肝線維化の原因因子の一つだと言われている。
注15) ELISA
抗体あるいは抗原の濃度を検出・定量する際に用いられる方法。






















