
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2021年8月31日
ヒトのiPS細胞から腱の細胞を作製する 〜アキレス腱断裂のラットに移植し、機能回復を確認〜
ポイント
- ヒトiPS細胞から中胚葉1)の発生を模倣することで腱細胞を分化誘導し、アキレス腱断裂したラットに移植した。
- 運動学的/生体力学的/組織学的な評価によって機能回復を確認し、さらに、回復メカニズムも調べた。
- 本手法は、ヒトiPS細胞由来腱細胞を用いた再生医療や、腱細胞に関連する遺伝子疾患の研究で活用されることが期待できる。
骨と筋肉をつないでいる腱は、血流が乏しいため、自己修復が非常に起こりにくい組織です。よって、アキレス腱断裂などの大きなケガの場合、患者さんの体の別の組織を用いた腱の再建手術が行われることがあります。しかし、手術後の再負傷率は比較的高く、また健常部位の採取により筋力低下が生じ、長いリハビリの期間が必要となることがほとんどです。
中島大輝研究員(現ハーバード大学医学部 兼ブリガムアンドウィメンズ病院 兼日本学術振興会海外特別研究員、元CiRA臨床応用研究部門)と池谷真准教授(CiRA同部門)らの研究グループは、京都大学大学院医学研究科、東京慈恵会医科大学、京都大学iPS細胞研究財団との共同研究で、腱のケガにおける新たな治療法の1つとして、iPS細胞を用いた細胞治療の開発を行いました。中胚葉の発生期におけるシグナル環境2)を再現することで、ヒトiPS細胞から腱細胞を分化誘導し、アキレス腱を断裂したラットに移植しました。移植した腱細胞は生着し、さらにタンパク質を分泌して回復能力を高めること(パラクライン効果)によって、負傷した腱が早期に回復していることが、運動学的/生体力学的/組織学的に確かめられました。今回、ヒトのiPS細胞から腱細胞を誘導し、細胞治療へ繋がる治療法が開発されるのは初めてです。この研究成果は2021年8月18日午後6時(日本時間)に英国科学誌「Nature Communications」でオンライン公開されました。
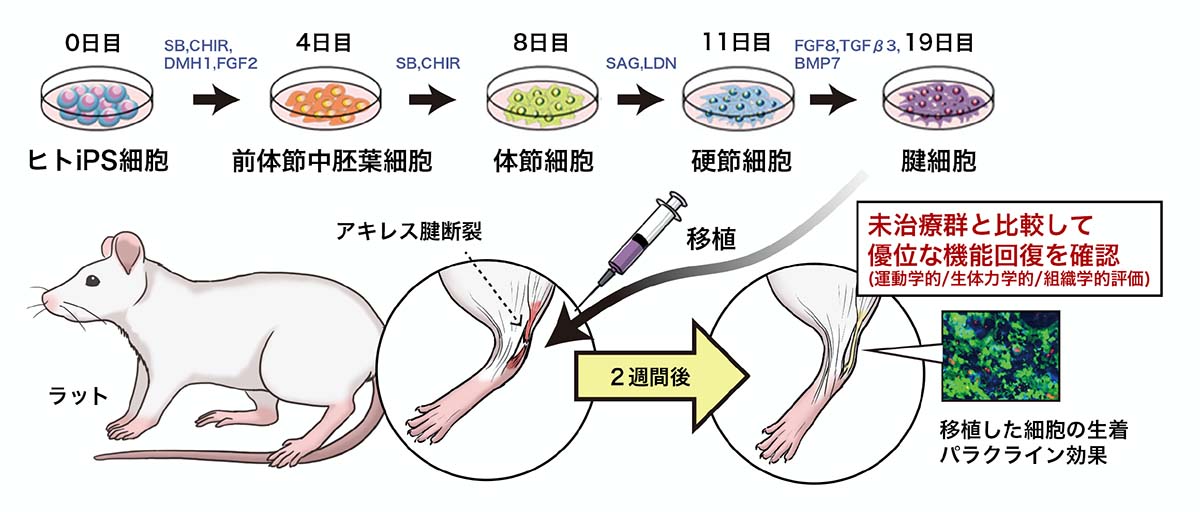
論文概要図
腱は、筋肉が伸び縮みする力を骨に伝える非常に重要な組織です。よって、腱の負傷は、人生の質(Quality of Life)に大きな影響を及ぼすため、早期の回復が求められます。重症の場合、従来の治療法で一般的なのは患者さん自身の別の組織を用いた腱の再建手術ですが、手術では患者さんに大きな負担がかかるため合併症のリスクが高く、手術後の再負傷率は比較的高いです。また、患者さんの体の別の組織を採取して腱を再建するため筋力低下が生じ、長いリハビリの期間が必要となります。
これまで、コラーゲン、カーボンあるいはポリエステルから作った人工の腱が開発されてきましたが、これらの腱には力学的強度や生体への親和性といった課題が存在します。
以上の課題を解決する新たな治療法として、腱細胞/皮膚線維芽細胞3)/間葉系幹細胞4)を移植する細胞治療が考えられます。怪我した腱の再生には腱細胞を補充することが最もシンプルですが、腱細胞は増殖する能力が低いため、移植に必要な量の腱細胞を集めるのは困難です。また、生体外で腱細胞を増やすことは細胞の機能低下を引き起こす可能性があります。一方、皮膚線維芽細胞や間葉系幹細胞を移植する場合、それらが腱以外の組織になる可能性があり、異所性組織形成5)のリスクがあります。よって、細胞治療のこれらの課題を解決する新たな手法が待ち望まれていました。
本研究グループは、そこで、ヒトのiPS細胞から作製した腱細胞を使った治療法を開発しました。iPS細胞を用いることにより、大量の腱細胞を作製することが可能となり、腱細胞に分化後の細胞を移植することで異所性組織形成のリスクを低くすることが期待できます。これまで、マウスのiPS細胞や間葉系幹細胞から腱細胞は作製されていましたが、ヒトのiPS細胞から腱細胞を誘導し、細胞治療へ繋がる研究が開発されるのは初めてです。
1) ヒトiPS細胞からゼノフリー条件6)で腱細胞を作製した。
ヒトの腱細胞は、発生を辿ると中胚葉が出発点です。研究グループはこれまで、体外でヒトiPS細胞から前体節中胚葉細胞7)、体節細胞8)を誘導し、さらにそこから硬節細胞9)や腱・靭帯細胞を分化誘導させるモデルの開発に成功しています(CiRAニュース:2018年8年24日「ヒト体節発生モデル化と進行性骨化性線維異形成症の病態解析」)。前回開発した分化誘導法では細胞を培養する過程で動物由来の成分を使用していましたが、今回の研究では、将来的にヒトの細胞治療への応用を目指すため、動物由来の成分を使用しない条件(ゼノフリー条件)下での分化誘導法の改良に成功しました。
新たに改良した分化誘導法を用いて、19日でヒトiPS細胞から腱細胞を作製し(図1左)、免疫染色を行うと、腱細胞に特有な転写因子(SCX、MKX、COL1A1、COL1A2)が発現していることが確認できました(図1右)。
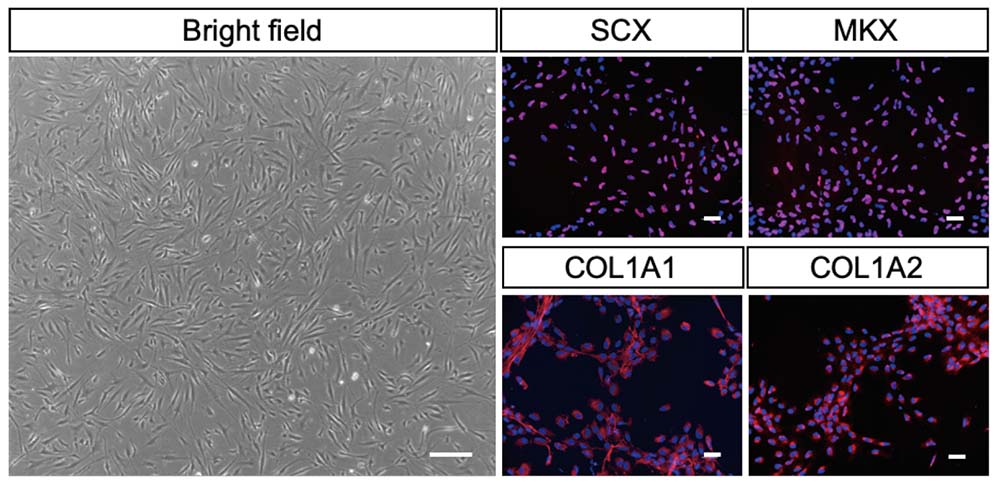
図1:ヒトiPS細胞から作製した腱細胞
腱細胞の顕微鏡写真(左)と腱細胞に特有な転写因子の免疫染色を行った写真(右)
スケールバーは50μmを示す。
2) アキレス腱断裂したラットに腱細胞を移植し、運動学的/生体力学的/組織学的な評価によって機能回復を確認した。
次に、作製した腱細胞が治療に有効か調べるため、アキレス腱断裂したラットを用いた動物実験を行いました。注射器を用いて300万個の腱細胞をラットの患部へ移植し、4週間の経過を観察しました。
経過観察においては①移植後のラットの歩行における足跡の分布、かかとの高さ、足首の角度を測定する運動学的評価、②再生されたアキレス腱の破断に要する最大荷重を測定する生体力学的評価、そして③再生されたアキレス腱の組織を細胞レベルで観察する組織学的評価を行いました。
① 運動学的評価
一般に健康なラットは、かかとを地面に付けずに歩行しますが、アキレス腱断裂したラットは、運動機能の低下のため負傷後3週間程度までかかとを地面に付けて歩行します。今回の経過観察では、移植後1週間はかかとを地面に付けて歩行していたラットが、2週間後にはかかとを付けずに歩行していることが足跡の解析でわかりました。かかとの骨の位置にマーカーを付けて歩行時の地面からの高さ(かかとの高さ)を測定すると、移植後2週間のラットのかかとの高さは未治療のラットのかかとの高さより有意に高く、健康なラットのかかとの高さと同程度になっていることがわかりました(図2左)。
また、膝関節と脚の小指にもマーカーを付けて測定した足首の角度においても、移植後2週間および4週間のラットは、健康なラットの足首の角度と同程度まで回復したことがわかりました(図2右)。
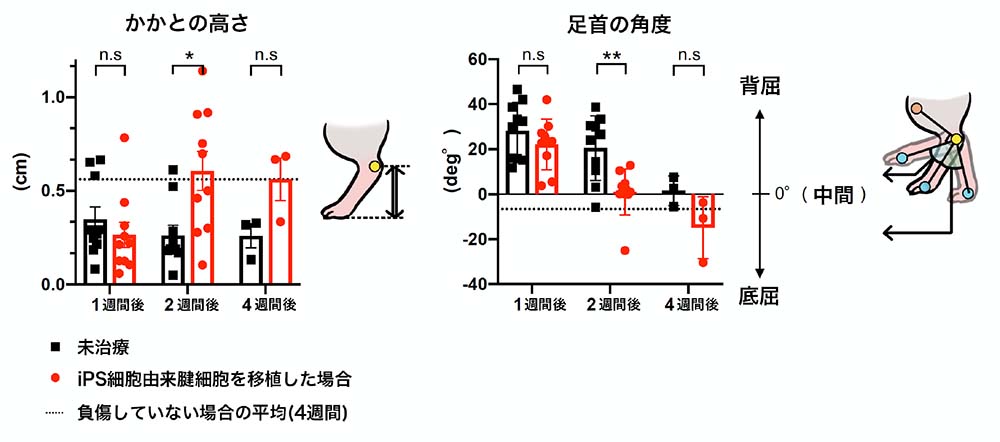
図2:移植後のラットの運動学的評価
トレッドミルを歩行させた移植後1週間、2週間、4週間のラットのかかとの高さ(左)と足首の角度(右)。移植後1週間と2週間:n=10、移植後4週間:n=3。点線は負傷していないラットの平均値を示す。
*:P < 0.05, **:P < 0.01, n.s:not significant(有意差なし)。
② 生体力学的評価
移植後2週間と4週間のラットのアキレス腱を採取し、再生されたアキレス腱の破断に要する最大荷重を測定する実験を行ったところ、移植後2週間のアキレス腱は同期間未治療のものと比べ、最大荷重が高いことがわかりました(図3左)。さらに再生した腱の物性を比べるため、荷重変位曲線10)を作成すると、未治療のアキレス腱はなだらかな曲線を示しているのに対し(粘弾性がある状態)、移植したアキレス腱は健康なアキレス腱と似たような挙動(降伏がある状態)を示していることがわかりました(図3右)。以上より、移植したアキレス腱の方が、未治療のものに比べて耐久性と物性が回復していることがわかりました。
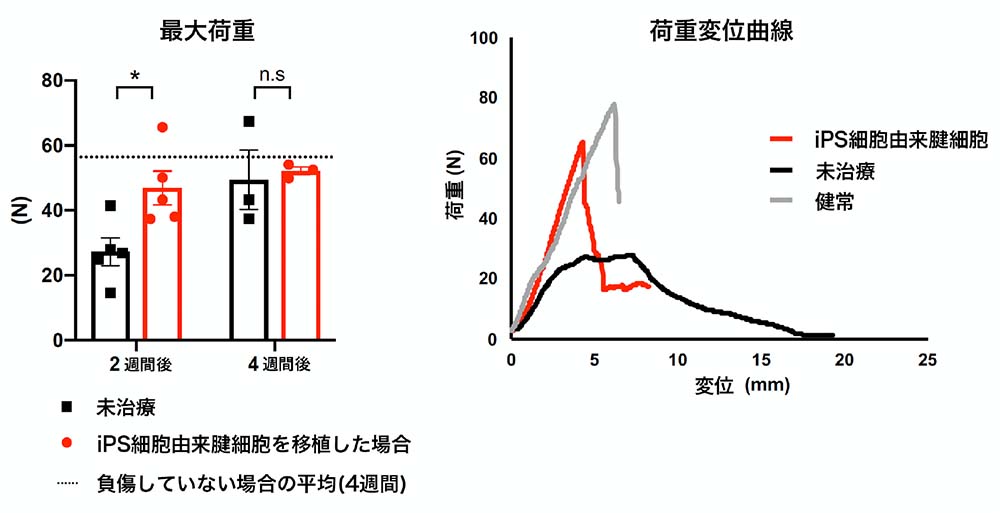
図3:再生されたアキレス腱の破断に要した最大荷重を測定する生体力学的評価
移植後2週間と4週間のラットの最大荷重(N)の測定値(左)と、移植後2週間の代表サンプルの荷重変位曲線(右)。移植後2週間:n=5、移植後4週間:n=3。
*:P < 0.05, n.s:not significant(有意差なし)。
③ 組織学的評価
移植した腱細胞の生着や組織の状態を調べるため、組織学的評価を行いました。移植するヒトiPS細胞由来腱細胞に蛍光色素を付加し、移植後24時間、2週間、4週間の蛍光分布を調べると、移植した腱細胞は移植部位にとどまっていることがわかりました(図4)。さらに、I型コラーゲン11)、Ⅲ型コラーゲン、ヒト特有のビメンチン12)に反応する免疫染色を移植後2週間のアキレス腱に施したところ、ヒト特有ビメンチン陽性の移植細胞が、コラーゲンを発現していることが確認できました(図5右)。これは、移植した腱細胞が生着し、ラットのアキレス腱の一部としてある程度機能していることを示唆します。
一方、未治療のラットのアキレス腱ではコラーゲンの生成が見られない未再生部分が多く確認できました(図5左)。
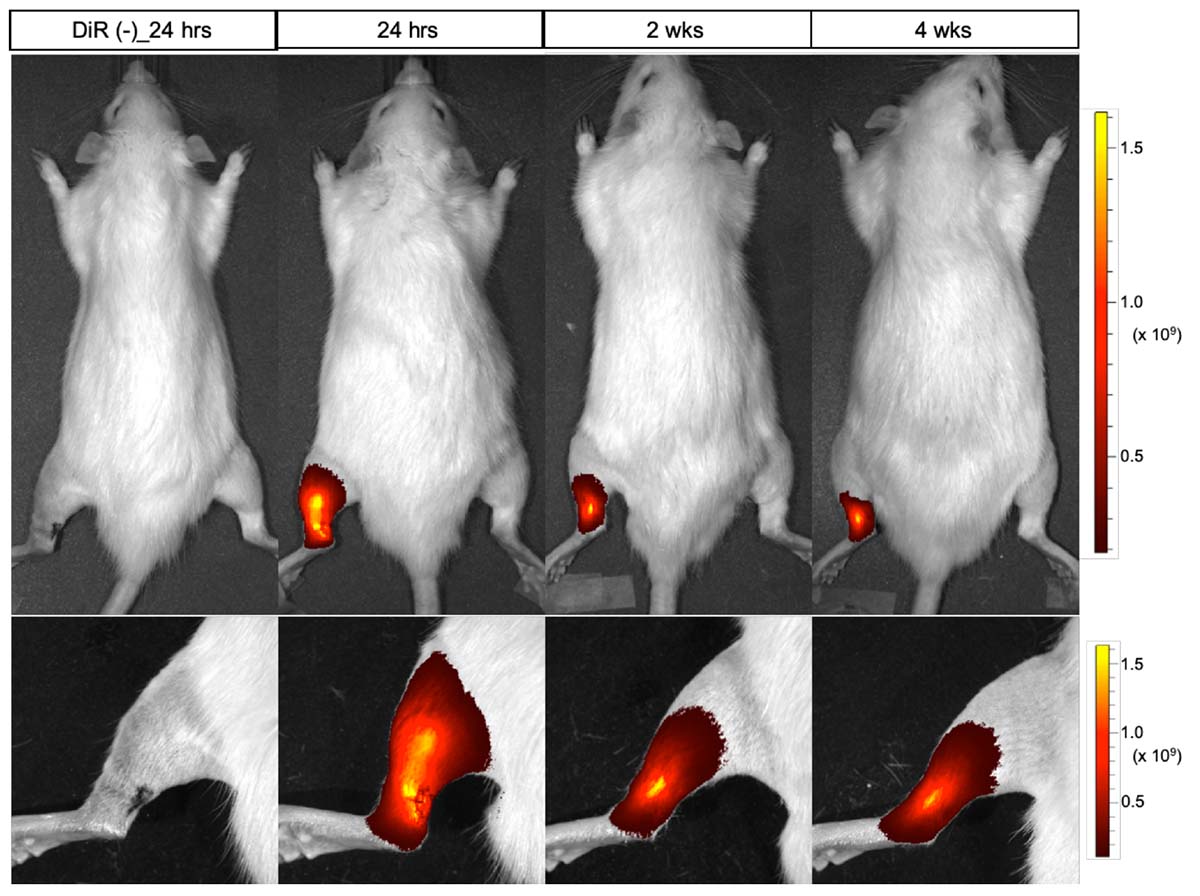
図4:移植したiPS細胞由来腱細胞の分布
移植するiPS細胞由来腱細胞に蛍光色素を付加し、移植後24時間、2週間、4週間の蛍光分布を調べると、移植した腱細胞は移植部位にとどまって生着していることがわかる。
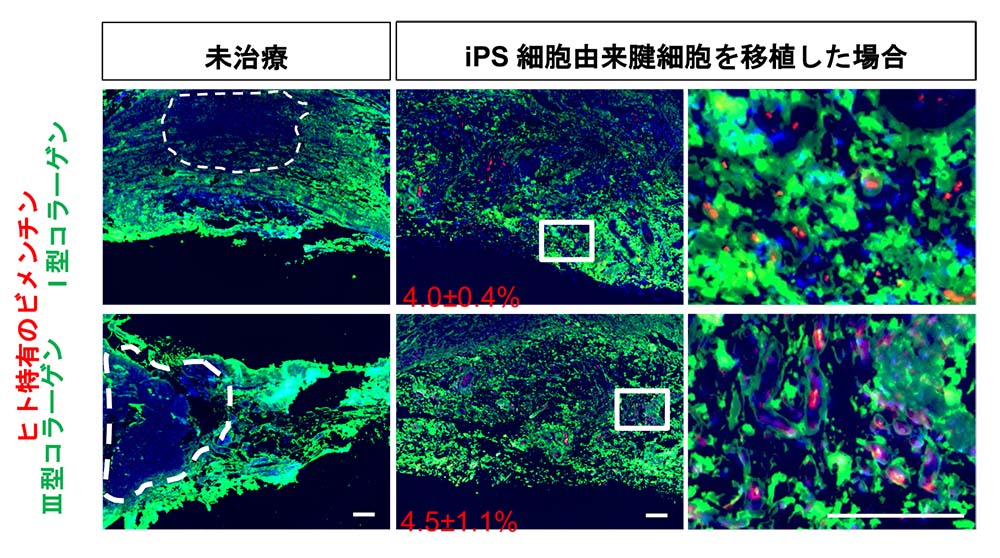
図5:移植したアキレス腱組織の組織学的評価
移植後2週間のラットのアキレス腱(右)と未治療のラットのアキレス腱(左)の代表サンプルの免疫染色画像。 I型コラーゲンとⅢ型コラーゲンは緑色に染色され、ヒト特有のビメンチンは赤色に染色される。左の点線内はコラーゲン未再生部分を示す。スケールバーは100μmを示す。
3) 移植したヒトiPS細胞由来腱細胞が成長因子を分泌し(パラクライン効果)、運動機能回復を促進していることがわかった。
最後に、アキレス腱の機能回復に関与したヒトiPS細胞由来腱細胞から分泌されるタンパク質の存在を調べました。ヒトiPS細胞由来腱細胞の培養上清濃縮液でヒトプライマリー腱細胞(初代培養した腱細胞)を培養したところ、濃縮前の液より増殖が良くなることがわかりました。これにより、ヒトiPS細胞由来腱細胞培養中の培地上清には腱細胞の増殖に寄与するような何らかの成長因子が含まれていることがわかりました。
さらに、プロテオーム解析13)により、その成長因子の候補を探索したところ、IGF1とTGFβ3シグナルの関連タンパク質がヒトiPS細胞由来腱細胞から多く分泌されていることがわかりました。そこで、IGF1タンパク質またはTGFβ3タンパク質をアキレス腱断裂したラットに投与し2週間後に評価すると、生体力学的には効果がそれほど見られなかったものの、運動学的には未治療のラットに比べ、IGF1とTGFβ3を投与したラットそれぞれにおいて優位に機能が回復していることがわかりました。つまり、IGF1とTGFβ3が移植先のラットの腱細胞の成長を促し、運動学的な機能回復に寄与していることが示唆されます。
一般的に、細胞移植による治療効果のメカニズムは2通り考えられます。1つは、移植した細胞が傷ついた細胞と入れ替わり組織の一部となることです(これは、移植後の組織学的評価(図5)によって確認されました)。もう1つは移植した細胞によるパラクライン効果によって患部の細胞の自己回復能力が高まることです。今回、IGF1とTGFβ3によるパラクライン効果が確認されました。よって、ヒトiPS細胞由来腱細胞の細胞治療では両方のメカニズムが関わっていることを示唆する結果が得られました。
今回初めて、ヒトiPS細胞由来腱細胞の移植がアキレス腱を断裂したラットの治療に有効であることを示し、さらに回復のメカニズムを示唆する結果も得ました。本研究の手法は、非ヒト動物由来成分を含まない、シンプルで安定した分化誘導法であり、今後のヒトiPS細胞由来腱細胞を用いた臨床研究で活用されることが期待できます。さらに、体外において腱細胞までの発生を再現しているので、患者さんのiPS細胞を用いた腱細胞に関連する遺伝子疾患の研究においても有用です。
今回、ヒトiPS細胞由来腱細胞を用いることによって、移植後2週間において、未治療のラットと比較して優位に歩行機能の機能回復が認められました。これは長期の治療によるリスクが高いアスリートや高齢者にとって、メリットの多い治療法となる可能性があります。
さらに、無限に増殖可能なヒトiPS細胞を用いることで、移植する腱細胞を大量に作製することができるため、これまで腱細胞/皮膚線維芽細胞/間葉系幹細胞を用いた細胞治療の課題であった、移植する腱細胞の不足を解決できます。また、ヒトiPS細胞由来腱細胞は一旦iPS細胞にすることで細胞の若返りが起こるため、老化によって弱った腱にはより有効だと考えられます。今後は、さらに長期にわたる経過観察や、アキレス腱以外の腱障害への治療適用、そして老年ラットを用いた移植治療効果の検証を進めていきたいと考えています。
- 論文名
Grafting of iPS cell-derived tenocytes promotes motor function recovery after Achilles tendon rupture - ジャーナル名
Nature Communications - 著者
Taiki Nakajima1,*, Akihiro Nakahata2, Naoki Yamada1,3, Keiko Yoshizawa1, Tomoaki M Kato4,
Mio Iwasaki1, Chengzhu Zhao1, Hiroshi Kuroki2, Makoto Ikeya1,*
*:責任共著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 東京慈恵会医科大学
- 京都大学iPS細胞研究財団
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)科研費
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
(iPS細胞研究中核拠点、技術開発個別課題) - iPS細胞研究基金
- 藤原記念財団
注1) 中胚葉
受精後の胚からできる細胞の塊は、内胚葉、中胚葉、外胚葉に分けられる。中胚葉は骨、心筋、赤血球などに分化する。
注2) シグナル環境
細胞外に分泌される成長因子などによって構成され、細胞の分化や移動などを制御する環境のこと。
注3) 皮膚線維芽細胞
皮膚組織を構成する最も主要な細胞。
注4) 間葉系幹細胞(Mesenchymal Stem Cells; MSCs)
成体の骨髄や脂肪組織に存在し、骨細胞、軟骨細胞、脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。
注5) 異所性組織形成
本来の場所とは異なる所(異所)に組織が形成されてしまうこと。
注6) ゼノフリー条件
ヒトiPS細胞の樹立および維持培養には、ウシ血清などの異種動物に由来する成分や、マウス胎仔由来のフィーダー細胞が通常用いられる。今回のゼノフリー条件では、フィーダー細胞の代わりにリコンビナントラミニン511 E8断片を用い、異種動物由来成分の除去に成功しており、ヒトへの細胞移植に適したグレードのiPS細胞を作ることが可能となっている。
注7) 前体節中胚葉細胞(Presomitic mesoderm)
中胚葉細胞の一種。体節細胞8)の前段階の細胞。
注8) 体節細胞(Somite)
中胚葉細胞の一種。発生期に一時的に形成される構造体。骨格筋細胞、骨軟骨細胞、真皮細胞、腱靭帯細胞の発生学上の起源細胞である。体節は、皮節、筋節、硬節の主に3つの構造体に分化する。
注9) 硬節細胞(Sclerotome)
体節から分化する構造体のうちの1つ。腹方内部から生じる。その後、椎骨や肋骨などの中軸骨格や、腱や靭帯の細胞へと分化する。
注10) 荷重変位曲線
材料の強度などを定量的に測定する際に用いられるグラフ曲線。横軸に材料の変位、縦軸に荷重をとる。傾きが急勾配で、ある変位点で急激に降下するとき、剛性(変形のしにくさ)が高く耐久力があると判断される。一方、曲線がなだらかで荷重の増減が少ない場合、靭性(粘り強い)のある材料と判断される。
注11) コラーゲン
靭帯を構成するタンパク質のひとつ。ポリペプチド鎖の組み合わせにより、脊椎動物では数十種類の型が存在する。I型コラーゲンは脊椎動物で最も多く存在する繊維性のコラーゲンであり、弾力性を持たせるのに働く。I型コラーゲンの存在する組織にはⅢ型コラーゲンも存在する場合が多く、同じく繊維性のコラーゲンである。
注12) ビメンチン
骨、軟骨、皮膚、筋肉、靭帯、腱などの多様な結合組織の中に存在する細胞骨格タンパク質。細胞の形態を保持し、細胞内外の運動を伝える繊維状の構造。太さなどにより種類が分類され、ビメンチンは約10nmの太さを持つ。
注13) プロテオーム解析
ある生物が持つゲノム情報によって作られる全てのタンパク質のセット、またはある細胞がある瞬間に発現している全てのタンパク質のセットをプロテオームと呼ぶ。個々のタンパク質の構造や機能、細胞や組織内で発現しているタンパク質の網羅的な解析によるタンパク質間相互作用の理解を目指した研究をプロテオーム解析と呼ぶ。複雑なタンパク質間相互作用の理解は、より効率的な診断手法や治療法の開発が可能になると考えられている。






















