
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2022年3月2日
アルツハイマー病病因分子の産生量に影響を与える土壌微生物叢由来代謝物の同定 〜土壌微生物叢 vs アミロイドβから新世代の微生物創薬へ〜
ポイント
- iPS細胞を使ったスクリーニング系を用いることで、神経細胞のアミロイドβ産生動態を変化させる土壌微生物叢注1)由来の代謝物注2)を同定し、土壌微生物とアルツハイマー病の関係を明らかにしました。
- この手法を用いて、微生物叢が神経細胞の病態に与える影響を直接的に調べることで、微生物叢の疾患への影響評価や、新たな微生物創薬研究につながると考えられます。
- 微生物とアミロイドβの関係を明らかにすることは、人類の防御システムと病因分子としてのアミロイドβの役割のトレードオフの結果としてのアルツハイマー病、という理解につながる可能性があります。
近藤孝之特定拠点講師(京都大学iPS細胞研究所(CiRA)増殖分化機構研究部門特定拠点講師、理化学研究所(理研)バイオリソース研究センター(BRC)iPS創薬基盤開発チーム客員研究員、理研革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム客員研究員)、井上治久教授(CiRA同部門教授、理研BRC同チームチームリーダー、理研AIP同チーム客員主管研究員)、日本マイクロバイオファーマ株式会社らの研究チームは、日本の土壌に由来する微生物叢から抽出・精製した代謝物ライブラリと、アルツハイマー病(AD)患者さん由来のiPS細胞から調製した大脳皮質神経細胞を用いて、土壌微生物叢の代謝物がADの中心的な病因分子の一つであるアミロイドβ(Aβ)注3)の産生動態に与える影響を評価し、Aβ産生動態を変化させる代謝物として、ミロテキウム属注4)の真菌が産生するベルカリンAと、ストレプトマイセス属注5)の細菌が産生するMer-A2026Aを同定しました。このように、微生物由来の代謝物ライブラリとiPS細胞技術を組み合わせることで、従来直接的に評価することが困難だった微生物叢と脳神経系の関連性を検証し、将来的なADのリスク因子探索や新たな微生物創薬につなげることができます。
本研究成果は2022年3月2日午後7時(日本時間)に英国科学雑誌『Scientific Reports』でオンライン公開されました。
1928年、アレクサンダーフレミング博士は、ペニシリウムという菌の培養から世界初の抗生物質であるペニシリンを発見しました。その後、糸状菌や放線菌などの微生物から、多くの抗生物質、高コレステロール血症薬、免疫抑制剤、抗腫瘍剤などが分離されました。このように微生物由来の代謝物を含む天然物には、生理学的活性を有するものがあることが知られています。本研究チームは、微生物資源、特に土壌微生物に由来する二次代謝物の化合物ライブラリの収集と整備を続けてきました。
2000年代に入り、ヒトを取り巻く微生物叢と多様な疾患との関係が脚光を浴びるようになりました。そして、患者さんの腸や口腔などの微生物叢が、ADを含む脳神経系疾患の発症や進行に影響を与えることも疫学研究から明らかになりつつあります。中でも、アルツハイマー病病因分子Aβが体内で微生物の感染に対する自然免疫としての役割を果たす可能性も報告されてきました。しかし、どのような微生物叢が、どのようにして脳神経疾患の発症に関わるのかを解明することは困難でした。特に土壌由来の微生物の多くは単離および維持培養が難しく、解析が困難でした。
本研究では、土壌微生物叢の代謝物とADの関係を直接的に調べるため、放線菌類を中心とする細菌65種と、多様な真菌33種から抽出した98の二次代謝物からなるライブラリを使用しました(図1)。これらの代謝物を、家族歴のない孤発性AD患者さんから樹立したiPS細胞を用いて調整した大脳皮質神経細胞に添加し、Aβの産生動態を定量的に評価しました。
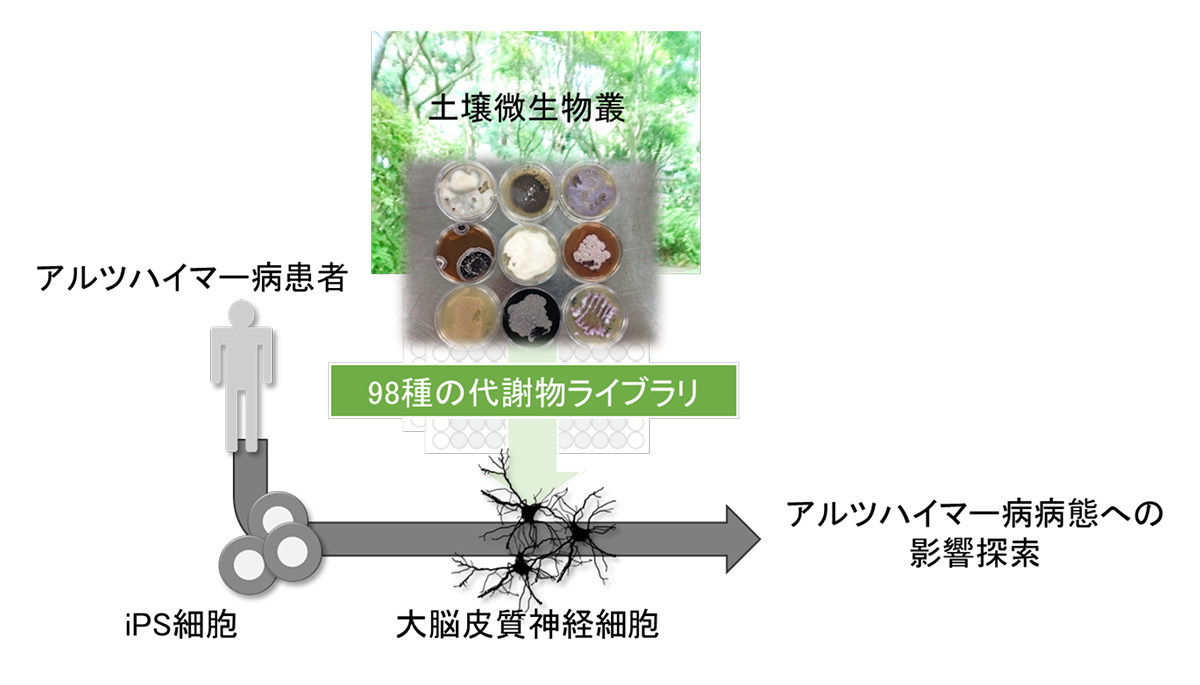
図1:研究概要図
土壌微生物叢由来の代謝物をAD患者さん由来のiPS細胞から分化した大脳皮質神経細胞に添加し、
どの代謝物がAD病態に影響を与えるのか調べた。
それぞれの代謝物を1μMの濃度で添加し、培地中のAβ40とAβ42の濃度およびAβ42/40比を測定しました。そして、ネガティブコントロールとして化合物の溶媒であるジメチルスルホキシド(DMSO)のみを添加した条件に対するAβ産生の比率を計算し、代謝物の影響を調べました(図2左上、右上、左下)。また、添加された代謝物による細胞損傷は培養皿の中の神経細胞数を減らしてしまいAβの定量結果に影響するため、神経細胞損傷の程度も同時に評価しました(図2右下)。スクリーニング内のアッセイの安定性指標としてネガティブコントロールの変動係数(CV%)を計算すると、Aβ40とAβ42の濃度、Aβ42/40比、および細胞損傷アッセイの平均CV%は、それぞれ2.1%、3.7%、1.7%、および3.4%であり、安定したスクリーニング系が構築されていることを示しました。そして、Aβの高毒性型であるAβ42の産生量に影響する代謝物として、Aβ42濃度が減少した、あるいはAβ42/40比が増加または減少した9つの代謝物を特定しました(図2右上、左下の黄色の点)。
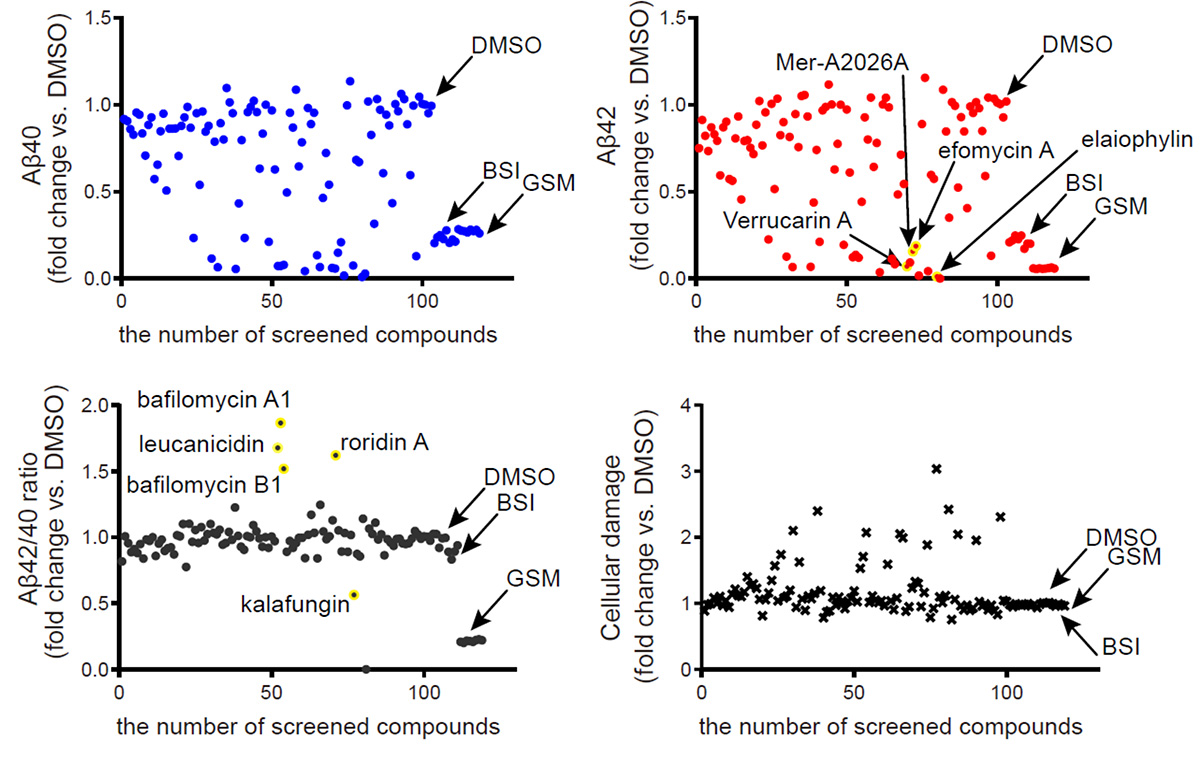
図2:孤発性AD患者さんのiPS細胞由来大脳皮質神経細胞を用いた一次スクリーニング
孤発性ADのiPS細胞由来大脳皮質神経細胞に、土壌微生物叢由来の代謝物98種類1μMを添加した際の、Aβ40濃度(左上)、Aβ42濃度(右上)、Aβ42/40比(左下)、細胞損傷(左下)のネガティブコントロールに対する比率。ヒットした化合物は、化合物名の付いた黄色で強調表示。DMSO:ジメチルスルホキシド(ネガティブコントロール)、BSI:β-セクレターゼ阻害剤(Aβ40濃度のポジティブコントロール)、GSM:γ-セクレターゼモジュレーター(Aβ42濃度およびAβ42/40比のポジティブコントロール)。
さらに、濃度依存性的にAβ産生動態が変化する代謝物として、ベルカリンAとMer-A2026Aを見いだしました(図3、4)。ベルカリンAは、土壌のミロテキウム属が生産することが報告されている化合物です。高濃度のベルカリンA(0.2-5μM)は弱い神経細胞損傷を示したものの、低濃度(0.32-8nM)では神経細胞に損傷を与えることなく、Aβ40およびAβ42の産生量を大きく減少させました(図3)。以上のことから、ベルカリンAはAβ産生量を減少させる治療薬の元になる可能性があります。
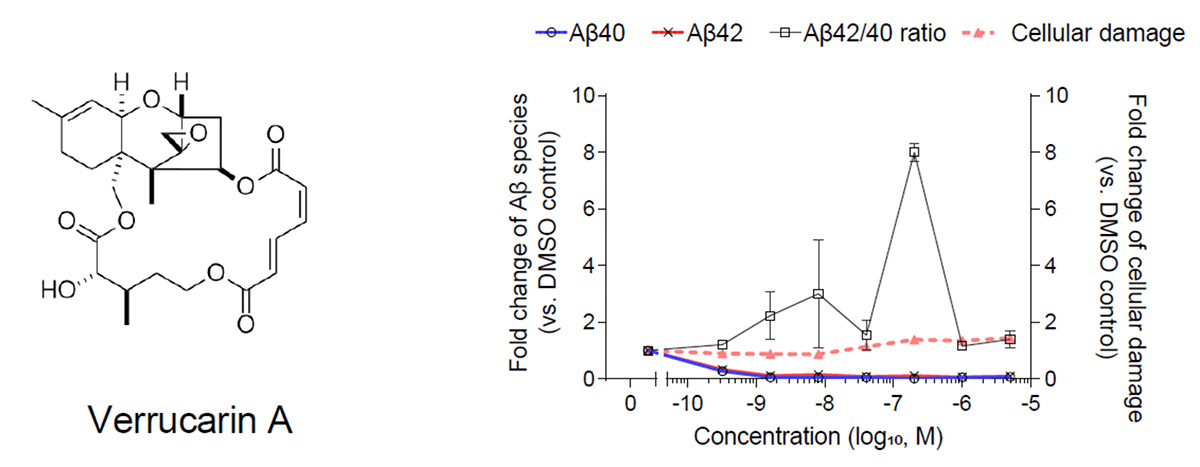
図3:ベルカリンAの構造式とAβ産生量に対する影響
左のグラフは、ベルカリンAを添加した際の神経細胞のAβ40とAβ42の産生量および神経細胞毒性をネガティブコントロールに対する比率で示す。
Mer-A2026Aは、添加した濃度にかかわらず神経細胞への損傷が小さく、低濃度(1.6-200nM)では保護的AβであるAβ40産生量の減少とAβ42/40比の増加を示しました(図4)。一方、高濃度のMer-A2026A
(0.04-5μM)は、Aβ40とAβ42両方の産生量をネガティブコントロールの半分程度まで減少させました。
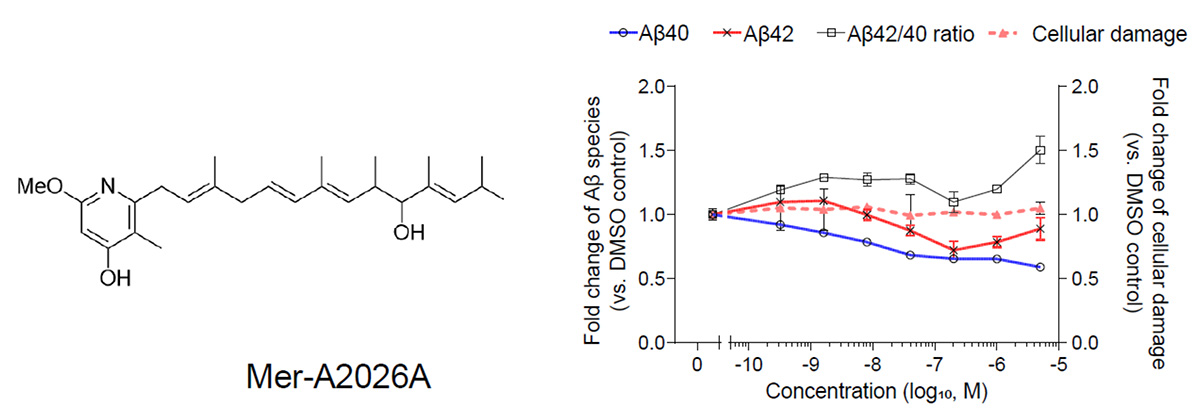
図4:Mer-A2026Aの構造式とAβ産生量に対する影響
左のグラフは、Mer-A2026Aを添加した際の神経細胞のAβ40とAβ42の産生量および神経細胞毒性をネガティブコントロールに対する比率で示す。
Mer-A2026Aは、土壌由来のストレプトマイセス属細菌ストレプトマイセス・パクトムの培養液から分離され、血管拡張作用がある化合物として報告されていました。本研究の結果からは、Mer-A2026Aには、Aβ42./40比を上げADの危険因子となる場合、あるいはAβ産生を抑制してADに対して保護的にはたらく場合という二面的な性質があることが示されました。神経細胞が土壌微生物叢の産生する物質を感知し、感染に対する免疫としてAβを産生する可能性や、土壌微生物叢がAβ産生を抑制するための物質を産生する可能性などを考えると、本研究成果は、今後、微生物叢とAD発症の関係を解明する糸口になるかもしれません。さらに、ヒトが感染症に対抗するために備わっているAβが、寿命延長によりADの原因になったとも考えられ、ADは人類の防御システムと病因分子としてのAβの役割の進化上のトレードオフの結果と考えられるかもしれません。
本研究では、土壌微生物叢由来の代謝物ライブラリとiPS細胞技術を組み合わせることで、土壌微生物叢の代謝物がADの病態に与える影響を直接的に評価することに成功しました。今後、この解析技術を用いることで、微生物叢とADの関連性の理解が進み、微生物叢を標的とした発症予防やリスク管理、新たな微生物創薬への道筋が開かれることが期待できます。
- 論文名
Metabolites of soil microorganisms modulate amyloid β production in Alzheimer's neurons - ジャーナル名
Scientific Reports - 著者
Takayuki Kondo1,2,3, Tsuyoshi Yamamoto4, Kaoru Okayama4, Hideki Narumi4, Haruhisa Inoue1,2,3,5* - 著者の所属機関
- 京都大学iPS細胞研究所
- 理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チーム
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 日本マイクロバイオファーマ株式会社(MBJ)
- 京都大学医学部附属病院 先端医療研究開発機構(iACT)
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 日本学術振興会科学研究費補助金(17K16121, 20K16599)
- 日本マイクロバイオファーマ株式会社(MBJ)
注1)微生物叢
特定の環境に生息する微生物の集まり。腸管内や口腔内などの場所ごとに特徴的なグループを形成し、この微生物叢の特性や変化が疾患に影響することが知られている。
注2)代謝物
生物の生育の過程で生産される化合物。微生物は種類や環境により様々な代謝物を生産することが知られている。代謝物の多くは生理活性を示し、代謝物の変化が宿主の病態に影響を与えることも示唆されている。今回の検討では、98種類の代謝物から構成される代謝物ライブラリを用いた。
注3)アミロイドβ(Aβ)
家族性アルツハイマー病の原因遺伝子であるAPPがコードするアミロイドβ前駆体を、β-セクレターゼやγ-セクレターゼなどの酵素が切断することで産生される。細胞外に分泌されるAβにはAβ40とAβ42があり、Aβ40と比べてAβ42は凝集性が高いことから、より毒性の高い種類のAβとして知られている。
注4)ミロテキウム属(Myrothecium)
主に土壌中に棲息する真菌の一種。植物などに寄生する事が多い。
注5)ストレプトマイセス属(Streptomyces)
主に土壌中に生息し、代謝物が抗生物質など様々な医薬品として応用されている。






















