
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2022年9月6日
固形がんにも効果のあるヒト化CARの作製に成功
ポイント
- 脳腫瘍や骨肉腫など様々な悪性腫瘍に高発現しているPodoplanin(PDPN)をターゲットにしたヒト化CAR(NZ-27 CAR)を作製した。
- NZ-27 CARはヒト化する前の抗PDPN CAR(NZ-1 CAR)と比較してT細胞表面への発現量が向上した。
- 動物モデルを用いた実験でNZ-27 CARはNZ-1 CARに比較してPDPN発現腫瘍の有意な抑制効果を示した。
石川晃大 大学院生(増殖分化機構研究部門・現研究員)、早稲田真澄 研究員(同部門)および金子新 教授(同部門)らの研究グループは東北大学大学院医学系研究科分子薬理学分野(加藤幸成教授)との共同研究として、PDPNを高発現している悪性腫瘍(がん)を効果的に傷害するヒト化CARの作製に成功しました。
近年、キメラ抗原受容体(CAR)(注1を発現したT(CAR-T)細胞を用いた治療法により、血液がんに対して高い効果が得られ、注目されています。しかし、CAR-T細胞は固形がんに対しては治療効果が低く、有効性を高める研究が多く行われています。治療効果の改善のためにはCAR-T細胞の体内での長期生存能を向上させる必要があり、その解決方策の一つとしてCAR遺伝子配列のヒト化が挙げられます。
本研究では脳腫瘍などの固形がんに多く発現し、がん患者さんの予後不良と関連するPodoplanin(PDPN)(注2をターゲットにしたヒト化CAR(注3の作製を試みました。新しく作製されたヒト化CARであるNZ-27 CARはこれまでに作成されたPDPN特異的CARであるNZ-1 CARと比較してT細胞表面に有意に発現し、PDPN特異的なT細胞活性化シグナルの向上が観察されました。実際にNZ-27 CAR-T細胞はNZ-1 CAR-T細胞と比較してPDPN発現細胞に対する細胞傷害活性能、炎症性サイトカイン産生能、PDPN発現腫瘍に対する抗腫瘍効果が有意に向上しました。この知見はPDPN発現腫瘍に対する抗腫瘍効果を向上させたCAR-T治療の開発につながることが期待されます。
この研究成果は2022年7月5日付で「Genes to Cells」誌に掲載されました。
キメラ抗原受容体(CAR)は抗原を特異的に認識する抗体部分(scFv)と細胞内へシグナルを伝達する部分(CD3ζおよび共刺激分子)をもつ受容体であり、CD19抗原を特異的に認識するCARを発現したT細胞(CAR-T細胞)はCD19陽性急性Bリンパ腫に対して優れた治療効果を発揮しています。一方で、CAR-T細胞の患者さん体内での生存期間は短く、固形腫瘍においてはCAR-T細胞の治療効果が乏しいことが課題として挙げられます。CAR-T細胞による高い治療効果を得るためには患者体内で長期生存を達成する必要があり、その解決方策の一つにCAR遺伝子に含まれるマウスやラット由来遺伝子配列をヒト化することが挙げられます。
Podoplanin(PDPN)はムチン型糖タンパク質の一種であり、脳腫瘍や骨肉腫など様々な悪性腫瘍に高発現していることから新しい治療標的として有望と考えられています。これまで、PDPNを特異的に認識するラットモノクローナル抗体であるNZ-1抗体からCARが作製されており、NZ-1 CARを発現したT細胞(NZ-1 CAR-T細胞)はマウスモデルにおいて治療効果があることが報告されています。そこで本研究では、治療効果の向上と将来の臨床応用を見据えて、NZ-1由来のPDPNを認識する領域(相補性決定領域: CDR)と乳がんの抗体医薬として使われているトラスツズマブ由来のフレームワーク領域(FR)から作製されたNZ-27 scFvを用い、NZ-27 CARを作製しました。NZ-27 CARを発現したT細胞(NZ-27 CAR-T 細胞)のマウスモデルにおける抗腫瘍効果をNZ-1 CAR-T細胞と比較することでNZ-27 CARの有用性について評価することにしました。
1) NZ-1 scFv、NZ-27 scFvはPDPNに対してのみ結合する
PDPN発現細胞株の選定を行うために抗PDPN抗体を用いてフローサイトメトリーで解析を行いました。その結果、チャイニーズハムスター卵巣細胞株のCHO-K1細胞にヒトPDPN(hPDPN)を安定発現させた CHO/hPDPN細胞、ヒト膠芽腫細胞株であるLN319細胞、ヒト骨肉腫由来骨芽細胞株であるMG63細胞においてPDPNの発現が観察されました。その後、それぞれの細胞株において、Fcタンパク質と融合して長寿命化したscFv(NZ-1 scFvFc、NZ-27 scFvFc)のPDPN発現細胞株への結合能を観察した結果、上述したすべてのPDPN発現細胞株においてその結合能が観察されました。
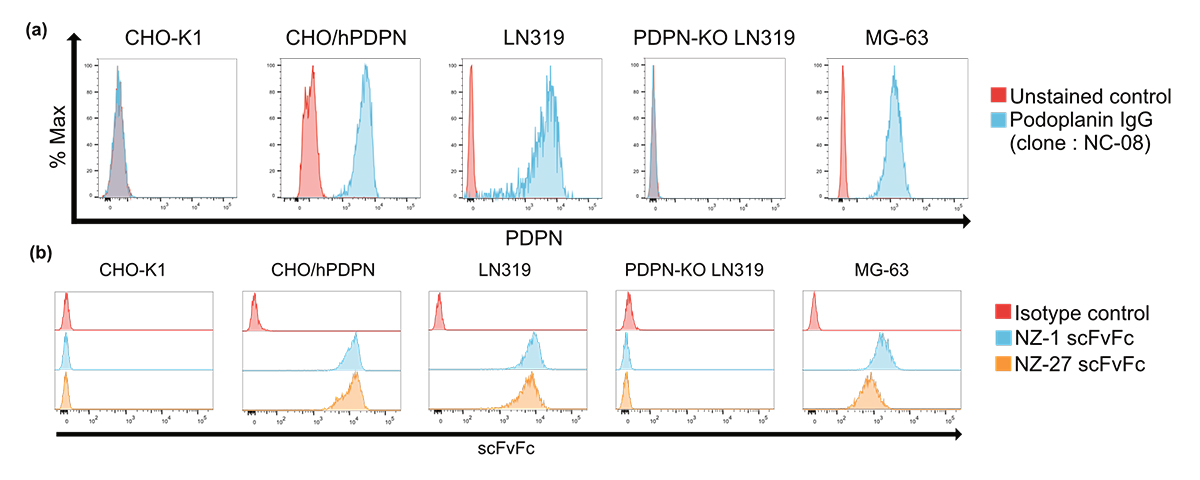
Fig.1 PDPN発現細胞株に対するNZ-1 scFvFc, NZ-27 scFvFcの結合能
NZ-1 scFvFc, NZ-27 scFvFcはPDPN発現細胞のみ結合する
2) NZ-1 CAR-T細胞、NZ-27 CAR-T細胞はPDPN発現細胞に対して特異的に機能する
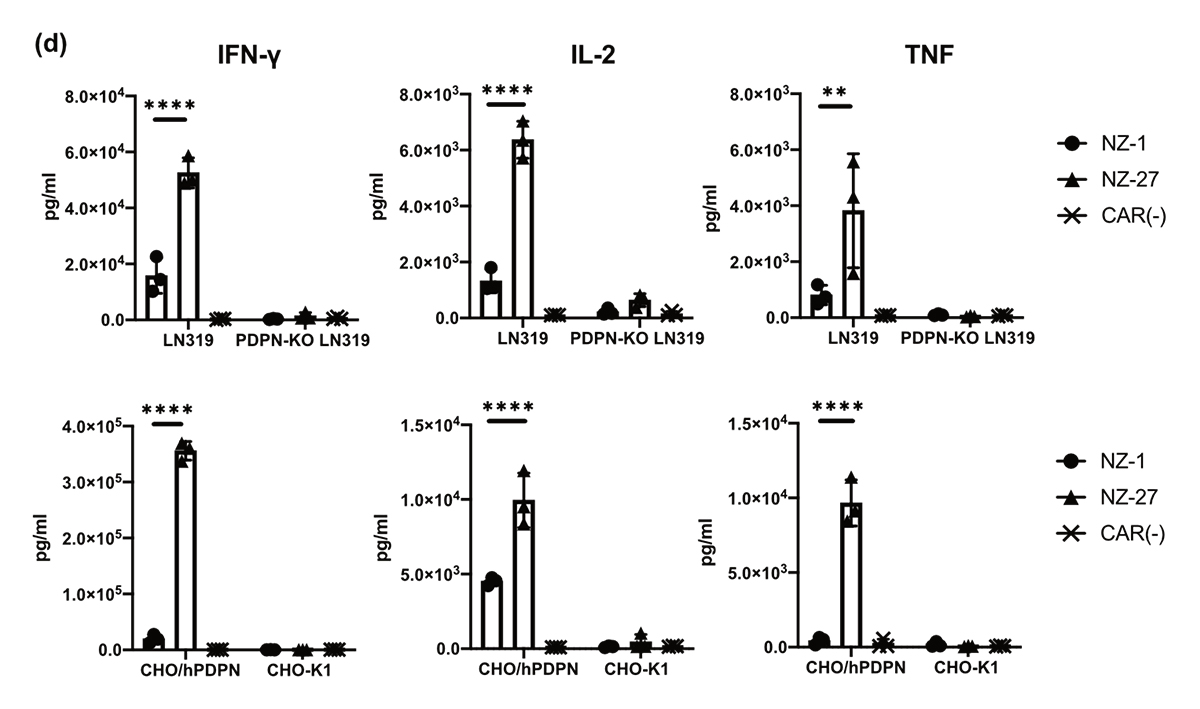
NZ-1 scFv、NZ-27 scFvを用いてNZ-1 CAR、NZ-27 CARを作製し、ヒト末梢血T細胞に遺伝子導入しました。遺伝子導入後、PDPN発現細胞に対する細胞傷害活性能と炎症性サイトカイン産生能を評価した結果、NZ-1 CAR-T細胞、NZ-27 CAR-T細胞はPDPN発現細胞(CHO/hPDPN、LN319、MG-63)に対して特異的な細胞傷害活性能と炎症性サイトカインであるIFN-γ、IL-2、TNFの産生が確認されました。
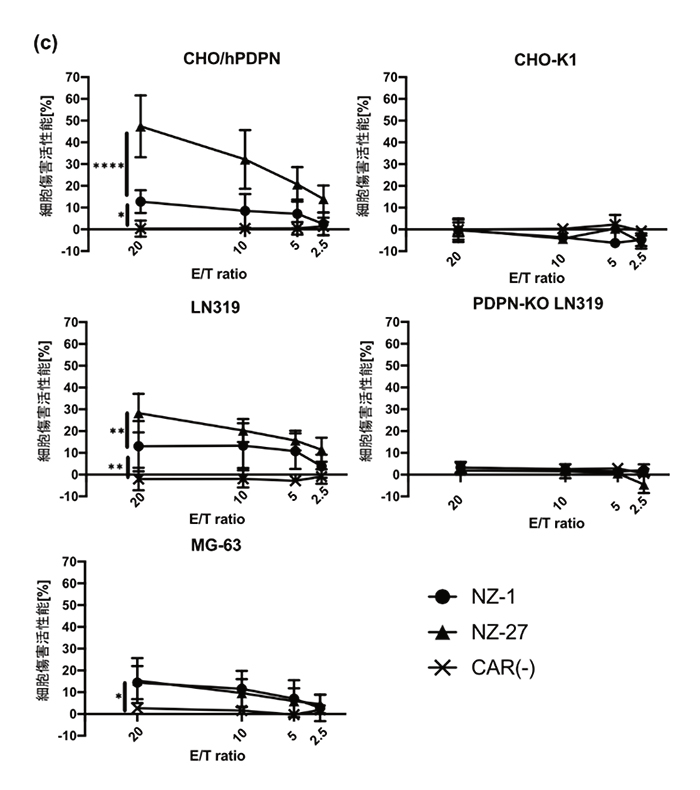
Fig.2 PDPN特異的な活性能評価
上図:PDPN特異的な細胞傷害活性能
(左側:PDPN発現細胞、右側:PDPN非発現細胞)
下図:PDPN特異的なサイトカイン産生能
3) NZ-27 CAR-T細胞はPDPN発現腫瘍の進行を抑え、腫瘍内に長く生存する
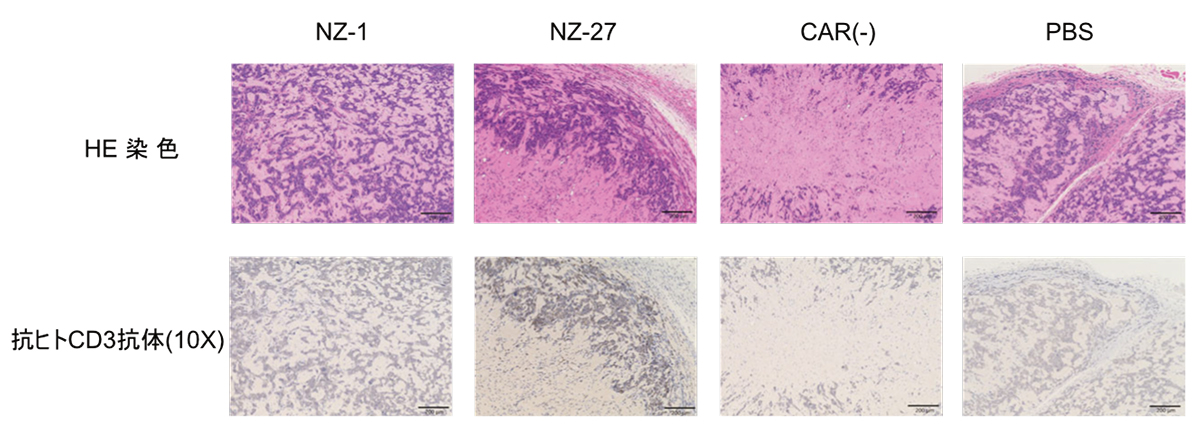
超免疫不全マウス(注4にPDPN発現細胞株であるLN319細胞を皮下接種した7日目にNZ-1 CAR-T細胞、NZ-27 CAR-T細胞を投与しました。その結果、NZ-27 CAR-T細胞投与群はNZ-1 CAR-T細胞投与群と比較して腫瘍の進行を抑えることが分かりました。さらに腫瘍内に浸潤したT細胞を免疫染色で確認したところ、NZ-27 CAR-T細胞を投与した腫瘍内にのみCD3陽性細胞(T細胞)が存在していることが分かりました。
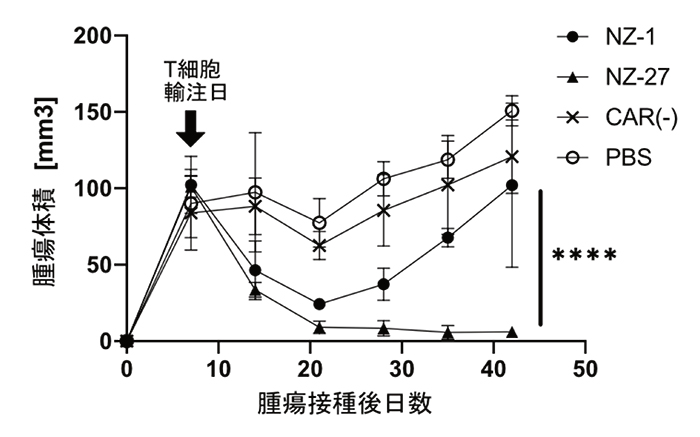
Fig.3 PDPN発現腫瘍への抗腫瘍効果
上図:PDPN発現腫瘍の腫瘍体積
下図:21日目の腫瘍内に浸潤したT細胞
(濃い茶色に染色された部分)
4) NZ-27 CAR-T細胞はNZ-1 CAR-T細胞と比較してT細胞表面に多く発現する
上述したNZ-27 CAR-T細胞の抗腫瘍効果向上の原因を探るためNZ-1 CAR遺伝子、NZ-27 CAR遺伝子にMyc-Tag(注5を挿入し、CAR遺伝子の細胞内の局在を解析しました。その結果、総タンパク質量には差がありませんが、NZ-27 CARはNZ-1 CARと比較して細胞膜に多く発現していることが分かりました。また、T細胞の活性化シグナルを評価したところ、NZ-27 CAR発現細胞では抗原依存的に強力な活性化シグナルの誘導が確認されました。これら結果から、NZ-27 CARは細胞表面に効率的に発現する事によりT細胞を強力に活性化して、高い抗腫瘍効果を誘導する事が示唆されました。
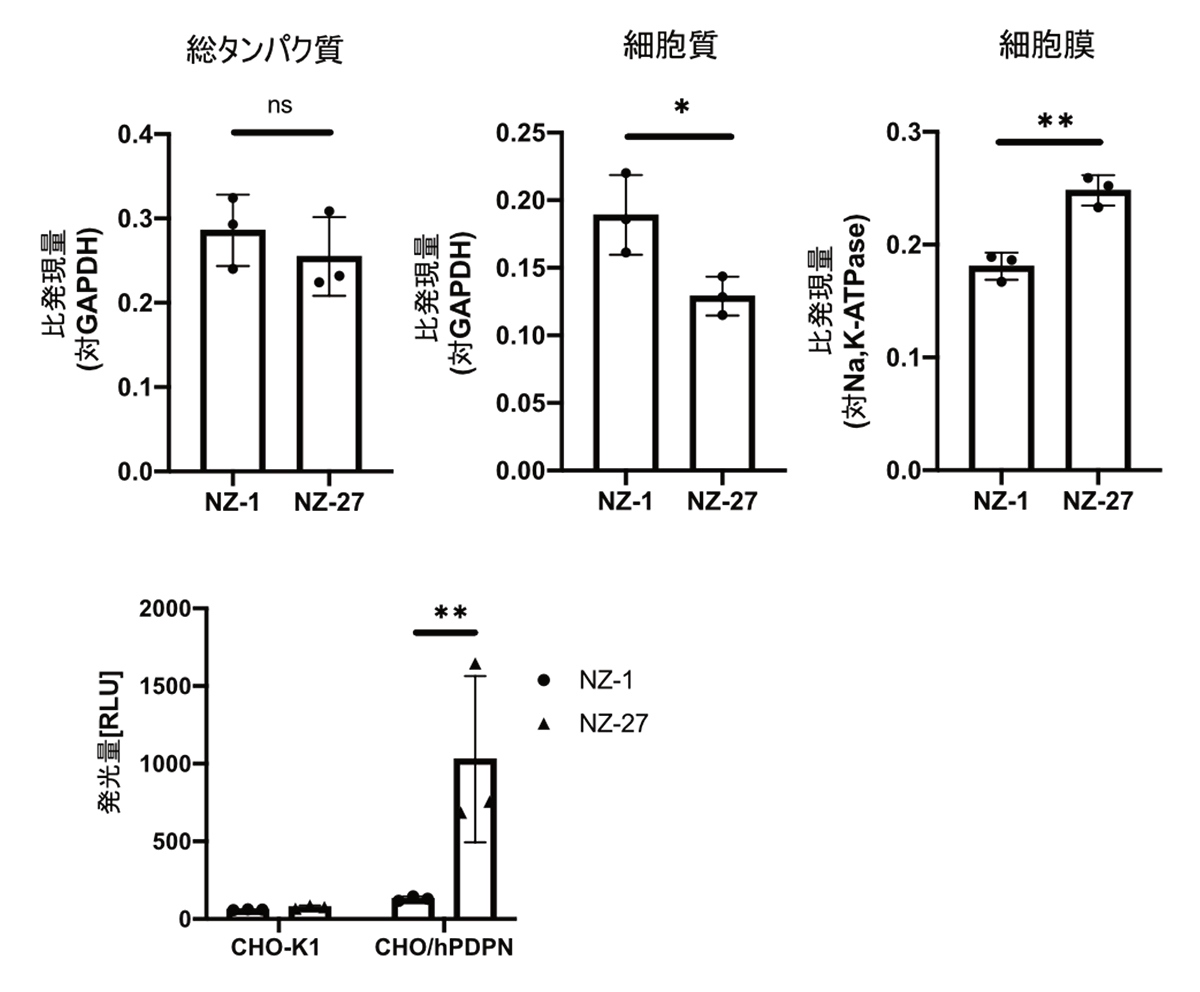
Fig.4 NZ-1 CAR、NZ-27 CARの細胞内の局在
上図:NZ-1, NZ-27 CARの細胞質、細胞膜への局在
下図:PDPN抗原依存的なルシフェラーゼ発光の確認
本研究ではNZ-1 CARおよびNZ-27 CARの総タンパク質量に有意な差は観察されなかったのに対し、T細胞膜上のCARの発現量に有意な差が生じる結果となりました。遺伝子が転写・翻訳された後、細胞内小器官で様々な翻訳後修飾が行われ、タンパク質の機能・局在・安定性が決定されることから、ヒト化による翻訳後修飾が細胞膜上での発現量の差をもたらしたのではないかと考察されます。この知見をより解析することによって新しいヒト化CAR創出が促進されること、iPS細胞から作製されたT細胞への応用、PDPN発現がん細胞に対する治療効果を向上させたNZ-27 CARを用いた臨床応用などに貢献することが期待されます。
- 論文名
Improved anti-solid tumor response by humanized anti-podoplanin chimeric antigen receptor transduced human cytotoxic T cells in animal model - ジャーナル名
Genes to Cells - 著者
Akihiro Ishikawa1*, Masazumi Waseda1*, Tomoko Ishii1, Kaneko K. Mika2, Yukinari Kato2,
Shin Kaneko1**
*筆頭著者
**責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 東北大学大学院医学系研究科
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人 日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
注1) キメラ抗原受容体(CAR)
抗体のターゲット認識部位を細胞外に、T細胞活性化タンパク質を細胞内に内包した人工タンパク質の総称。CD19タンパク質をターゲットとしたCARを発現したT細胞において完全寛解を達成した患者さんもいることから、免疫細胞療法において注目されている。今回はNZ-1、NZ-27抗体のターゲット認識部位からCARを作製した。
注2) ポドプラニン(Podoplanin, PDPN)
PDPNはムチン型糖蛋白質の一種であり、悪性脳腫瘍など様々な固形腫瘍に高発現することが知られている。また、がん細胞の浸潤・転移や悪性化との関連も報告されているため、治療標的として注目されている。
注3) ヒト化CAR
マウスなどの異種動物由来の抗体配列は、ヒトの体内で異物として認識され排除されることがある。これを回避するため、遺伝子工学的手法を用いて相補性決定領域と呼ばれる抗原結合部位以外をヒト由来の抗体配列に置き換えた抗体を"ヒト化"抗体と呼び、ヒト化CARの作製や抗体医薬の分野において良く用いられている。
注4) 超免疫不全マウス
遺伝子編集技術を用いて先天性突然変異、または、人工的に免疫応答が欠失したマウスの総称。マウスにとって異種の細胞であるヒトの細胞に対して免疫拒絶反応を比較的生じず生体内に生着するため、ヒト由来細胞の機能をマウスにて研究することを可能としている。
注5) Myc-Tag
c-Myc遺伝子に由来するポリペプチドタンパク質であり、組換えDNA技術を用いて目的のタンパク質に付加することができる。この方法でMyc-Tagを付与されたタンパク質は抗Myc-Tag抗体を用いて細胞内外の発現量を定量することが可能となる。






















