ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2023年1月17日
脊髄性筋萎縮症における骨格筋病変の発症メカニズムの一部を解明
ポイント
- 脊髄性筋萎縮症に関わるタンパク質SMN注1)の欠損しているiPS細胞では、ミトコンドリア注2)の機能低下と筋分化異常が見られた。
- SMN欠損骨格筋細胞では、ミトコンドリアの成熟に重要なマイクロRNA(miRNA)注3)であるmiR-1およびmiR-206の発現量が低下していることが明らかになった。
- miR-1およびmiR-206の転写開始点上流において、SMNが転写因子MYOD1と共に結合しており、それらの転写活性に対する制御への関与が示唆された。
- miR-1およびmiR-206の補充は、脊髄性筋萎縮症モデルマウス由来筋管細胞の疾患表現型を改善し、これらの因子が治療標的として有望であることを示した。
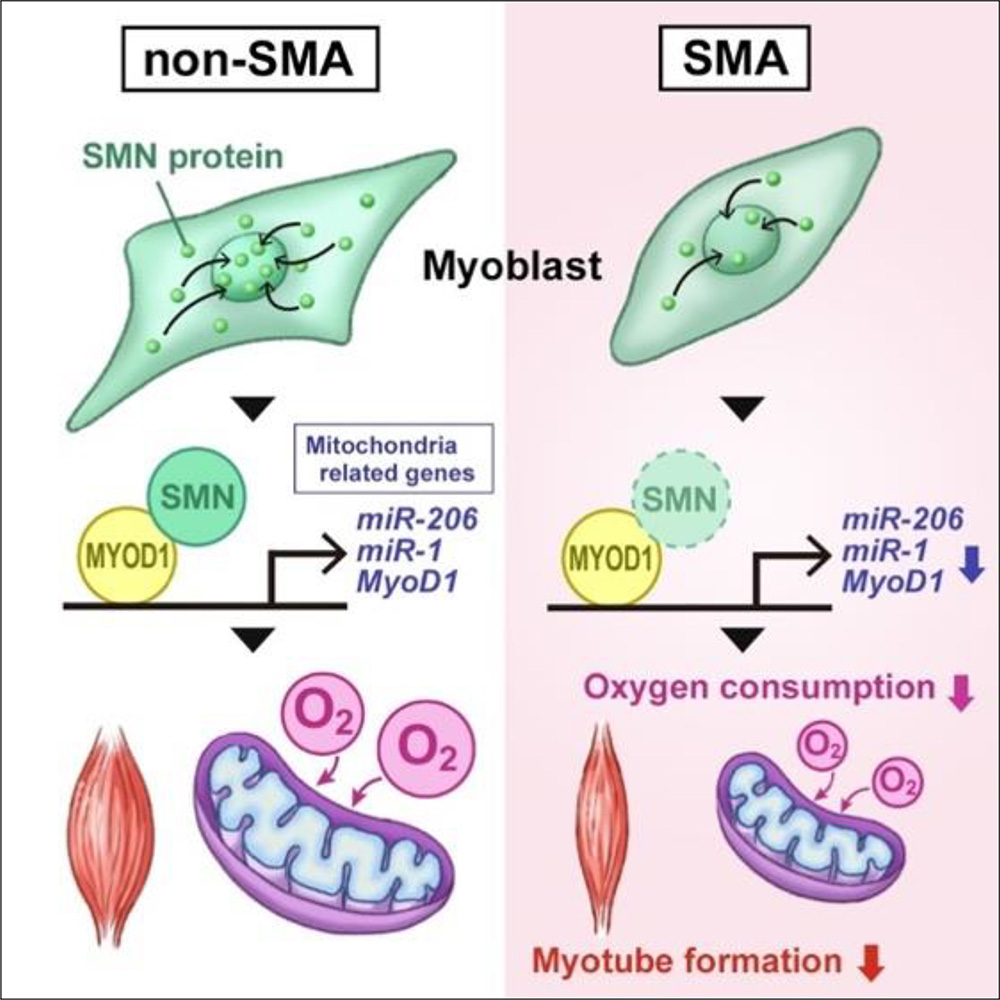
図1 SMNによるMYOD-miRNA経路を介した骨格筋分化過程におけるミトコンドリアの機能制御機構の概要
池中亮裕研究員(CiRA臨床応用研究部門)、齋藤潤教授(CiRA同部門)らの研究グループは、脊髄性筋萎縮症に関わるタンパク質SMNが骨格筋分化過程においてMYOD-miRNA経路を制御することにより、ミトコンドリアの機能的成熟を促進することを明らかにしました。
この研究成果は、2023年1月5日に国際科学誌「Life Science Alliance」に掲載されました。
脊髄性筋萎縮症(Spinal Muscular Atrophy : SMA)は、先天性の神経筋疾患であり、SMN(Survival Motor Neuron)をコードするSMN1遺伝子の機能喪失型変異によって発症します。SMAは重症度によってI型からIV型に分類されており、最重症型のI型では乳児期に呼吸不全によって死に至ることが知られています。現在は、ゾルゲンズマをはじめとした遺伝子標的治療薬によって、患者さんの予後が著明に改善されています。しかし最重症型のI型に対する効果は限定的であり、引き続き治療の改善が望まれています。
従来、SMAは運動神経疾患と考えられており、運動神経でSMNの機能が解析されてきました。一方で、近年、SMAにおいてミトコンドリアの機能異常を含む骨格筋固有の病変も報告されており、骨格筋がSMAの新たな治療標的として注目されています。しかし、SMAにおける骨格筋病変の発症機序は、明らかになっていません。
そこで、今回の研究では、SMA患者さんより樹立したiPS細胞およびマウス由来筋芽細胞を用いて、SMAにおける骨格筋病変の発症機序を調べました。
1)SMN欠損による骨格筋分化過程におけるmiR-1およびmiR-206の発現量の低下
まず、健常者由来iPS細胞(WT-iPS)にSMNを標的とするshRNA注4)を導入しSMNをノックダウンしたSMN欠損WT-iPS細胞を作製しました。また、SMA患者さん由来iPS細胞(SMA-iPS)にSMNを補充したSMN補充SMA-iPS細胞を作製しました。次に、これらの細胞に対して、骨格筋分化に重要な転写因子であるMYOD1を人工的に発現させることで、骨格筋細胞へ分化誘導しました。
その結果、SMN欠損WT-iPS細胞およびSMA-iPS細胞由来骨格筋細胞、つまり、SMNを欠損している2種の細胞において、分化開始の6日目にミトコンドリアの酸素消費量が低下することを確認しました(図2A)。さらに、SMNを持たない上記2種の細胞について、骨格筋分化の過程におけるミトコンドリアの機能制御に重要なMYOD1、miR-1およびmiR-206の発現量が低下していることがわかりました(図2B、2C)。
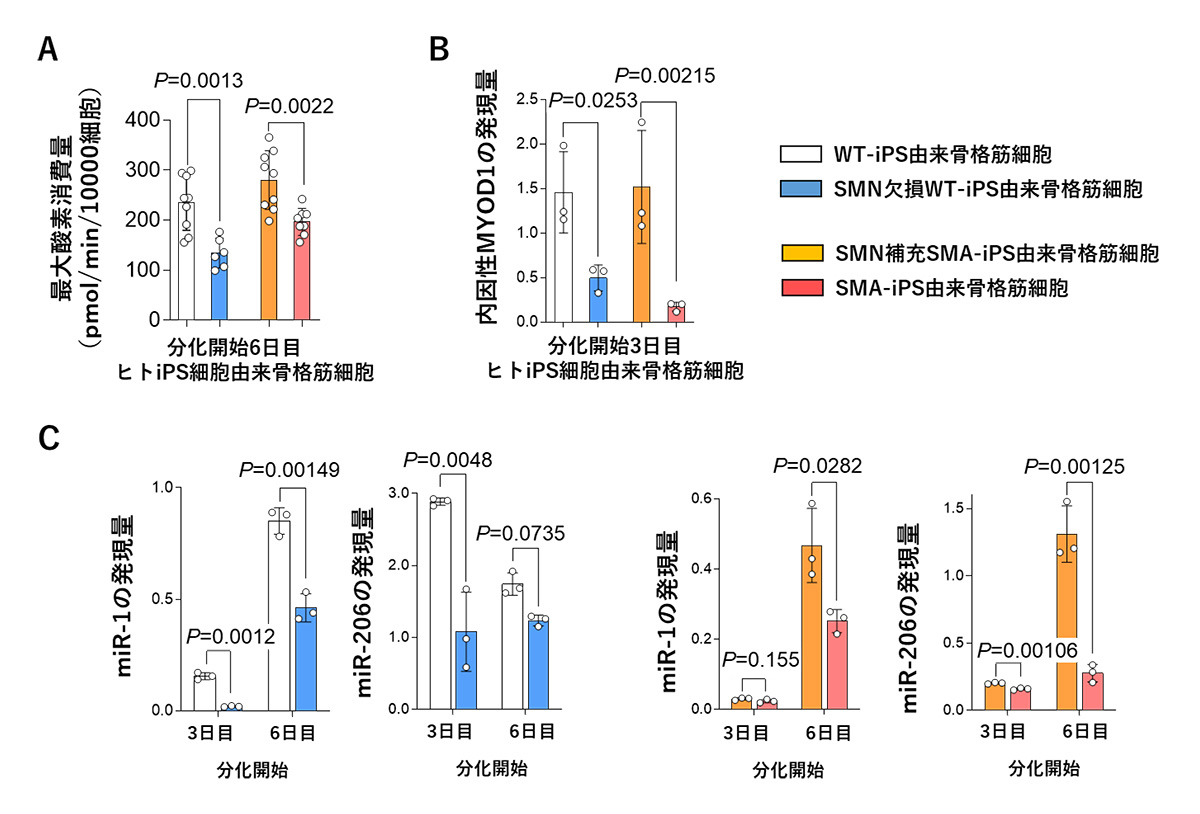
図2 SMN欠損骨格筋細胞におけるミトコンドリアの酸素消費量低下とMYOD1、
miR-1およびmiR-206の発現量低下
A. 分化開始6日目のヒトiPS細胞由来骨格筋細胞のミトコンドリアの酸素消費量
B. 分化開始3日目のヒトiPS細胞由来骨格筋細胞における内因性MYOD1の発現量
(分化誘導のために導入した外因性MYOD1と区別して解析)
C. 分化開始3日目と6日目のヒトiPS細胞由来骨格筋細胞におけるmiR-1
およびmiR-206の発現量
2)SMNによるmiR-1とmiR-206の転写制御
次に、SMNの骨格筋分化過程における機能に着目して解析を進めました。
ヒトiPS細胞を骨格筋細胞に分化する過程におけるSMNの発現量と細胞内での局在を調べたところ、分化開始前と比べて、分化3日目においてSMNの発現量が増加しており、細胞核内に一様に分布をすることを見出しました(図3A、3B)。この結果より、骨格筋分化過程に、SMNがゲノム上で何らかの機能を持つ可能性を考えました。
またMYOD1の転写は、タンパク質であるMYOD1がゲノム上の自己のMYOD1遺伝子の転写調節領域に結合することで制御されており、SMN欠損下ではMYOD1の発現量が低下することが知られています。これらのことから、SMNが転写調節領域においてMYOD1の転写制御へ関与している可能性を調べることにしました。
その結果、ChIP-qPCR法注5)により、MYOD1遺伝子の転写開始点上流においてSMNがゲノムに結合していることが明らかになりました(図3C)。さらに、共免疫沈降法注6)による解析の結果、SMNとMYOD1が物理的に相互作用していることが確認されました(図3D)。
また、これまでにmiR-1およびmiR-206の転写についても、転写調節領域にMYOD1が結合することで、制御されていることが知られていました。そこで、miR-1およびmiR-206についても、SMNがこれらのmiRNAの転写調節領域に結合しているかをChIP-qPCR法によって調べたところ、同様にSMNの結合が認められました(図3E)。
これらの結果を合わせると、SMNは骨格筋分化の特定の時期に、MYOD1、miR-1およびmiR-206の転写調節領域に結合することによって、転写活性の制御に関与していることが示唆されます。
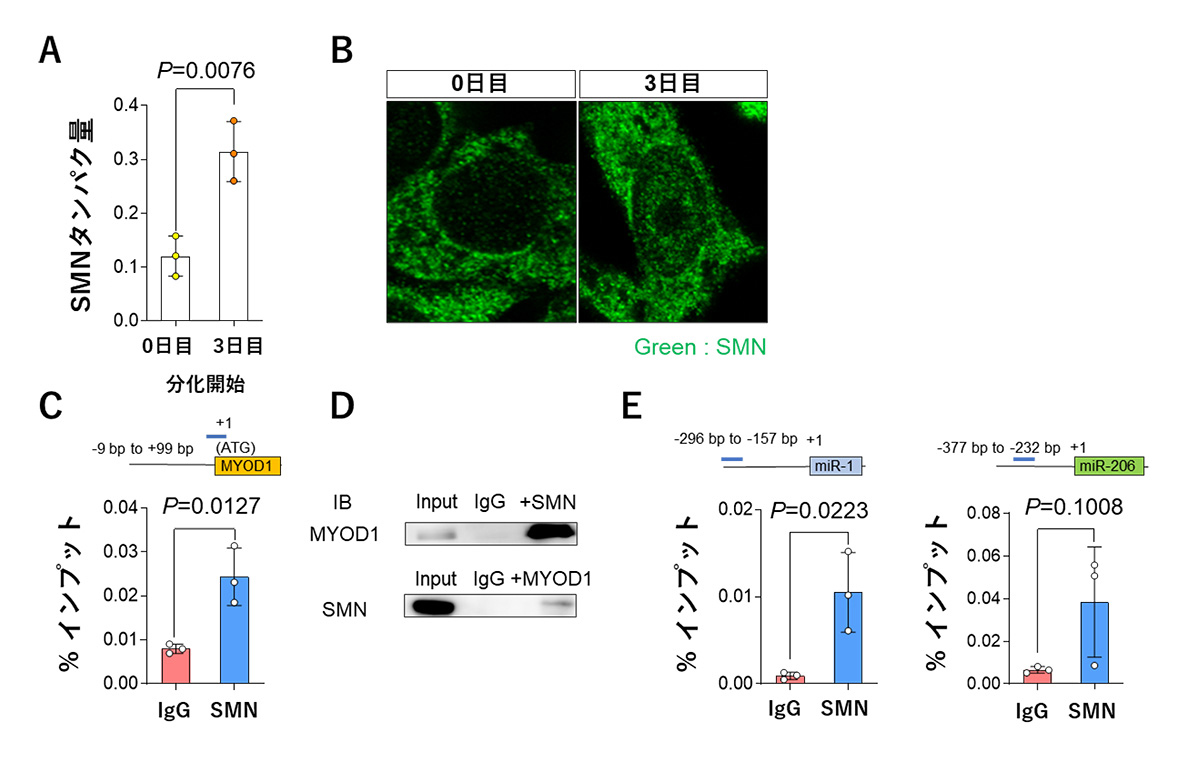
図3 MYOD1、miR-1およびmiR-206の転写開始点上流へのSMNの結合
A. 分化開始0日目と3日目のヒトiPS細胞由来骨格筋細胞におけるSMNタンパク質の発現量
B. 分化開始0日目と3日目のヒトiPS細胞由来骨格筋細胞におけるSMNの細胞核における分布
C. MYOD1の転写開始点上流におけるSMNの結合
D. SMNとMYOD1の物理的相互作用
E. miR-1およびmiR-206の転写開始点上流におけるSMNの結合
IgG : コントロール ━(青色のバー):ChIP-qPCR法における増幅ゲノム領域
3)miR-1およびmiR-206によるSMAモデルマウス由来筋管細胞における疾患表現型の改善
最後に、SMAにおいて発現量の低下しているmiR-1およびmiR-206を骨格筋へ導入することが、SMAの治療法として有効かを検証しました。
SMAモデルマウスより単離した骨格筋幹細胞に、miR-1またはmiR-206もしくはその両方を導入後、筋管細胞へ分化誘導し、疾患表現型が改善するかを評価しました。その結果、miR-1およびmiR-206の導入によって、ミトコンドリアの酸素消費量の上昇(図4A)と筋管細胞の形成能の改善(図4B)が認められました。
さらに、miR-1とmiR-206の導入によって、筋管細胞の収縮機能が改善するかを、筋管細胞の収縮加速度を解析することで検証しました。その結果、miR-1とmiR-206を導入したSMAモデルマウス由来筋管細胞の収縮加速度が、野生型マウス由来筋管細胞と同程度の値まで回復しました(図 4C)。
以上より、miR-1とmiR-206の遺伝子導入は、SMAモデルマウス由来の筋管細胞の疾患表現型を改善することが明らかになりました。この結果は、miR-1とmiR-206がSMAの骨格筋を標的とした治療に有効な因子であることを示唆しています。
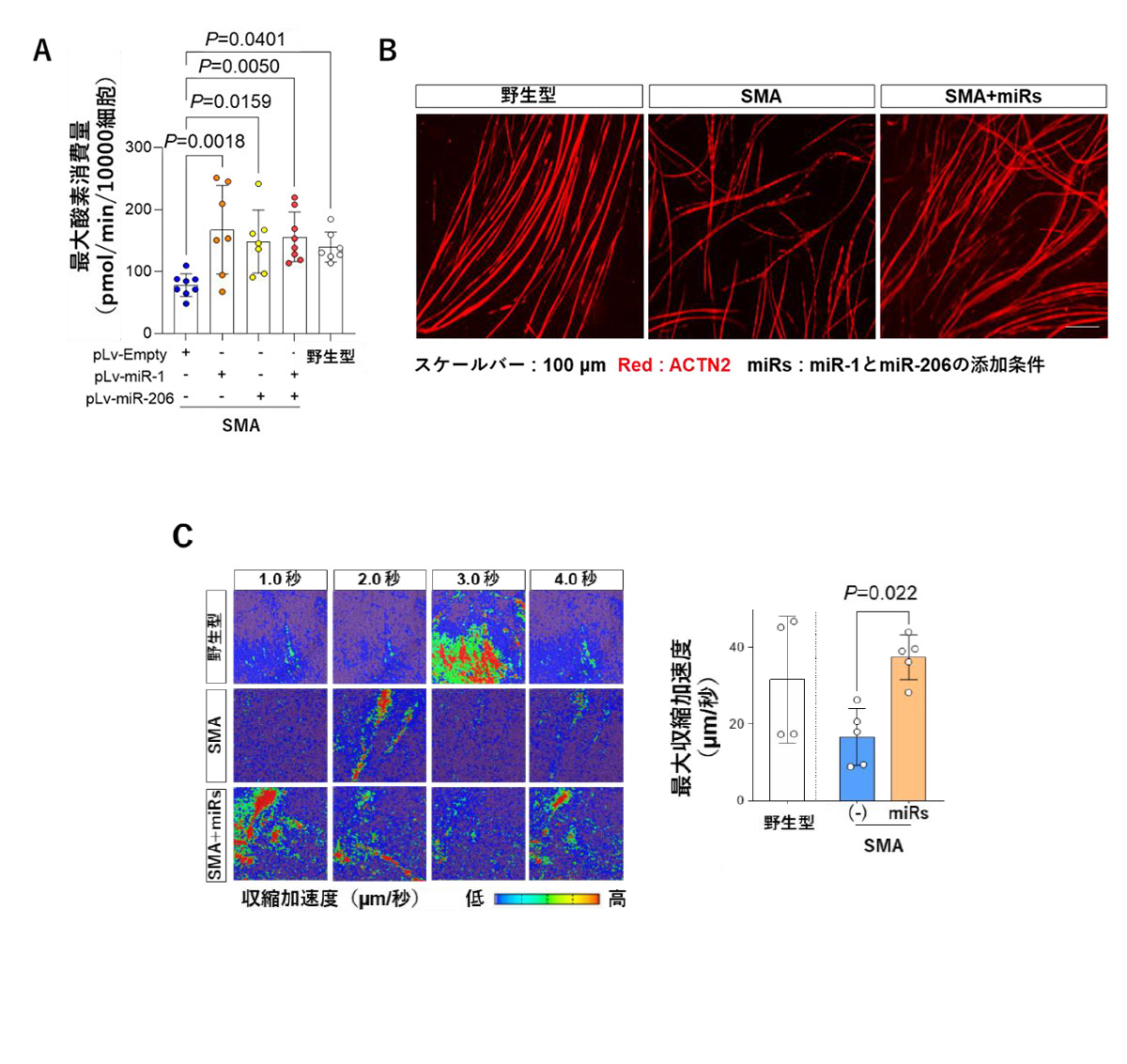
図4 miR-1およびmiR-206を導入したSMAモデルマウス由来筋管細胞の
疾患表現型に対する評価
A. miR-1またはmiR-206もしくは両方を導入したSMAモデルマウス由来筋管細胞の酸素消費量
B. miR-1およびmiR-206を導入したSMAモデルマウス由来筋管細胞の筋管細胞形成能の評価
ɑACTN2 (ɑActinin2) : 筋管細胞のマーカー
C. miR-1およびmiR-206を導入したSMAモデルマウス由来筋管細胞の収縮加速度の解析
SMA患者さん由来の疾患特異的iPS細胞およびSMN欠損マウス筋芽細胞を用いて研究を行い、SMAにおいて、骨格筋の形成過程でmiR-1およびmiR-206の発現量が低下することで、ミトコンドリアの機能異常が引き起こされることを明らかにしました。加えて、SMNがmiR-1およびmiR-206の転写開始点上流に結合していることを見出し、SMNがこれらの発現調節に関与している可能性を示しました。また、SMAモデルマウスより単離した骨格筋幹細胞にmiR-1およびmiR-206を導入し筋管細胞へと分化誘導した場合、ミトコンドリアの機能、筋管細胞形成、骨格筋の収縮能が改善することがわかりました。
以上より、本研究は、SMAの骨格筋病変の発症機構の1つを明らかにしました。今後、骨格筋を標的とした新規治療法の開発に繋がることが期待されます。
- 論文名
SMN promotes mitochondrial metabolic maturation during maturation by regulating the MYOD-miRNA axis - ジャーナル名
Life Science Alliance - 著者
Akihiro Ikenaka1*, Yohko Kitagawa1, Michiko Yoshida2, Chuang-Yu, Lin1,3, Akira Niwa1,
Tatsutoshi Nakahata4, Megumu K. Saito1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所・臨床応用研究部門
- 京都府立医科大学・小児科学教室
- 高雄医学大学(台湾)
- 京都大学 iPS細胞研究所・基盤技術研究部門 創薬技術開発室
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費(16H0552、20H03642)
- iPS細胞研究基金
注1)SMN(survival motor neuron: 生存運動神経)
スプライシング(DNAの遺伝情報がmRNAに転写される際に不要なものを切り離して編集すること)を担うRNA結合タンパク質に作用するタンパク質。SMNタンパク質量が減少することによりSMAを引き起こすと考えられている。
注2)ミトコンドリア
細胞内小器官の1つで、細胞のエネルギーであるATP合成の大半を担っている。
注3)miRNA
マイクロRNA。約25 bp塩基の1本鎖RNAで、特定のmRNAに対して結合することで、遺伝子の転写後発現調節に関与している。
注4)shRNA
short hairpin RNA(短鎖ヘアピンRNA)の略。ヘアピン型のRNAのこと。RNA干渉(RNAi)による目的の遺伝子の働きを抑制するために使われる。
注5)ChIP-qPCR法
目的のタンパクが特定のゲノム領域に結合しているかをqPCRによって定量的に評価する実験手法。
注6)共免疫沈降法
特定のタンパク複合体に含まれるタンパクを同定する実験手法。