
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2023年3月1日
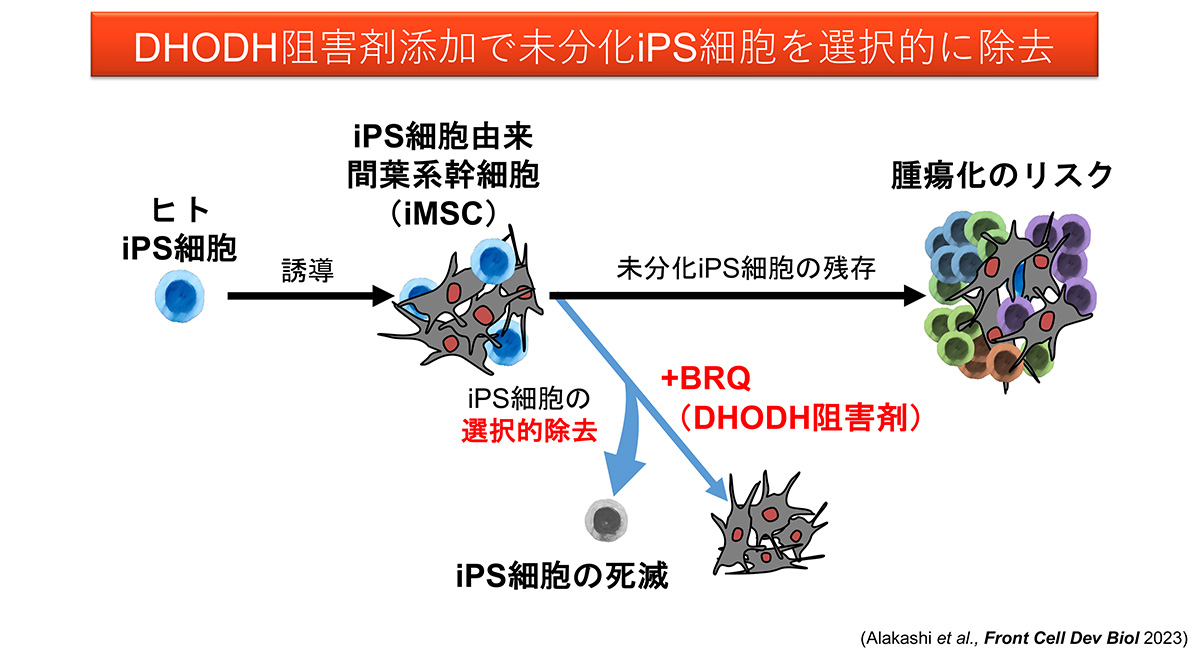
間葉系幹細胞から未分化iPS細胞を選択除去する方法を開発
iPS細胞由来間葉系幹細胞の再生医療利用に期待
ポイント
- ヒトiPS細胞由来間葉系幹細胞注1)から、未分化iPS細胞を除去する方法を確立した。
- この方法により、iPS細胞から誘導した間葉系幹細胞を医療利用する際の腫瘍化リスクが最小限に抑えられる。
Ziadoon Al Akashi大学院生(CiRA臨床応用研究部門)および池谷真准教授(CiRA同部門)らの研究グループは、ジヒドロオロト酸デヒドロゲナーゼ(DHODH)注2)阻害剤の一つであるブレキナー(BRQ)を培地に添加することで、iPS細胞由来間葉系幹細胞(iMSC)からiPS細胞を選択的に除去し、iMSCを精製する方法を確立しました。
iPS細胞から作製した細胞を再生医療に応用する際には、未分化iPS細胞の混入による奇形腫注3)形成の可能性を徹底的に排除する必要があります。研究グループは、ピリミジン新規合成経路酵素注4)のDHODHの阻害剤の1つBRQが、iPS細胞に細胞死、細胞周期停止、分化誘導を引き起こすが、iMSCには引き起こさないことを示しました。また、混合培養の実験から、BRQはiMSCに混じった未分化iPS細胞を選択的に除去できることを示しました。この結果は、iMSCを使った再生医療を成功させるための重要な成果と考えられます。
この研究成果は近藤亨教授(北海道大学)、加藤友久講師(金沢医科大学)らとの共同研究として行われました。論文は、2023年2月6日(スイス時間)に「Frontiers in Cell and Developmental Biology」で公開されました。
間葉系幹細胞(MSC)は、あらゆる組織に存在する細胞で、直接または間接的に組織の再生を促進することが知られています。MSCを用いた移植片対宿主病の治療がすでに始まっており、また急性呼吸窮迫症候群(ARDS)、心筋梗塞などにMSCを用いた治療法の治験も進められています。
しかし、生体からMSCを得る場合には、侵襲性、増殖限界、採取ごとの生物学的特性の違いなど、いくつかの課題があります。これらの課題に対し、iPS細胞からMSC(iMSC)を作製することで、侵襲性がなく、増殖能も高く、また均一な生物学的特性を持つMSCを得ることが可能となります。しかし、iPS細胞から作製した細胞を移植治療に使用する場合、未分化なiPS細胞の残存による奇形腫形成のリスクがあります。よって、移植時に不要なiPS細胞を完全に除去する方法の開発は、安全なiMSC再生医療の実現のために重要なステップです。
これまでの研究で、DHODH阻害剤によって、マウスのES/iPS細胞が選択的に除去可能なことは、すでに示されていました。ヒト細胞でも同様かどうかは不明でしたが、今回、研究グループは、DHODH阻害剤の1つであるBRQ処理により、iMSCから不要なiPS細胞を除去できることを示しました。この研究は、iMSCを使った再生医療に有効な基盤技術開発研究です。
1. DHODH阻害によるヒトiPS細胞の選択的除去
3種類のヒトiPS細胞株(1231A3、RPChiPS771、Ff-XT28s05-Abo_To)を、3種類のDHODH 阻害剤(ASLAN、BRQ、Teriflunomide)で処理し、生存率を検証しました。DHODH阻害剤をさまざまな濃度で7日間細胞を処理したところ、BRQが最も強力で約50 nMの処理でiPS細胞は完全に死滅し、ASLANでは250~500 nMで死滅することが分かりましたわかりました(Fig. 1)。一方、iMSCはDHODH阻害剤に対して強い抵抗性を示し、試験した最高濃度の1000 nMでも生存率は50%を超えていました。これらの結果は、100 nMのBRQがヒトiPS細胞の選択的な除去に有効であること示唆しています。
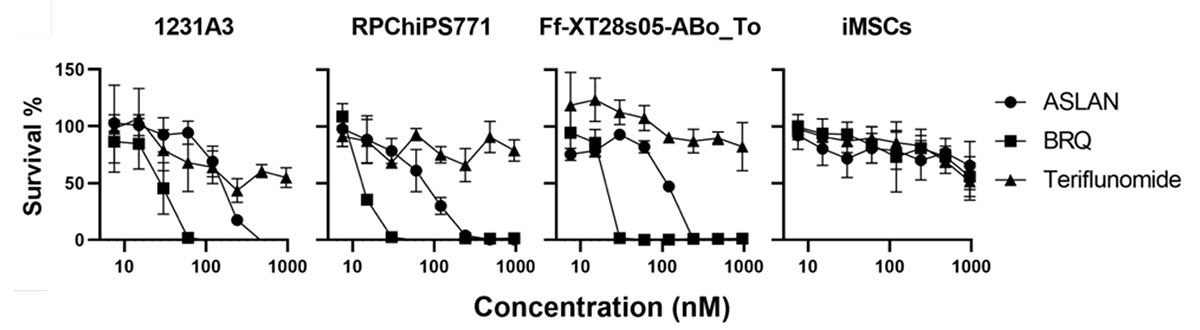
Fig. 1 ヒトiPS株はDHODH阻害剤に強く反応して死滅する
2. DHODH阻害剤BRQによる凝集体の成長阻害と分化促進
次に、iPS細胞を96ウェルU底プレートで培養して3次元の細胞凝集体を作製し、そこに10 ngのbFGFを加えることで自発的な分化を誘導しつつ、100 nMまたは10nMのBRQを加え、8日間培養しました。すると、100 nMのBRQ で処理した細胞凝集体は実験開始後からサイズが大きくならないという結果を得ました(Fig. 2)。
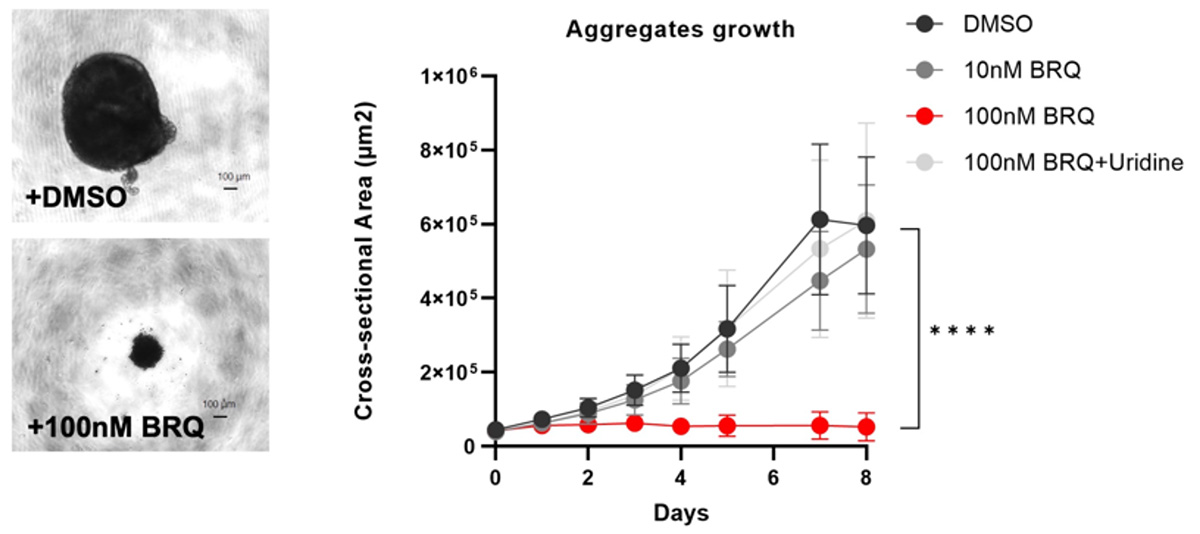
Fig. 2 ヒトiPS細胞凝集体を100nMのBRQで処理すると成長しない
また、処理3日目の凝集体を回収し、遺伝子発現を解析したところ、BRQ処理した凝集体は、外胚葉(PAX6 および NESTIN)、中胚葉(SMA および TBXT)、および内胚葉(FOXA1 および FOXA)注5)の全てのマーカーが上昇し、未分化マーカー (POU5F1、LIN28A) が減少しており、BRQがiPS細胞の分化を誘導することが示されました(Fig. 3)。
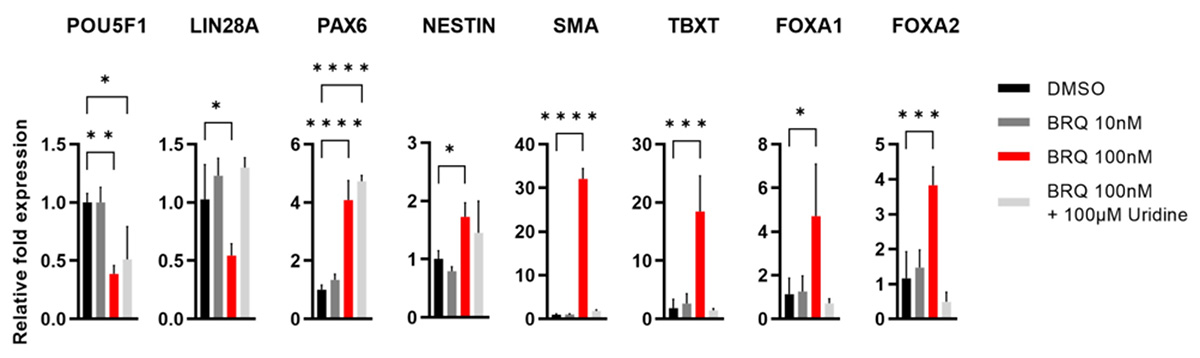
Fig. 3 ヒトiPS細胞凝集体を100nMのBRQで処理すると
未分化マーカーの発現が低下し分化マーカーの発現が上昇する
3. BRQはiMSCとiPS細胞の混合培養からiPS細胞を選択的に除去する
BRQによる未分化iPS細胞除去の有効性をさらに確認するために、iMSCとiPS細胞を混合して両方の細胞を1つのウェルで共培養し、この細胞を100 nMのBRQで7日間処理しました(Fig. 4)。すると、iMSCは生存したのに対し、未分化iPS細胞のコロニーが消失しました。この結果から、BRQはiMSCからiPS細胞を選択的に除去するのに有効であることが示されました。
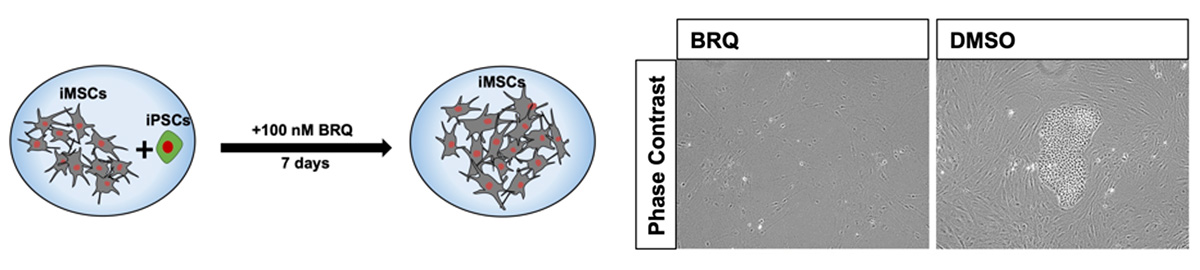
Fig. 4 iPS細胞とiMSCの混合培養をBRQで処理したところ、iPS細胞のコロニーが消失した。
4. ヒトiPS細胞はBRQ処理によりアポトーシスと細胞周期停止を起こす
BRQ処理でiPS細胞が除去される理由を調べるために、BRQで24時間と48時間処理したiPS細胞、および7日間処理したiMSCを、アネキシン V とヨウ化プロピジウム (PI)注6)で染色し、セルソーター注7)で解析しました。
100 nMのBRQで処理したiPS細胞では、アネキシン V と PI の二重陽性の細胞増えており、アポトーシス注8)を起こしていることが分かりました(Fig. 5)。一方。iMSCは100nMのBRQで7日間処理しても、DMSO処理した対照群と比較して、アポトーシスを起こした細胞の割合に変化はありませんでした。また細胞周期を分析したところ、100 nMのBRQ処理したiPS細胞は、処理48時間後にS/G2期で細胞周期停止を起こし、G1期の細胞の割合が大幅に減少しました(Fig. 6)。一方、iMSCを100 nMのBRQで7日間処理しても、細胞周期に変化は観察されませんでした。これらのデータから、BRQはiPS細胞に選択的に細胞周期の停止とアポトーシスを起こすことが示されました。
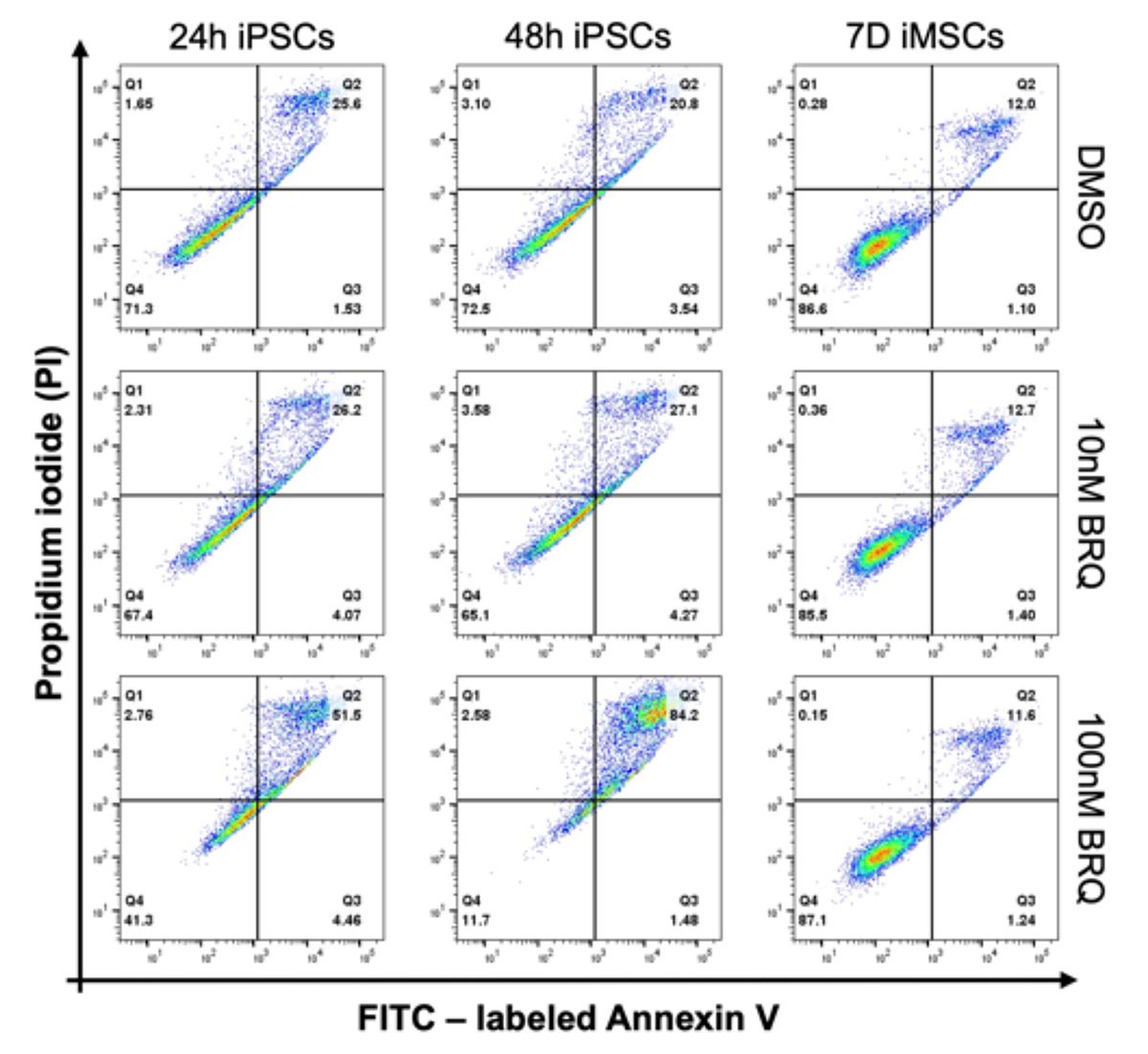
Fig. 5 iPS細胞をBRQで処理したところ、
アネキシンVとPIの二重陽性のアポトーシス細胞が増加した。
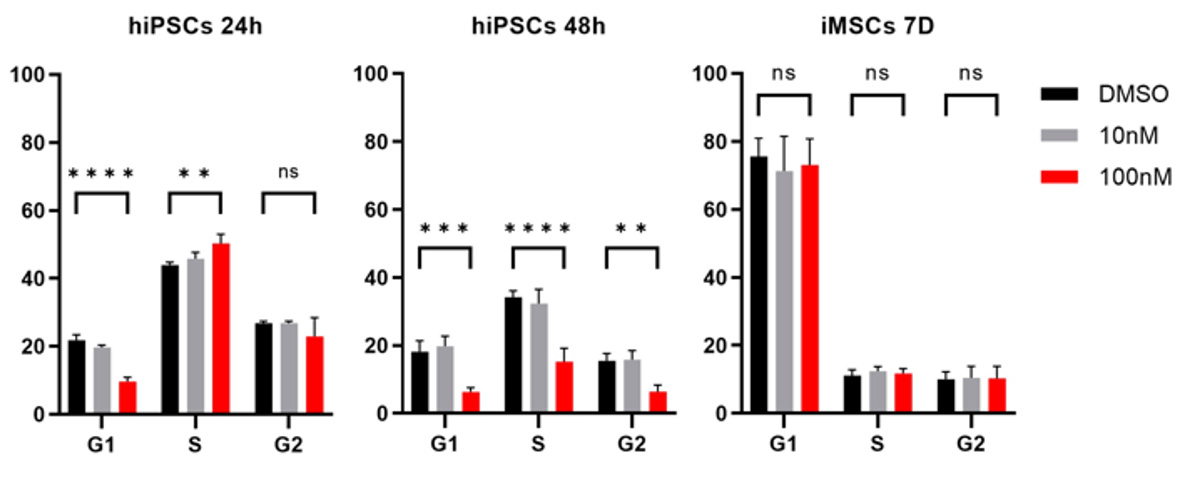
Fig. 6 BRQはiPS細胞に選択的に細胞周期の停止を引き起こす。
5. BRQ処理でiMSCの特性は変化しない
BRQ処理によりiMSCの特性が変化するかどうかを調べました。まずiMSCを100 nMのBRQで7日間処理し、MSCの表面マーカーであるCD105、CD90、CD73、CD44(陽性マーカー)、CD34、CD31(陰性マーカー)の発現を、セルソーターおよびRT-qPCR注9)で調べたところ、対照群と比べて変化はありませんでした(Fig. 7A-B)。また、インターフェロン-γ (IFN-γ) への反応性を、免疫調節遺伝子IDO1およびPD-L1の発現上昇で調べましたが、こちらもBRQ処理群と対照群で変化はありませんでした(Fig. 7C)。さらにiMSCの骨、軟骨、脂肪への分化能を調べましたが、こちらも7日間の BRQ処理群と対照群で違いは観察されませんでした(Fig. 7D-F)。以上から、BRQ処置によってiMSCの特性は変化しないことが示されました。
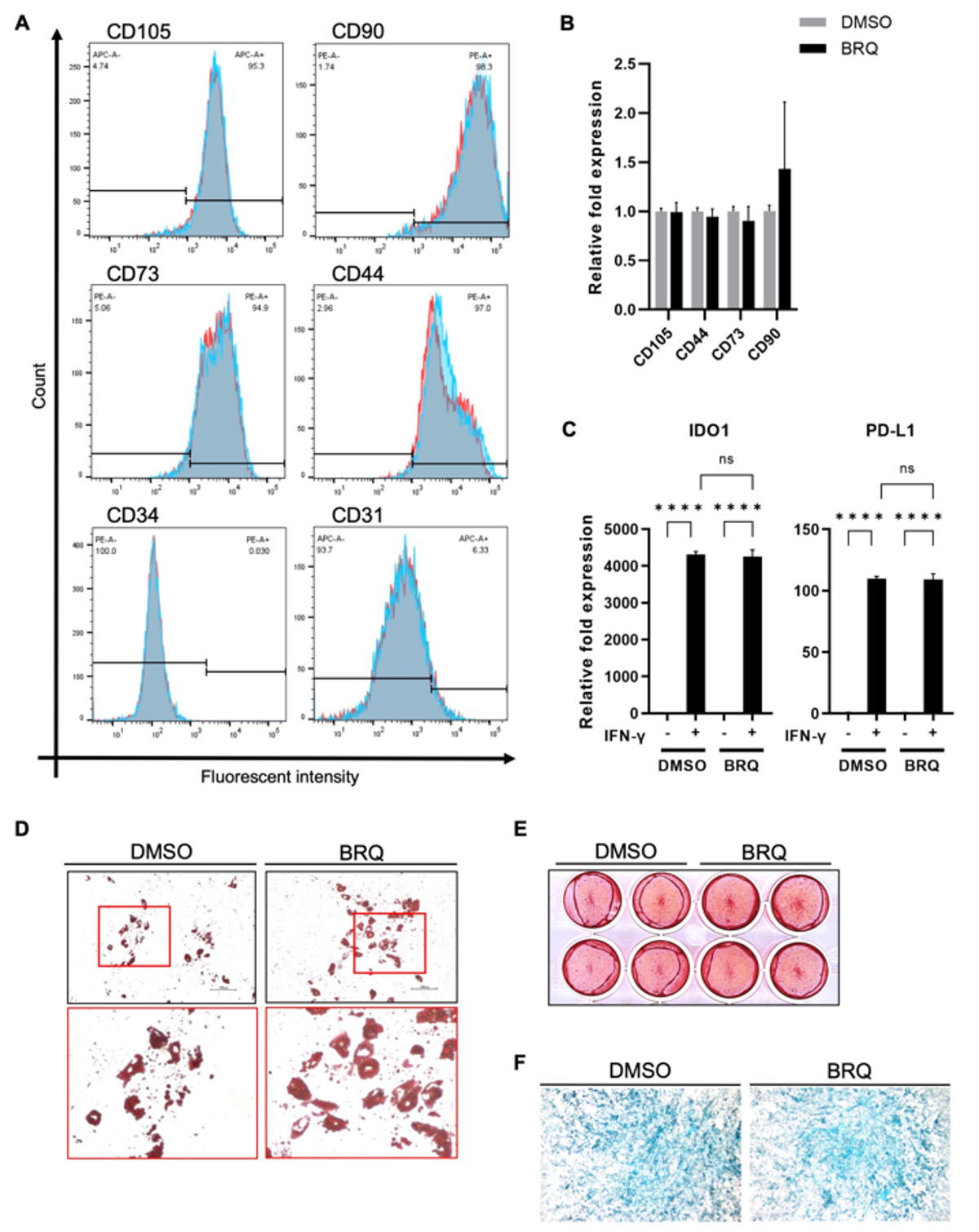
Fig. 7 BRQ処理によりiMSCの特性は変化しない
DHODH阻害剤であるBRQ処理により、iMSCから未分化iPS細胞を選択的に除去できることを示しました。この方法で処理すると、iPS細胞は細胞周期を停止し、アポトーシスを起こし、また未分化マーカーの発現が減少し、分化マーカーの発現が上昇しました。一方、同じ処理をしてもiMSCは生存し、さらに本来の特性を失わないことを示しました。
iPS細胞から分化させた細胞を臨床応用する場合、未分化iPS細胞の混入による奇形腫形成のリスクがあります。今回の研究では、iMSCは、途中段階の細胞である神経堤細胞注10)を経由した二段階誘導法により作製されており、その過程でセルソーターによる神経堤細胞の抽出と未分化細胞の除去が行われているため、元々リスクはほとんどありません。しかし、実際の臨床応用ではマウス等の小動物を使った実験と比較して非常に大量の細胞を移植する可能性があり、その場合には腫瘍化のリスクが高まります。今後、iMSCを細胞移植治療の細胞源の一つとして利用する際に、今回の研究成果が役立ち、患者さんが安心してiMSCを使った治療を受けて頂くための一助となることが期待されます。
- 論文名
Selective vulnerability of human-induced pluripotent stem cells to dihydroorotate dehydrogenase inhibition during mesenchymal stem/stromal cell purification - ジャーナル名
Frontiers in Cell and Developmental Biology - 著者
Ziadoon Al-Akashi1, Denise Zujur1, Daisuke Kamiya1,2, Tomohisa Kato Jr3, Toru Kondo4
and Makoto Ikeya1,2*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 金沢医科大学総合医学研究所
- 北海道大学遺伝子病制御研究所
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」
「再生医療実現拠点ネットワークプログラム 再生・細胞医療・遺伝子治療研究開発課題」 - 日本学術振興会 科研費(#22H03275, #22H03204)
- iPS細胞研究基金
- 武田薬品工業株式会社
- 科学技術振興機構 次世代研究者挑戦的研究プログラム(JPMJSP2110)
- 北海道大学 遺伝子病制御研究所 一般共同研究
注1) iPS細胞由来間葉系幹細胞
間葉系幹細胞は、成体内に存在する幹細胞の一種で、骨や軟骨、脂肪などに分化する能力がある。これをiPS細胞から誘導したものがiPS細胞由来間葉系幹細胞(iMSC)。
注2) ヒドロオロト酸デヒドロゲナーゼ(DHODH)
ピリミジンヌクレオシド生合成経路の第4反応であるジヒドロオロト酸からオロト酸への参加を触媒する酵素。
注3)奇形腫
外胚葉、中胚葉、内胚葉の三胚葉由来の胎児性組織および成熟性組織を含む腫瘍。テラトーマともいう。
注4)ピリミジン新規合成経路酵素
アミノ酸などを材料としてピリミジンを新規に生合成する経路を制御する酵素。
注5)外胚葉・内胚葉・中胚葉
発生の過程で、外側の細胞(外胚葉)と内側の細胞(内胚葉)、さらにその両者の間にある細胞(中胚葉)に大きく分かれる。 外胚葉からは皮膚や神経などの細胞が、内胚葉からは消化管や肝臓などが、中胚葉からは血液や筋肉や骨などが作られる。
注6)アネキシン V とヨウ化プロピジウム (PI)
アネキシンVは、細胞膜の脂質二重層の内側に存在しているフォスファチジルセリンに、Ca2+存在下で強く結合する物質。アポトーシスが起こると細胞膜内側にあるフォスファチジルセリンが細胞表面に露出されるため、アネキシンVで検出されることはアポトーシスの指標となる。PIは二重らせん分子にインターカレートすることでDNAに結合する。通常、細胞に傷がない場合にはPIが細胞内に入らず、よってDNAとは結合しないため、死細胞の指標となる。
注7)セルソーター
セルソーターとは、浮遊液中の細胞1つ1つを蛍光標識技術や散乱光を利用して分析、分取する装置。
注8)アポトーシス
プログラム細胞死ともいう。あらかじめ予定されている細胞の死。
注9)RT-qPCR
遺伝子の発現量を調べる方法。
注10)神経堤細胞
発生の途中で一時的に現れる細胞で、さまざまな細胞に分化する。第四の胚葉とも呼ばれる。






















