ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2023年3月8日
新型コロナウイルス感染症(COVID-19)研究のための肝臓チップの開発 ~肝障害の病態解明と治療薬の評価~
ポイント
- 臓器チップ注1)技術を用いて胆管および血管の構造をもつ肝臓チップ(肝内胆管チップおよび肝内血管チップ)を開発した。
- 肝臓チップを用いて新型コロナウイルス(SARS-CoV-2)注2)感染における部位特異的な肝障害と後遺症の再現に成功した。
- SARS-CoV-2感染によって肝内血管チップにおいて生じた肝障害について、レムデシビルとバリシチニブを併用することで治療できることを示した。
- 新型コロナウイルス感染症(COVID-19)注3)の重症の患者さんでは、血清中の肝障害マーカーの上昇が高頻度にみられたが、胆道系疾患マーカーの上昇はみられなかった。
出口清香 大学院生(CiRA増殖分化機構研究部門、医学研究科)、高山和雄 講師(CiRA同部門)らの研究グループは、胆管および血管の構造をもつ肝臓チップ(肝内胆管チップおよび肝内血管チップ)を開発し、新型コロナウイルス感染症(COVID-19)の患者さんの肝臓における病態の解明と創薬への応用を試みました。
その結果、新型コロナウイルス(SARS-CoV-2)感染は血管周囲での肝細胞障害を引き起こすことが分かりました。また、SARS-CoV-2感染後の肝臓で認められる後遺症を肝内血管チップで再現することにも成功しました。さらに、肝内血管チップで再現した肝障害はレムデシビルとバリシチニブを使用することで治療できることを確認しました。
ヒト肝臓の三次元構造と肝機能をより正確に模倣する肝臓チップ技術をCOVID-19研究に活用することで、COVID-19患者さんの病態の理解と治療薬の開発が進むことが期待されます。
この研究成果は2023年3月7日(米国時間)に「PNAS Nexus」でオンライン公開されました。
SARS-CoV-2はヒトの複数の臓器に感染し、さまざまな臓器障害を引き起こします。COVID-19患者さんにおいては呼吸器障害が多く報告されていますが、そのほかにも、肝臓や心臓、腎臓、腸管、神経系における異常が確認されています。そのなかでも肝障害は、COVID-19重症化リスクとの関連が示唆されています。さらに、COVID-19患者さんにおける肝障害は部位特異性があることが確認されており、肝臓の血管周囲では炎症反応がみられる一方で、胆管周囲ではほとんど構造上の異常がみられないことがこれまでに報告されています。しかし、COVID-19患者さんの肝臓の病態解明は十分に進んでいないというのが現状です。このため、COVID-19患者さんの病態を再現した肝臓モデルが必要です。
これまで生体外(in vitro)肝臓モデルとして、肝がん細胞株等が広く使用されてきました。しかし、従来の肝細胞モデルは血管や胆管などの構造を有していないため、血管や胆管周囲の複雑な病態を再現することは困難です。そこで、本研究グループがこれまでに開発した生体内(in vivo)の三次元構造および動的刺激を模倣した環境下で細胞培養を可能にする臓器チップ技術を用いて、新規の肝臓モデルとして血管や胆管周囲の構造を再現した肝臓チップの開発に取り組みました。
そして、今回作製した肝臓チップによるSARS-CoV-2感染モデルを使用し、COVID-19患者さんにおける肝障害の病態解明および治療薬評価を行いました。さらに、COVID-19患者さんの血液検査値の解析を行い、肝臓チップを用いて得られた結果と比較することで、COVID-19研究における肝臓チップの有用性を検証しました。
1) 胆管および血管周囲の肝臓の三次元構造を再現した肝臓チップの開発
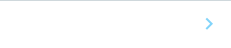
胆管および血管周囲の肝臓を再現するために、マイクロ流体デバイス注4)に肝細胞および胆管上皮細胞、血管内皮細胞を搭載した、肝内胆管チップ(胆管チップ)および肝内血管チップ(血管チップ)を開発しました。本研究グループのマイクロ流体デバイスは、ポリジメチルシロキサン(PDMS)注5)で作製された流路を持ち、流路が2枚の多孔質膜で仕切られた構造です(図1A)。このマイクロ流体デバイスの、多孔質膜で仕切られた上側の流路(top channel)に肝細胞、下側の流路(bottom channel)に胆管上皮細胞をそれぞれ搭載することで胆管チップを構築しました。同様に、top channelに肝細胞、bottom channelに血管内皮細胞をそれぞれ搭載し血管チップを構築しました(図1B,C)。
免疫染色法により各細胞のチップ内の分布を調べたところ、胆管チップにおいて胆管上皮細胞がbottom channel内で管状の構造をとり、そこに肝細胞がシート状に隣接する様子が確認されました(図1D)。同様に、血管チップにおいて血管内皮細胞がbottom channel内で管状の構造をとり、そこに肝細胞がシート状に隣接する様子が確認されました(図1E)。よって、胆管および血管付近の三次元構造を再現した、胆管チップおよび血管チップの開発にそれぞれ成功しました。
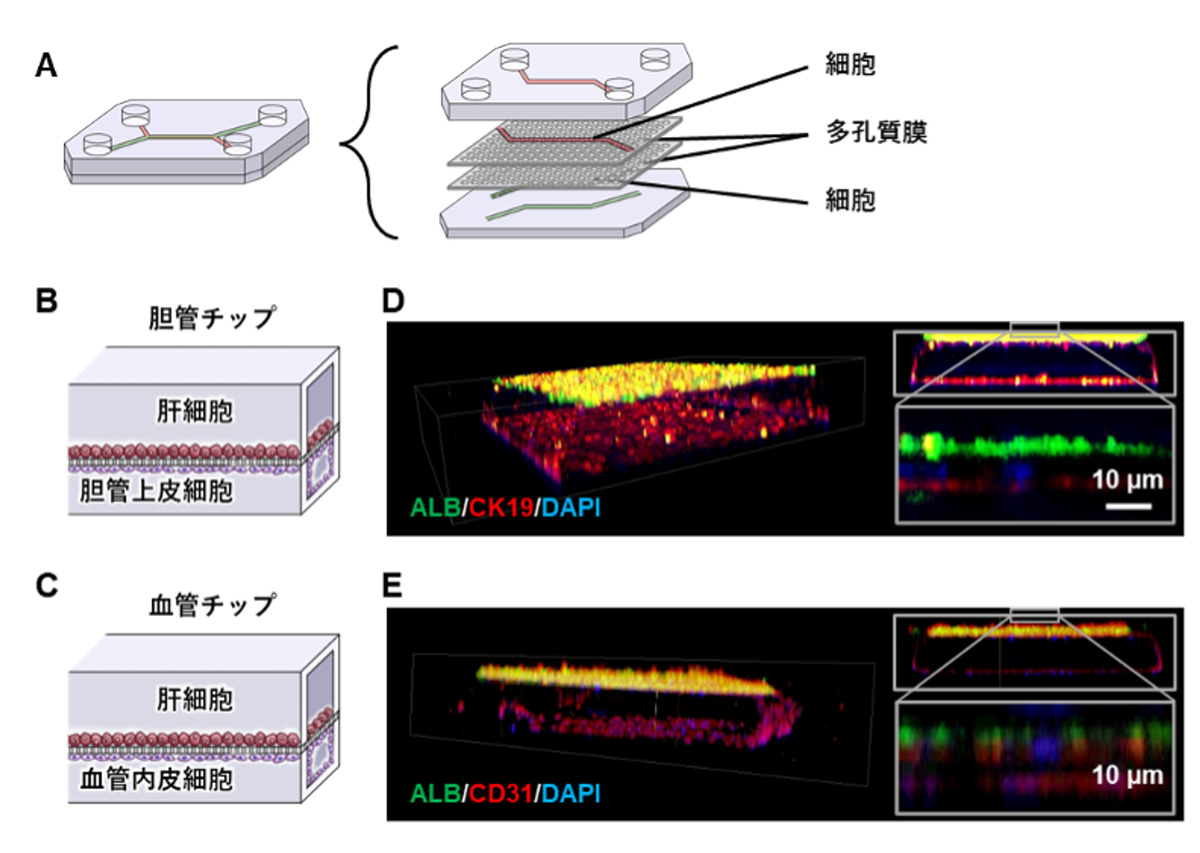
図1 肝臓チップ(胆管チップと血管チップ)
A. マイクロ流体デバイスの構造。2枚の多孔質膜で仕切られた上下二つの流路を持つ。
B. 胆管チップの模式図。マイクロ流体デバイスのtop channelに肝細胞、bottom channelに胆管上皮細胞が存在する。
C. 血管チップの模式図。マイクロ流体デバイスのtop channelに肝細胞、bottom channelに血管内皮細胞が存在する。
D. 胆管チップにおける肝細胞マーカー(ALB、緑)および胆管上皮細胞マーカー(CK19、赤)の
免疫染色結果。DAPI(青)で核染色を実施。
E. 血管チップにおける肝細胞マーカー(ALB、緑)および血管内皮細胞マーカー(CD31、赤)の
免疫染色結果。DAPI(青)で核染色を実施。
2) 胆管チップおよび血管チップを用いたSARS-CoV-2感染実験
COVID-19患者さんにおける肝臓の病態を解明するため、2種の肝臓チップを用いたSARS-CoV-2感染実験を実施しました。SARS-CoV-2に感染した肝細胞から、どのようにしてウイルス感染が広がり、病変するのか調べるため、本実験ではそれぞれの肝臓チップのtop channelにSARS-CoV-2を含む培地を流しました。
その結果、いずれの肝臓チップにおいても、感染後2日目には培養上清中からウイルスゲノムが検出されましたが、感染後14日目になるとウイルスゲノムはほとんど検出されなくなりました(図2A)。また、SARS-CoV-2の存在を示すタンパク質であるヌクレオカプシドタンパク質(NP)注6)の染色を行ったところ、感染後2日目には両方の肝臓チップでNP陽性のウイルス感染肝細胞がみられました(図2B)。以上の結果より、SARS-CoV-2は胆管チップおよび血管チップのどちらの肝細胞にも感染するが、いずれも14日後には大部分が排除されることが分かりました。
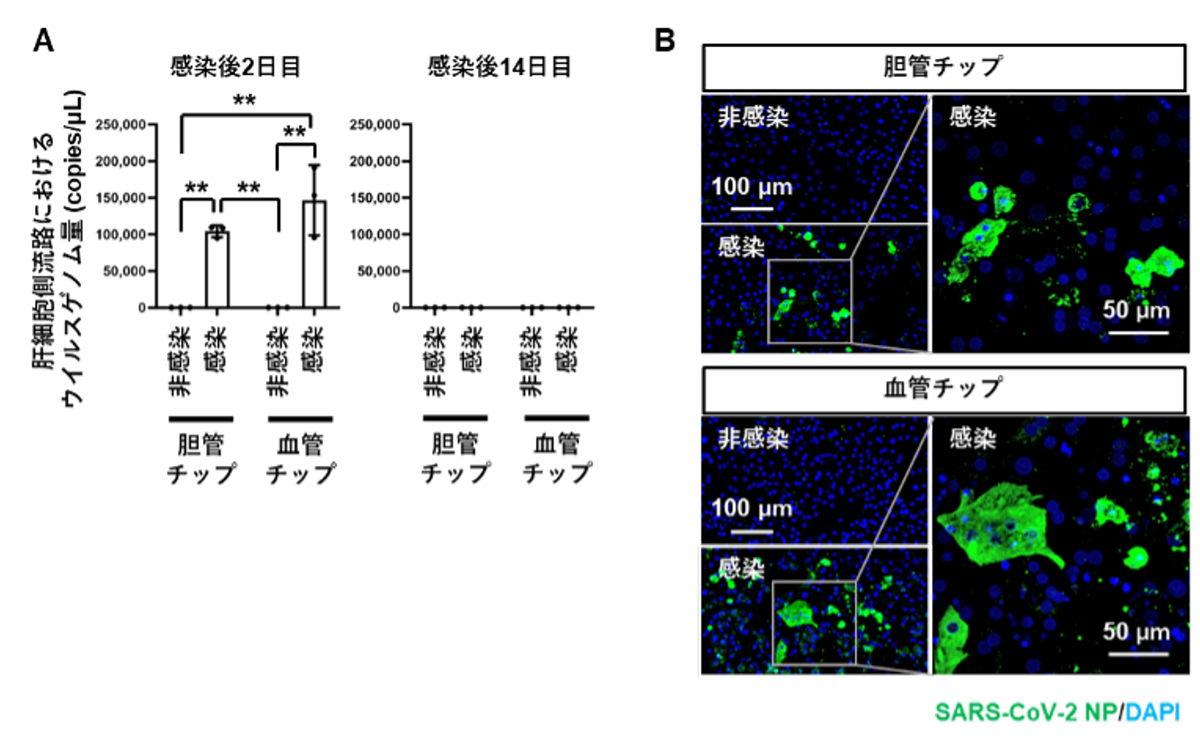
図2 肝臓チップを用いたSARS-CoV-2感染実験
A. SARS-CoV-2感染後2日目および14日目において、胆管チップおよび血管チップのtop channel側から培養上清を回収し、ウイルスゲノム量を測定した。
B. SARS-CoV-2感染後2日目における、胆管チップおよび血管チップのヒト肝細胞を用いて、SARS-CoV-2のNP(緑)の免疫染色を行った。DAPI(青)で核染色を実施。
3) SARS-CoV-2感染が引き起こす血管チップの障害は、レムデシビルとバリシチニブの併用により軽減する
COVID-19患者さんの肝障害が、SARS-CoV-2感染による直接的な影響で生じているのか、あるいは肝臓以外でSARS-CoV-2に感染した臓器から放出されたサイトカインなどの間接的な影響で生じているのかについては、十分に明らかになっていません。そこで、胆管チップおよび血管チップを用いて、SARS-CoV-2感染に起因する肝障害に関する検討を行いました。
胆管チップおよび血管チップのtop channelからSARS-CoV-2を感染させ、培養上清に分泌される細胞傷害性マーカーである乳酸脱水素酵素(LDH)注7)産生量を測定しました(図3A)。上清中のウイルスゲノム量は感染後14日目で消失していたのに対し(図2A)、LDH産生量は、感染後14日目においても上昇していました(図3A)。このLDH産生量の上昇は、胆管チップよりも血管チップにおいてより顕著でした。
さらに、肝細胞内の中性脂肪の増加は、肝障害の指標とされているため、感染後14日目の胆管チップおよび血管チップの肝細胞における中性脂肪の蓄積を評価しました(図3B)。その結果、感染によって血管チップの肝細胞において顕著な脂肪滴の増加がみられました。したがって、血管チップにおける肝細胞では、SARS-CoV-2感染によって肝障害が誘発されることが示唆されるとともに、ウイルス排除後も肝障害が残ること、すなわち肝臓における後遺症の再現が示唆されました。
次に、血管チップを用いて、COVID-19治療薬の評価を実施しました。抗ウイルス薬レムデシビルおよび抗炎症薬バリシチニブ注8)は、COVID-19への使用が承認されている薬です。レムデシビルの単独投与よりも、レムデシビルとバリシチニブの併用投与のほうが、COVID-19からの回復率が向上することが臨床研究において報告されています。そこで、SARS-CoV-2に感染した血管チップに生じた肝細胞傷害も、両薬剤の併用投与により改善するのではないかと考え、血管チップにSARS-CoV-2を感染させたあと、感染後2日目から両薬剤を作用しました。
その結果、SARS-CoV-2感染後14日目におけるLDH産生量は、薬剤非作用群およびレムデシビル単独作用群では上昇しましたが、レムデシビルとバリシチニブの併用群では有意に低下しました(図3C)。さらに、感染後14日目の血管チップの肝細胞における中性脂肪の蓄積も、両薬剤の併用群においてのみ軽減しました(図3D)。以上の結果より、SARS-CoV-2感染によって引き起こされる肝障害は、レムデシビルとバリシチニブを併用投与することで軽減することが示唆されました。
図3 肝臓チップによる肝障害の検証
A. SARS-CoV-2感染後2日目および14日目において、胆管チップおよび血管チップのtop channel側から培養上清を回収し、LDH産生量を測定した。
B. SARS-CoV-2感染後14日目において、胆管チップおよび血管チップの肝細胞でOil Red O染色注9)を実施した。肝細胞に蓄積した中性脂肪が赤く染色されている。
C. SARS-CoV-2感染後14日目の血管チップのtop channel側から培養上清を回収し、LDH産生量を測定した。
D. SARS-CoV-2感染後14日目の血管チップの肝細胞でOil Red O染色を実施した。肝細胞に蓄積した中性脂肪が赤く染色されている。
4) 軽症および重症のCOVID-19患者さんの検体を用いた肝障害の評価
最後に、肝臓チップから得られた結果が、COVID-19患者さんの病態を正確に反映しているか確かめるため、COVID-19患者さんの血液検査結果との比較を行いました。発症から2週間時点のCOVID-19患者さんの血清中の肝障害マーカーの平均値が正常範囲よりも高値を示すかどうかを調べました(図4)。
その結果、肝障害マーカーであるアスパラギン酸アミノトランスフェラーゼ(AST)(odds ratio, 30.6; 95% CI, 1.19-784.70)やアラニンアミノトランスフェラーゼ(ALT)(odds ratio, 35; 95% CI, 1.74 - 703.03)が異常値を示す患者さんは、軽症よりも重症の患者さんで高頻度に生じることが分かりました。一方で、胆道系疾患マーカーであるアルカリフォスファターゼ(ALP)および総ビリルビン(T-BIL)が異常値を示した患者さんは軽症および重症の患者さんともに少なく、その頻度に差がありませんでした。このことから、COVID-19患者さんにおける肝障害では、胆汁うっ滞症などの胆道系疾患は生じないことが示唆されました。
これは、血管チップでは肝細胞障害がみられたのに対し、胆管チップでは細胞障害がみられなかったという2種の肝臓チップによる実験結果と一致する傾向を示しており、血管チップで見られた障害が、COVID-19重症の場合の病態を再現していることを示唆しています。
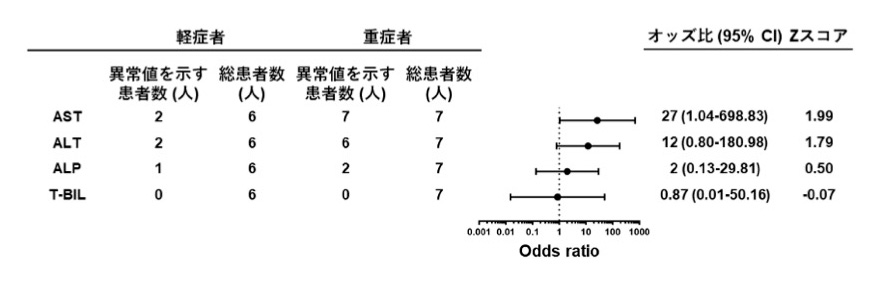
図4 COVID-19重症度と肝障害との関連を示すオッズ比注10)
COVID-19患者さんのうち、発症後2週間における血清中肝障害マーカー(ASTおよびALT)および
胆道系疾患マーカー(ALPおよびT-BIL)の平均値が異常値を示す人数を症状の重症度別で比較した。
本研究では、胆管や血管の構造をもつ肝臓チップを用いて、SARS-CoV-2感染が胆管周囲よりも血管周囲の肝臓において障害を引き起こす可能性を明らかにしました。また、このような肝障害はレムデシビルとバリシチニブの併用投与により軽減することが分かりました。さらに、COVID-19患者さんの血清を用いた解析により、軽症よりも重症の患者さんにおいて肝障害マーカーの異常が高頻度に生じることを見出しました。肝臓チップと臨床検査の結果を用いることで、COVID-19患者さんの病態をより詳細に明らかにできると期待されます。
- 論文名
Elucidation of the liver pathophysiology of COVID-19 patients using liver-on-a chips - ジャーナル名
PNAS Nexus - 著者
Sayaka Deguchi1,2, Kaori Kosugi1, Rina Hashimoto1, Ayaka Sakamoto1, Masaki Yamamoto3, Rafal P. Krol4, Peter Gee5, Ryosuke Negoro6, Takeshi Noda7,8, Takuya Yamamoto1,9,10, Yu-suke Torisawa11, Miki Nagao3, Kazuo Takayama1,12,*
* : 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 京都大学大学院医学研究科臨床病態検査学
- 京都大学iPS細胞研究財団
- MaxCyte社
- 立命館大学薬学部
- 京都大学医生物学研究所微細構造ウイルス学分野
- 科学技術振興機構戦略的創造研究推進事業(CREST)
- 京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 京都大学大学院工学研究科マイクロエンジニアリング専攻
- 日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)
本研究は、下記機関より支援を受けて実施されました。
- 京都大学基金 iPS細胞研究基金
- 京都大学iPS細胞研究所山中伸弥研究室への新型コロナウイルス特別研究助成
- 国立研究開発法人日本医療研究開発機構(JP20fk0108533, JP21fk0108492, JP21gm1610005)
- 国立研究開発法人科学技術振興機構(ACT-X, JPMJAX222A)
- 日本学術振興会 特別研究員
- 公益財団法人 三菱財団
注1)臓器チップ
生体内の三次元環境および力学的・動的刺激を再現したマイクロ流体デバイスを用いて開発された細胞モデル。
注2)新型コロナウイルス(SARS-CoV-2)
Severe acute respiratory syndrome coronavirus 2の略。ヒトの様々な臓器に感染し、呼吸器およびその他の臓器の障害を引き起こすことが知られている。
注3)新型コロナウイルス感染症(COVID-19)
SARS-CoV-2感染によって引き起こされる感染症。
注4)マイクロ流体デバイス
自在に幅と深さを設計した微小流路を持つ細胞培養用デバイス。
注5)ポリジメチルシロキサン(PDMS)
マイクロ流体デバイス作製に汎用されているシリコーン素材の一種。
注6)ヌクレオカプシドタンパク質(NP)
SARS-CoV-2に最も多く存在する構造タンパク質である。
注7)乳酸脱水素酵素(LDH)
障害を受けた細胞から放出される酵素。細胞培養上清中のLDH産生量を測定することで、培養細胞の障害レベルを評価することができる。
注8)抗ウイルス薬レムデシビルおよび抗炎症薬バリシチニブ
COVID-19治療薬として承認されている薬。レムデシビルはRNA依存性RNAポリメラーゼ活性を阻害し、バリシチニブはヤヌスキナーゼの働きを阻害する。
注9)Oil Red O染色
細胞内の中性脂肪を染色する手法。
注10)オッズ比
二つのオッズの比。オッズとは、ある事象の起こりやすさを示す指標。