
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2024年2月19日
オミクロンXBB.1.5のウイルス学的特性の解明 ~新型コロナウイルスの生態の全容解明に貢献すると期待~
ポイント
- オミクロンXBB.1.5のウイルス学的特性を多角的に解明した。
- ウイルスの性状変化に関与するウイルスタンパク質とそのアミノ酸を同定した。
- 新型コロナウイルスの生態の全容解明に貢献することが期待される。
高山和雄 講師(CiRA増殖分化機構研究部門)、福原崇介教授(北海道大学大学院医学研究院)、研究コンソーシアム「The Genotype to Phenotype Japan (G2P-Japan)」注1)らは、2022年10月ごろに出現したオミクロン注2)XBB.1.5のウイルス学的特性を明らかにしました。
XBB.1.5は、それ以前に流行していたXBB.1と比較して、スパイクタンパク質注3)とORF8タンパク質注4)にアミノ酸の点変異注5)をもつことがわかっていました。しかし、なぜ二つのアミノ酸の違いで、XBB.1.5が流行するに至ったのかは不明でした。本研究では、このXBB.1.5について系統進化、スパイクタンパク質の構造およびウイルス学的解析を行うことで、多角的にその特性を解析しました。
まず、オミクロンの系統進化学的解析を行ったところ、XBB.1.5で認めた二つの変異はORF8、スパイクの順に出現したことがわかりました。次に、直接の祖先であるXBB.1とXBB.1.5を用いて、中和試験注6)を実施したところ、同等の中和感受性を示すことがわかりました。クライオ電子顕微鏡を用いた解析ではXBB.1とXBB.1.5のスパイクタンパク質と新型コロナウイルス(SARS-CoV-2)の感染受容体であるACE2注7)との相互作用の違いは認めませんでした。また、合胞体形成活性注8)、培養細胞およびオルガノイドでの増殖能もXBB.1とXBB.1.5との間で有意な差を認めませんでした。一方で、ハムスターモデルにおけるXBB.1.5の病原性はXBB.1よりも低いことが明らかとなりました。そこで、ウイルスの弱毒化のメカニズムを明らかにするために、オルガノイドにおけるMHCクラスI分子注9)の発現を調べました。その結果、XBB.1.5はXBB.1と比較して、発現の低下が抑えられていないことがわかりました。それぞれの点変異をもつ組換えウイルス注10)を作出し、病原性試験を行ったところ、ORF8の機能欠損による免疫抑制機構の低下がXBB.1.5の病原性に関与することを突き止めました。
この研究成果は、2024年2月8日(木)に「Nature Communications」で掲載されました。
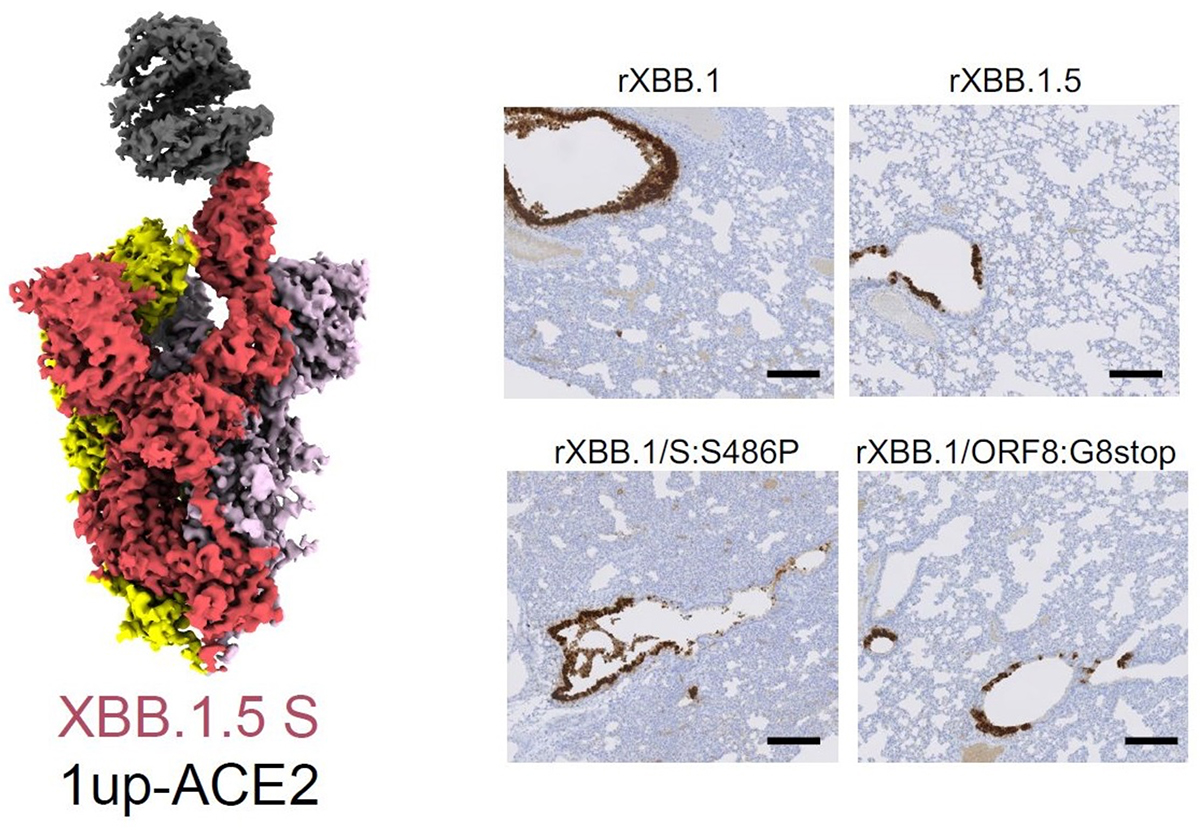
XBB.1. 5の多角的なウイルス性状解析
ウイルス感染症の制御が難しい一因は、ウイルスが変異を獲得し進化することにあります。実際に、新型コロナウイルス(SARS-CoV-2)は流行の過程で著しく多様化し、「変異株」と呼ばれるさまざまな特性をもったウイルスが出現しました。SARS-CoV-2の研究を通し、ウイルスの進化と流行の原理を理解することができれば、新型コロナウイルス感染症(COVID-19)だけでなく、将来のパンデミックを含めたさまざまな感染症の制御につながる知見を得られることが期待されます。
社会でワクチン接種が奨励され、またSARS-CoV-2感染を経験することで免疫が賦与されているにもかかわらず、2022年9月頃からインドを中心に流行を拡大したオミクロンXBBが進化し、XBB.1さらにはXBB.1.5に系統分類されるSARS-CoV-2によるCOVID-19が世界で流行するようになりました。XBB.1.5はその親株であるXBB.1と比較して、ウイルスタンパク質に二つの点変異を認めるのみでしたが、オミクロンXBB.1.5の実効再生産数注11)は、約1.2倍高いことが報告されています。そのため、オミクロンXBB.1.5は世界保健機関(WHO)より2023年1月に注目すべき変異株(variant of interest、VOI)に指定されました。しかし、なぜ二つのアミノ酸の違いで、XBB.1.5が流行するに至ったのかは不明でした。
まず、オミクロンXBB系統の詳細な配列・系統解析を行いました。オミクロンXBB.1.5は祖先株であるオミクロンXBB.1と比較して、ORF8タンパク質におけるナンセンス変異(終止コドンを挿入し、タンパク質を破壊する変異)とスパイクタンパク質におけるF486P変異をもっています。解析の結果、オミクロンXBB.1.5はまずナンセンス変異によりORF8タンパク質を欠失し、その後スパイクタンパク質においてF486P変異を獲得することで生じた変異株であることが明らかとなりました(図1)。
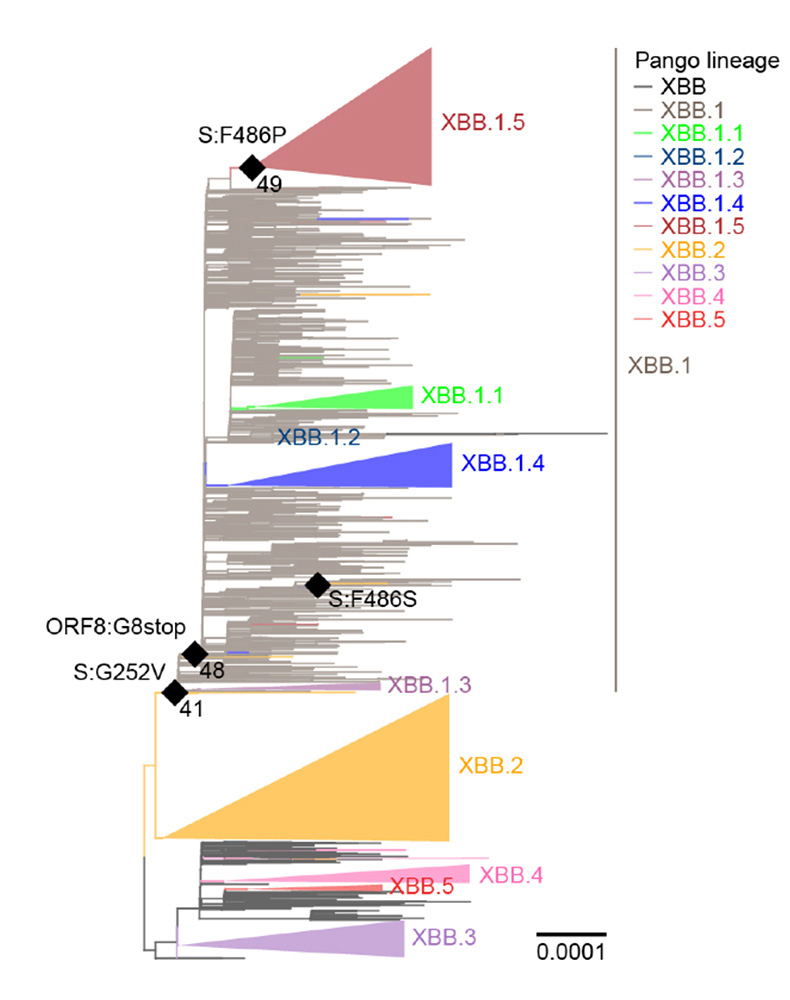
図1. オミクロンXBB系統の進化
オミクロンXBB.1.5は、XBB.1がORF8タンパク質におけるナンセンス変異(ORF8:Gstop)を獲得し、その後スパイクタンパク質におけるF486P変異(S:F486P)を獲得することで出現した。
また、オミクロンXBB.1.5をその親株であるXBB.1と比較することによって、そのウイルス性状の解明に取り組みました。シュードウイルスを用いた中和試験の結果、XBB1.5の液性免疫からの逃避能はXBB.1と同程度であることが明らかになりました(図2A)。また、クライオ電子顕微鏡を用いた解析ではXBB.1とXBB.1.5のスパイクタンパク質とSARS-CoV-2の感染受容体であるACE2との相互作用の違いは認めませんでした(図2B)。さらに、合胞体形成活性(図2C)、培養細胞およびオルガノイドでの増殖能(図2D)もXBB.1とXBB.1.5の間で大きな有意差を認めませんでした。生体での呼吸器系の環境を模倣できるマイクロ流体デバイスを駆使した実験の結果、オミクロンXBB.1.5の呼吸器上皮―血管内皮バリアの破壊能についてもXBB.1と同程度でした(図2E)。
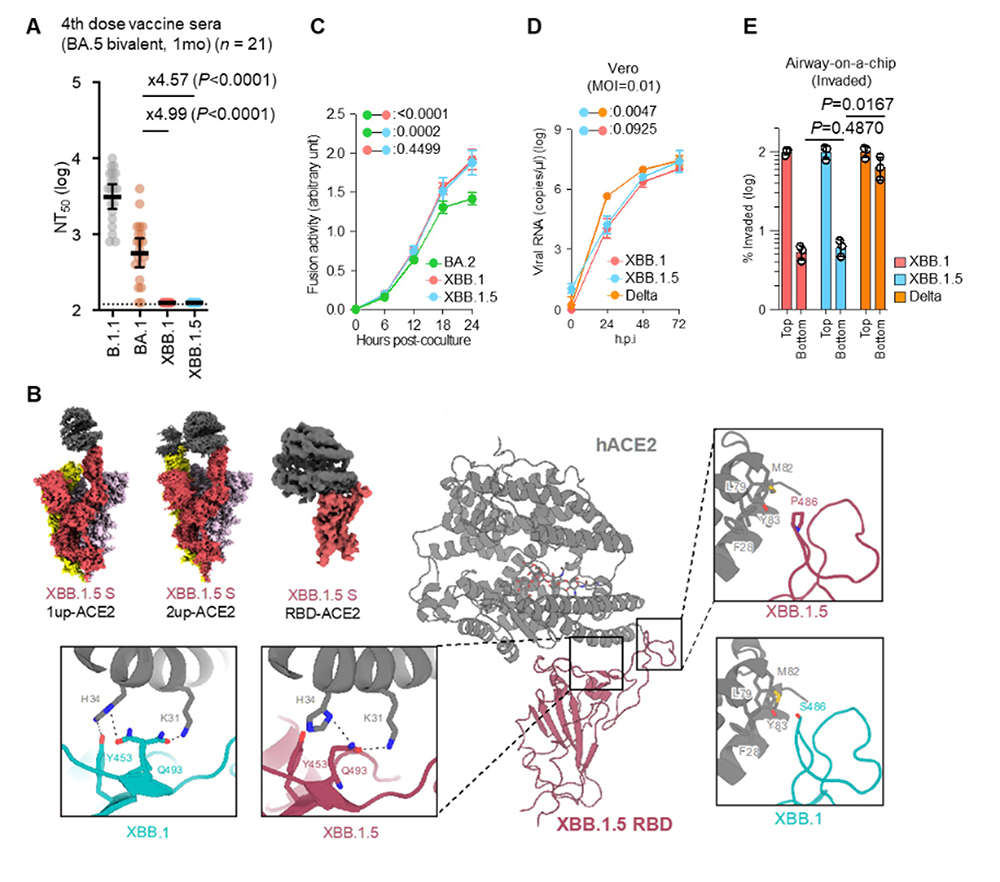
図2. In vitroにおけるオミクロンXBB.1.5の性状解析
A)シュードウイルスを用いた中和試験。XBB1.5の液性免疫からの逃避能はXBB.1と同程度であった。
B)XBB.1.5スパイクタンパク質とACE2受容体の複合体のクライオ電子顕微鏡構造、および、XBB.1における相互作用との比較。XBB.1.5とXBB.1の全体構造は似ているが細部に違いが認められる。
C)合胞体形成活性。
D)培養細胞およびオルガノイドでの増殖能試験。XBB.1とXBB.1.5の間で有意な差を認めなかった。
E)生体での呼吸器系の環境を模倣できるマイクロ流体デバイスを駆使した実験。オミクロンXBB.1.5の呼吸器上皮―血管内皮バリアの破壊能についてもXBB.1と同程度であった。
最後に、ハムスターモデルを用いた感染実験によりオミクロンXBB.1.5の病原性を評価しました。その結果、XBB.1.5の病原性はXBB.1よりも低いことがわかりました(図3A、B)。そこでウイルス弱毒化のメカニズムを解明するため、オルガノイドにおけるMHCクラスI分子発現の変化を調べました。すると、XBB.1.5はXBB.1と比較して、MHCクラスI分子発現の低下が抑えられていないことが判明しました(図3C)。さらに、それぞれの点変異をもつ組換えウイルスを作出し、病原性試験を行ったところ、ORF8の機能欠損による免疫抑制機構の低下がXBB.1.5の病原性に関与することを突き止めました(図3D)。
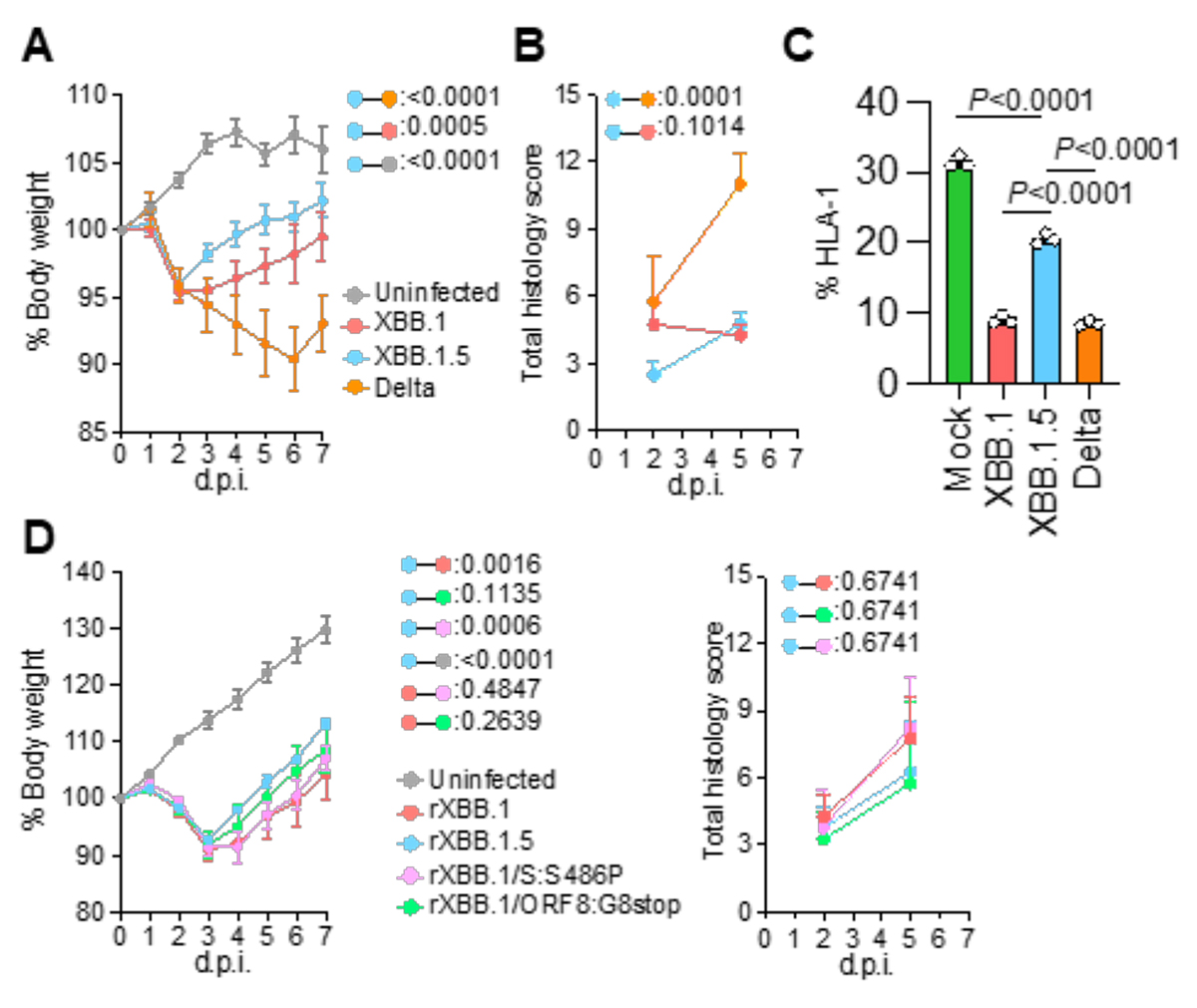
図3. ハムスターモデルにおけるオミクロンXBB.1.5およびORF8欠損体の性状解析。
A)ウイルス感染ハムスターの体重の推移。
B)ハムスター肺の組織病理学的障害スコア。値が高いほど組織障害の程度が強いことを示す。
C)ウイルスを感染させた肺オルガノイドにおけるMHCクラスI分子(HLA-1)の発現量。
D)オミクロンXBB.1のORF8欠損体(rXBB.1/ORF8:G8stop)を感染させたハムスターの体重推移および肺の組織病理学的障害スコア。
2024年2月現在、オミクロンXBB.1.5はさらに多様化し、その子孫であるHV.1が米国を中心に流行しています。一方、オミクロンBA.2から別に派生したBA.2.86とその子孫であるJN.1が世界的な感染拡大を引き起こしています。今後もオミクロン系統ウイルスの流行、性質、進化の継続的な監視が重要です。
G2P-Japanは、SARS-CoV-2の進化・流行動態を司る原理の解明に関する研究および出現が続くさまざまな変異株について、ウイルス学的特性の解析や中和抗体や治療薬への感受性の評価、病原性の研究に取り組んでいます。G2P-Japanでは今後もSARS-CoV-2の変異(Genotype)の早期捕捉と、その変異がヒトの免疫やウイルスの病原性・複製に与える影響(Phenotype)を解明するための研究を推進します。
- 論文名
Virological characteristics of the SARS-CoV-2 Omicron XBB.1.5 variant - ジャーナル名
Nature Communications - 著者
Tomokazu Tamura1,2,3,**, Takashi Irie4,**, Sayaka Deguchi5,**, Hisano Yajima6,**, Masumi Tsuda1,7,**, Hesham Nasser8,**, Keita Mizuma9,**, Arnon Plianchaisuk10,**, Saori Suzuki1,2,**, Keiya Uriu10, M. S. T, Monira Begum8, Ryo Shimizu8, Michael Jonathan8, Rigel Suzuki1,2, Takashi Kondo1, Hayato Ito1, Akifumi Kamiyama1, Kumiko Yoshimatsu11, Maya Shofa12, Rina Hashimoto5, Yuki Anraku13, Kanako Terakado Kimura6, Shunsuke Kita13, Jiei Sasaki6, Kaori Sasaki-Tabata14, Katsumi Maenaka13,14, Naganori Nao3,9, Lei Wang1,7, Yoshitaka Oda1, The Genotype to Phenotype Japan (G2P-Japan) Consortium, Terumasa Ikeda8, Akatsuki Saito12, Keita Matsuno3,9, Jumpei Ito10, Shinya Tanaka1,7,*, Kei Sato8,10,*, Takao Hashiguchi6,*, Kazuo Takayama5,*, Takasuke Fukuhara1,2,3,15,*
**:筆頭著者
* :責任著者 - 著者の所属機関
- 北海道大学大学院医学研究院・大学院医学院・医学部医学科
- 北海道大学創成研究機構ワクチン研究開発拠点
- 北海道大学 One Healthリサーチセンター
- 広島大学大学院医系科学研究科
- 京都大学iPS細胞研究所
- 京都大学医生物学研究所
- 北海道大学創成研究機構化学反応創成研究拠点
- ヒトレトロウイルス学共同研究センター 熊本大学キャンパス
- 北海道大学人獣共通感染症国際共同研究所
- 東京大学医科学研究所
- 北海道大学遺伝子病制御研究所
- 宮崎大学農学部獣医学科
- 北海道大学大学院薬学研究院
- 九州大学大学院薬学研究院
- 大阪大学微生物病研究所
本研究は、下記機関より支援を受けて実施されました。
- AMED 革新的先端研究開発支援事業(AMED-CREST)(JP21gm1610005、JP23gm1610008)
- 日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業(JP23fk0108617、JP22fk0108516、JP22fk0108511)
- AMED 先進的研究開発戦略センター(SCARDA)(HU-IVReD、JP223fa627005、JP223fa827001)
注1)研究コンソーシアム「The Genotype to Phenotype Japan (G2P-Japan)」
東京大学医科学研究所の佐藤佳教授が主宰する、若手研究者中心の研究コンソーシアム。日本国内のさまざまな専門性をもつ若手研究者が参画し、多角的アプローチからウイルスの性質の解明に取り組んでいる。
注2)オミクロン(B.1.1.529, BA系統)
新型コロナウイルスの流行拡大によって出現した、顕著な変異を有する「懸念すべき変異株(VOC:variant of concern)」の一つ。オミクロンBA.1、オミクロンBA.5、オミクロンBQ.1.1、オミクロンBA.2.75などが含まれる。
注3)スパイクタンパク質
新型コロナウイルスが細胞に感染する際に、細胞と結合するためのタンパク質。現在使用されているワクチンの標的となっている。
注4)ORF8タンパク質
新型コロナウイルスのアクセサリータンパク質の一つ。ORF8は、免疫機能に重要な役割をもつMHCクラスIタンパク質の働きを抑え、細胞障害性T細胞を介した免疫応答を損なう働きがあると報告されている。
注5)点変異
DNAあるいはRNAの特定の1塩基が別の塩基に置き換わる変異。
注6)中和試験
抗体や抗体を含む血清がウイルスを不活化(中和)する能力を定量するための実験。ウイルスを中和する能力のある抗体は中和抗体と呼ばれる。新型コロナウイルスの場合、中和抗体はスパイクタンパク質に結合することでスパイクタンパク質と感染受容体であるACE2との相互作用を抑制する場合が多い。
注7)ACE2
Angiotensin-Converting Enzyme 2(アンジオテンシン変換酵素2)の略称で、新型コロナウイルスが細胞に感染する際に受容体として機能する。
注8)合胞体形成活性
合胞体とは、新型コロナウイルスに感染した細胞が、スパイクタンパク質を細胞表面に発現し、周囲の細胞と融合することによって形成される大きな細胞塊のこと。合胞体形成活性とは、新型コロナウイルスのスパイクタンパク質を介して、合胞体を形成する能力のこと。
注9)MHCクラスI分子
主要組織適合遺伝子複合体(MHC)分子の主要な二つのクラスのうちの一つ。脊椎動物のすべての有核細胞の細胞表面に存在し、抗原提示に重要な役割を果たしている。
注10)組換えウイルス
遺伝子を任意に組換えたウイルス。法令遵守のもと、任意の変異をもつウイルスを人工的に作出し、性状解析やウイルス学研究に使用する。
注11)実効再生産数
特定の条件下において、1人のウイルス感染者が平均して何人の二次感染者を生み出せるかを表す尺度。本研究では変異株の流行拡大能力を比較する目的で使用している。






















