
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2024年5月7日
ヘパラン硫酸鎖が付加された次世代型合成細胞外マトリックスを用いて、高効率な骨格筋幹細胞の誘導を実現
ポイント
- 広くiPS細胞の培養などに使用されてきた合成細胞外マトリックス注1)であるラミニンE8フラグメント注2)に、ヘパラン硫酸鎖注3)が結合した次世代型合成細胞外マトリックスを開発した。
- iPS細胞の分化誘導に次世代型合成細胞外マトリックスを用いると、沿軸中胚葉注4)への分化誘導が強く促進される。
- 沿軸中胚葉への分化誘導効率が上昇した結果、骨格筋幹細胞注5)の分化誘導効率も従来の約2倍に上昇した。
- そのメカニズムとして、ヘパラン硫酸鎖が培地に含まれるbFGF注6)を捕捉してiPS細胞に効率よくシグナル伝達をすることが明らかとなった。
超明明 元特定研究員(当時:CiRA臨床応用研究部門、現:重慶医科大学基礎医学院・教授)、関口清俊 寄附研究部門教授(大阪大学蛋白質研究所)、櫻井英俊 准教授(CiRA臨床応用研究部門)らの研究グループは、ヘパラン硫酸鎖が結合した次世代型合成細胞外マトリックスを開発し、iPS細胞の分化誘導に用いることで、高効率に骨格筋幹細胞を分化誘導できることを見出しました。またそのメカニズムとして、ヘパラン硫酸鎖が培地に含まれる塩基性線維芽細胞成長因子(basic fibroblast growth factor, bFGF)を捕捉してiPS細胞に効率よくシグナル伝達をすることが明らかとなりました。この成果により、iPS細胞から骨格筋幹細胞への分化誘導を生体由来原材料を用いずに実施可能となり、筋ジストロフィーの再生医療の実現に寄与すると期待されます。
この研究成果は2024年4月29日にドイツ科学誌「Advanced Science」にオンライン公開されました。
筋ジストロフィーに対する再生医療の研究開発として、櫻井准教授らのグループはこれまでに、ヒトiPS細胞から高い再生能を持つ骨格筋幹細胞の誘導に成功しています(CiRAニュース2020年7月3日)。しかしこの報告で用いられた分化誘導方法は、臨床応用を目指すにあたって二つの問題点がありました。一つは誘導効率が低いことであり、実際に移植する量の骨格筋幹細胞を得るために、相当量の細胞を準備する必要があり、製造コストが懸念されます。もう一つは、培養ディッシュのコーティング剤に生体由来の細胞外マトリックスである「マトリゲル注7)」を使用していることであり、人に移植する細胞を製造するためには、生体材料由来ではなく合成タンパク質を使うことが望まれます。これらの問題点を解決するため、合成細胞外マトリックスの専門家である大阪大学蛋白質研究所の関口寄附研究部門教授との共同研究を開始し、今回の研究グループを形成しました。関口教授らは、これまで基底膜の細胞外マトリックスであるラミニンの細胞接着活性をほぼ100%保持した組換えラミニンE8フラグメントを開発し、この組換えフラグメントはiPS細胞の維持培養などに広く用いられています(CiRAニュース2014年1月8日)。関口教授らはさらに、マトリゲルの機能を模倣するため、パールカンという細胞外マトリックスのヘパラン硫酸鎖担持ドメインをラミニンE8フラグメントに連結した「次世代型ラミニンE8フラグメント」を開発し、今回の研究材料としてiPS細胞から骨格筋幹細胞への分化誘導に応用しました。
1. 次世代型ラミニンE8フラグメントは骨格筋幹細胞分化誘導効率を約2倍に高めた
研究グループでは、まず全ての種類のラミニンE8フラグメントと次世代型ラミニンE8フラグメントを用いて、骨格筋幹細胞分化誘導を実施し、中間段階の分化38日目で骨格筋細胞への分化誘導効率を評価しました(図1A)。すると従来のラミニンE8フラグメントでは全て骨格筋細胞への分化が見られないのに対し、次世代型ラミニンE8フラグメントでは全てがマトリゲル(MG)と同等かそれ以上の骨格筋細胞誘導能を持つことが分かりました(図1A)。その中でも次世代型ラミニン421E8フラグメント(p421)が統計学的有意に誘導効率を上昇させたことから、以降の実験ではp421をラミニン421E8フラグメント(LM421-E8)と比較して実験を進めました。骨格筋幹細胞のマーカーであるMYF5遺伝子が発現すると赤色蛍光を発するiPS細胞を用いて、骨格筋幹細胞への分化誘導を実施し、分化80日目で赤色蛍光を発する細胞(=骨格筋幹細胞)を計測しました。従来法のMGでは平均12%程度の誘導効率、LM421-E8では平均6%程度と半減したのに対し、p421では平均22%程度の誘導効率に上昇しました(図1B)。
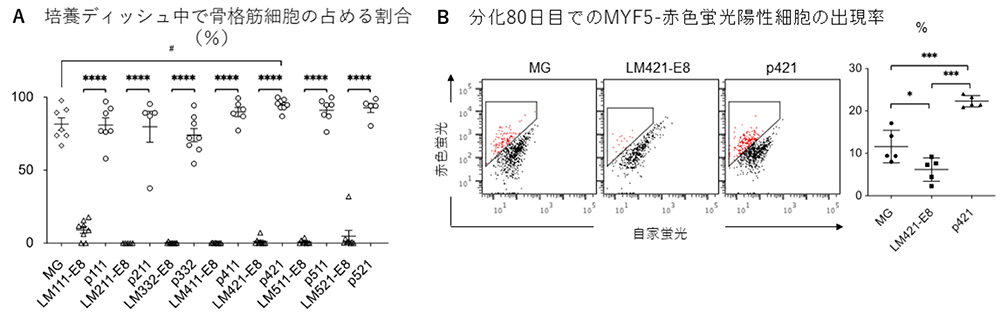
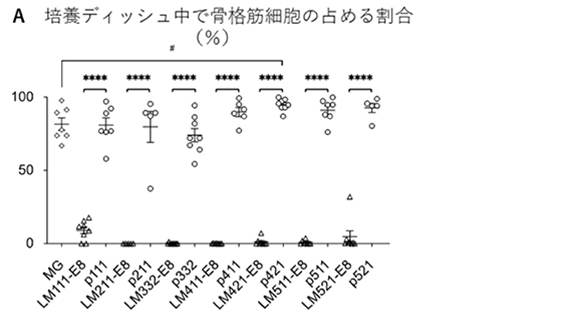
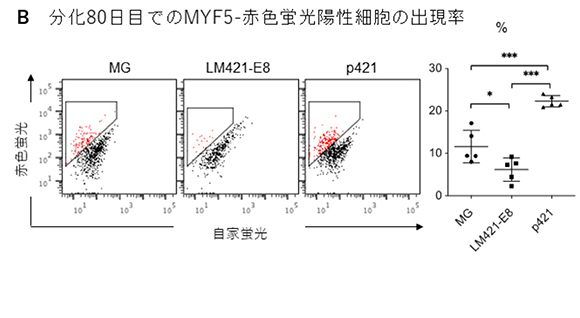
図1:次世代型ラミニンE8フラグメントを用いた骨格筋幹細胞誘導の従来法との比較
A:免疫染色法を用いて確認した分化38日後の骨格筋細胞の占める面積の割合。従来法のMGでは平均80%の誘導効率であるのに対し、既存のラミニンE8フラグメントではラミニン111からラミニン521に至るまで、ほとんど筋細胞へと分化しなかった。一方パールカンのヘパラン硫酸鎖担持ドメインを結合した次世代型ラミニンE8フラグメントでは、すべてのタイプで80~90%の誘導効率を誇り、中でもp421は95%近くと極めて高い骨格筋分化効率を示した。
B:骨格筋幹細胞の誘導効率の定量結果。骨格筋幹細胞のマーカーであるMYF5の発現に合わせて赤色蛍光が光るiPS細胞を用いて、骨格筋幹細胞への分化誘導を実施し、分化80日目で赤色蛍光の出現率をフローサイトメトリーで解析した。台形で囲まれた赤いドットが骨格筋幹細胞を表す。右図は5回の実験の平均値をグラフ化したもの。
2. 次世代型ラミニン421E8フラグメントは沿軸中胚葉分化誘導を促進する
次に、骨格筋幹細胞誘導効率の上昇が、どの時点で起きているかを検証しました。骨格筋幹細胞誘導の最初のステップは沿軸中胚葉の誘導であるので、初期中胚葉マーカーのBRACHYURY(T)および沿軸中胚葉マーカーのTBX6の発現を免疫染色で確認しました。分化2日目のTの発現はMGでは比較的均一に発現しており、LM421-E8では一部にしか発現していませんでした。p421ではMGに比べて輝度が高く発現していました(図2A)。分化4日目のTBX6の発現は、MGでは球形の細胞塊にはある程度発現しているものの、TBX6が発現していない細胞がその周囲に広がる傾向が観察されました。LM421-E8ではTと同じく、ごく一部の細胞のみで発現するにとどまりました。一方でp421では球状の細胞塊のみが特異的に誘導される傾向が確認され、ほとんどすべての細胞が陽性でした(図2B)。以上より、p421は分化のもっとも初期において沿軸中胚葉の誘導効率を上昇させていることが明らかとなりました。論文ではさらにその効果を生み出す時期が分化7日目までであることを見出しています。
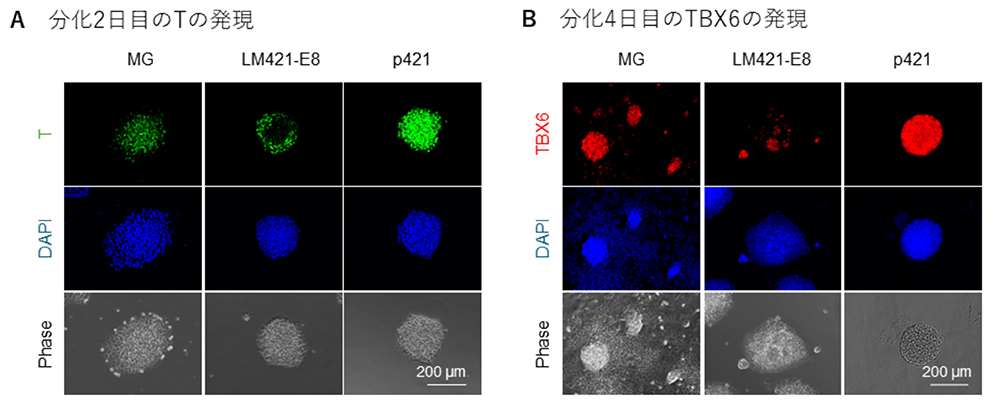
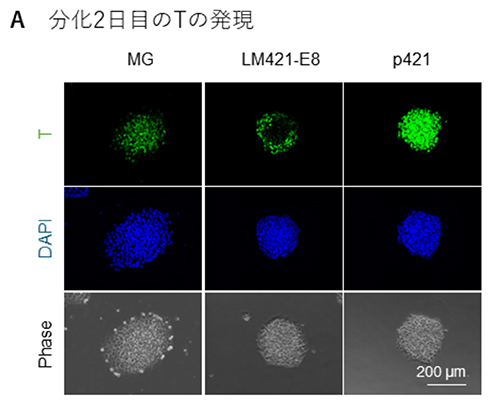
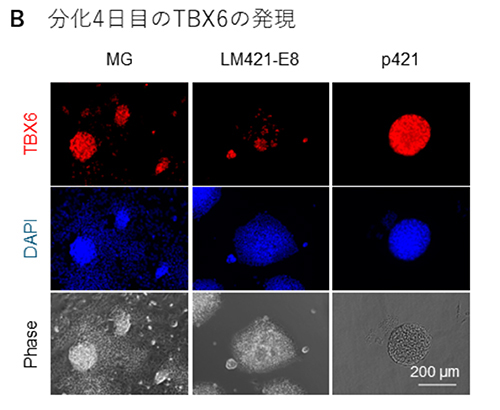
図2:中胚葉分化誘導の比較
A:分化2日目のTの免疫染色画像。緑がT、青は核染色。
B:分化4日目のTBX6の免疫染色画像。赤がTBX6、青は核染色。
3. p421による中胚葉分化促進には線維芽細胞成長因子(FGF)シグナリングが重要である
続いて、p421の持つ中胚葉分化促進効果が、どのようなメカニズムで起きるのかを検証しました。まずヘパラン硫酸の拮抗薬であるSurfenを分化誘導の開始時および分化2日目から添加すると(図3A)、MGコート上でもp421コート上でも中胚葉分化マーカーであるTおよびTBX6の発現がそれぞれ低下しました(図3B)。このことから、ヘパラン硫酸が中胚葉分化を促進する機能を持っていることが分かりました。
ヘパラン硫酸鎖は、成長因子と呼ばれるホルモンの一種を捕捉してそのシグナルを細胞に効率よく伝える役割を担っています。そこで、次世代型ラミニンE8フラグメントがおそらくは何らかの成長因子を捕捉して効果を発揮しているのではないかと仮説を立てました。そこでSurfen添加と同じタイミングでさまざまな成長因子の阻害剤を添加したところ、FGF受容体の阻害剤は全て強力にT発現についてもTBX6発現についても抑制し、中胚葉誘導が阻害されていることが分かりました(図3C)。これらの結果から、p421に結合しているヘパラン硫酸鎖によりFGFシグナル伝達がFGF受容体に効率よく伝わることが、中胚葉分化促進効果のメカニズムであることが明らかとなりました。
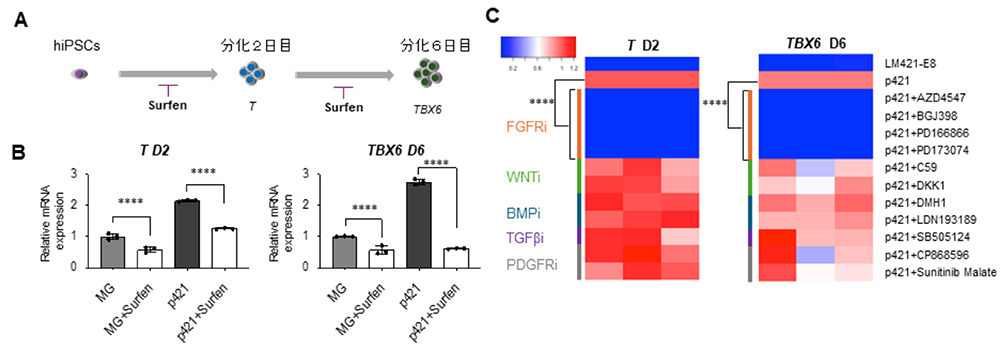
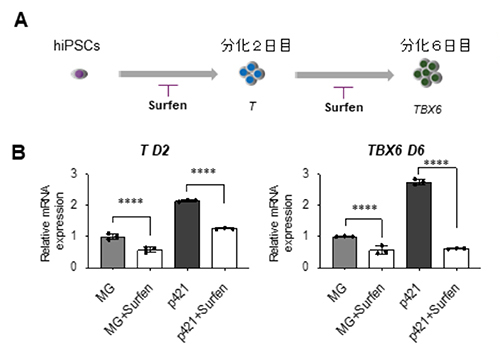
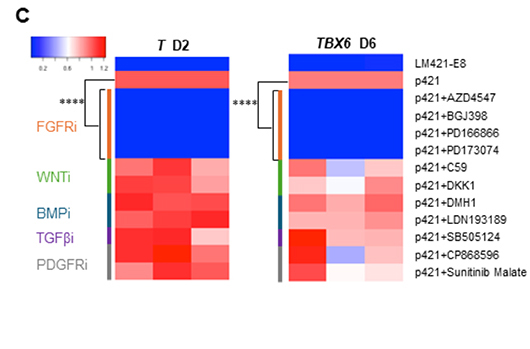
図3:ヘパラン硫酸の持つ中胚葉分化促進効果のメカニズム解析
A:実験の模式図。分化初日から2日目までSurfenを添加しTの発現を解析、あるいは分化2日目から6日目までSurfenを添加しTBX6の発現を解析した。
B:Aの実験結果。MGコート上でもp421コート上でも、Surfenによるヘパラン硫酸の阻害により、2日目でのT(左)および6日目でのTBX6(右)の発現が抑制される。
C:各種成長因子の阻害剤を添加した実験結果をヒートマップで表した図。FGF受容体阻害剤(FGFRi)は、強力に中胚葉分化マーカーの発現を抑制している(赤は発現が高く、青は発現が低い)。
4. 分化誘導開始前に使用しているiPS細胞維持培地中のbGFGがFGFシグナルを伝えていた
3. の結果を受けて、研究グループは悩みました。というのも分化誘導培地にはFGFは添加しておらず、どこからFGFシグナルが伝えられているのかが分からなかったからです。しかし、よく考えると、分化誘導開始前に使用しているiPS細胞維持培地であるAK02Nには100 ng/mlという比較的高用量のbFGFが添加されており、このbFGFがヘパラン硫酸鎖に捕捉されており、分化誘導開始以後にも作用しているのではないかと仮説を立てました。そこで、まずAK02Nに含まれるbFGFの量を段階的に減らした実験をしました(図4A上段)。するとbFGFの濃度を5 ng/mlまで減らした際に、分化2日目のTの発現量が大きく低下し(図4A下段)、やはり分化誘導開始前のbFGFが、その後の中胚葉分化促進効果に影響を与えることが分かりました。つぎに、その効果はFGF受容体を介するものかどうかを検証するため、3. で使用した成長因子阻害剤を分化誘導1日前から開始時まで添加して、分化2日目のTの発現を解析しました(図4B上段)。結果は分化誘導後の際と同じく、FGF受容体阻害剤を阻害した際に強力にTの発現が抑制され、やはり分化誘導開始前にbFGFからFGFシグナルが伝えられていることが重要であることが分かり、そのためにはヘパラン硫酸鎖によるbFGFの捕捉が機能しているであろうと考えられました。
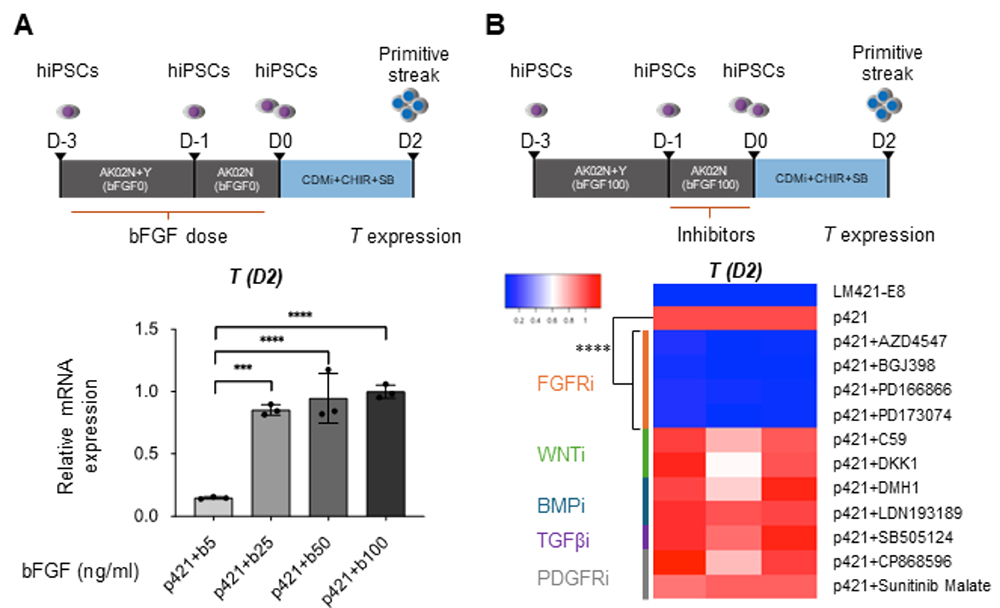
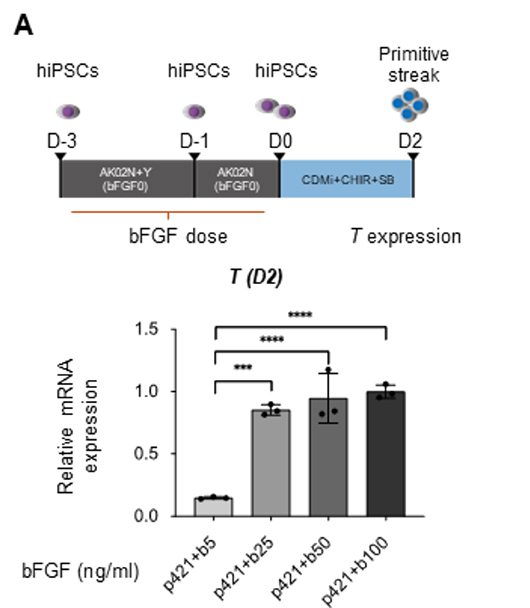
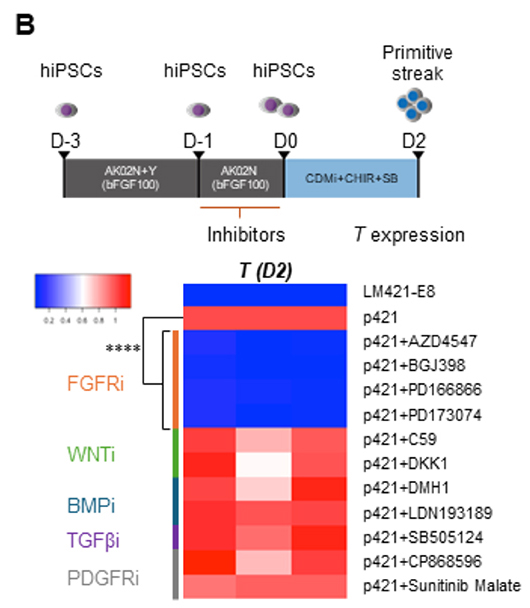
図4:分化誘導開始前のFGFシグナリングの重要性の検証
A:iPS細胞維持培地に含まれるbFGFの量を減らした際の、中胚葉誘導効率の変化を見た実験。下段は分化2日目のTの発現解析。bFGFを5 ng/ml(+b5と表記)まで減らすと、Tの発現が大きく下がる。
B:分化誘導1日前から分化誘導開始時まで成長因子阻害剤を添加した際の、中胚葉誘導効率の変化を見た実験。下段は分化2日目のTの発現解析。FGF受容体阻害剤を添加すると、Tの発現が強力に抑制される。
5. FGFシグナルにより高効率に中胚葉分化誘導するには、ヘパラン硫酸鎖が適切な位置にあることが重要
分化誘導開始前のbFGFの添加が重要であることが分かりましたので、ではp421を用いなくても、単純にbFGFを過剰量添加すればヘパラン硫酸鎖を持たないLM421-E8でも、中胚葉分化促進効果を見出せるのではないかと考え、bFGFの大量添加実験を行いました。LM421-E8でコートしたプレート上で分化誘導を実施し、分化誘導3日前から開始時まで100, 500, 1000 ng/mlという大量のbFGFを添加しました。しかし、大量のbGFG添加によりT発現量は上昇したものの、p421を用いた条件には遠く及びませんでした(図5A)。やはりヘパラン硫酸鎖が必要であるということが分かったので、次にヘパラン硫酸鎖を結合する位置によって違いがあるのか、どこに付けても効果があるのかを検証しました。通常のp421ではヘパラン硫酸鎖はラミニンα鎖のC末端に連結されていますが、ヘパラン硫酸鎖をβ鎖のN末端あるいはγ鎖のN末端に連結した次世代型ラミニンE8フラグメントを作製し(それぞれnb421あるいはng421と表記)、中胚葉への分化誘導効率を比較検討しました。その結果、C末端に結合させた通常のp421が最も効果が高いことが明らかとなりました。C末端側は、細胞が実際に接着する場でもあり、接着した細胞膜表面に近い位置にヘパラン硫酸鎖が存在することで、効率よくFGFシグナルを伝えられている可能性が示唆されました。
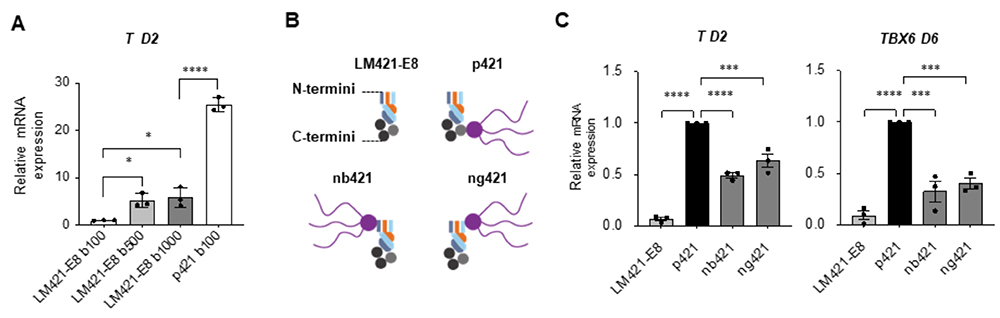
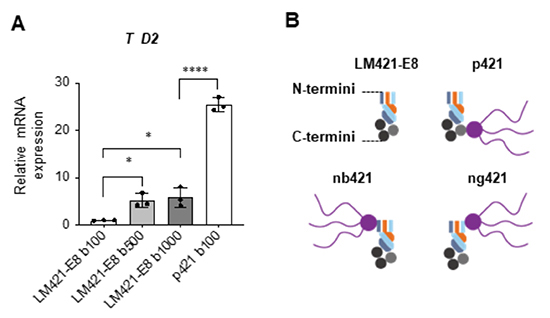
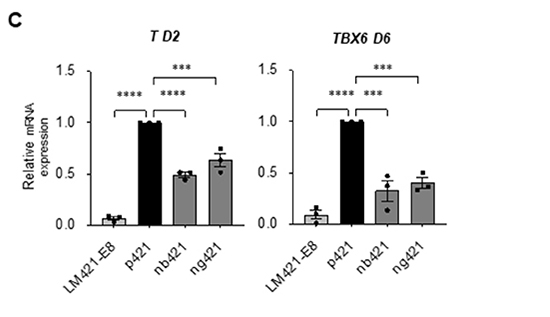
図5:ヘパラン硫酸鎖の結合部位の検証
A:LM421-E8コート上で、iPS細胞維持培地に含まれるbFGFの量を過剰量まで増加させた際の中胚葉誘導効率の変化を見た実験。分化2日目のTの発現は、通常のbFGF濃度である100 ng/mlから500 ng/mlに増加すると5倍程度増加するが、過剰量と考えられる1000 ng/mlまで増加させても大きな変化はなく、p421には及ばない。
B:LM421-E8フラグメントと、3種類の次世代型ラミニンE8フラグメントの模式図。通常のp421はC末端側に結合されているが、N末端側に結合させたnb421tおよびng421を合成した。
C:上記フラグメントでコートした際の中胚葉分化誘導効率の比較。TやTBX6の発現は通常のp421で最も高く、N末端側にヘパラン硫酸鎖を結合させたものは、させていないLM421-E8フラグメントよりは高い発現を呈するが、p421には及ばない。
本研究では、次世代型ラミニンE8フラグメントであるp421を用いることで、ヒトiPS細胞からの骨格筋幹細胞分化誘導効率を上げることに成功しました。これまで用いていたネズミ腫瘍由来の「マトリゲル」は、再生医療の臨床応用には適さないため、ヒト由来の組換えタンパク質であるp421の使用により高効率で骨格筋幹細胞を分化誘導できることは、ヒトに投与可能な骨格筋幹細胞分化誘導プロトコール確立に寄与します。またヘパラン硫酸鎖により初期の中胚葉への誘導分化効率を上昇させることが、最終的な骨格筋幹細胞分化誘導効率を上げることが分かり、今後の分化誘導プロトコールの安定化や改良に役立つ知見を多く得ることができました。
またiPS細胞由来骨格筋幹細胞は患者さん由来のヒトiPS細胞を用いることで、病態研究や創薬スクリーニングにも応用可能です(CiRAニュース2023年1月11日)。効率の良い分化誘導法により筋疾患の病態解明や創薬研究にも貢献することが期待されます。
- 論文名
Heparan Sulfate Chain-conjugated Laminin-E8 Fragments Advance Paraxial Mesodermal Differentiation Followed by High Myogenic Induction from hiPSCs - ジャーナル名
Advanced Science - 著者
Mingming Zhao1,4*, Yukimasa Taniguchi2, Chisei Shimono2, Tatsuya Jonouchi1, Yushen Cheng3, Yasuhiro Shimizu2, Minas Nalbandian1, Takuya Yamamoto3, Masato Nakagawa3, Kiyotoshi Sekiguchi2*, and Hidetoshi Sakurai1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)臨床応用研究部門
- 大阪大学蛋白質研究所 マトリクソーム科学(ニッピ)寄附研究部門
- 京都大学iPS細胞研究所(CiRA)未来生命科学開拓部門
- 重慶医科大学基礎医学院 メディカルエピジェネティクスセンター
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(「次世代型マトリックスによる高効率骨格筋幹細胞分化誘導法の開発」、「再生医療用iPS細胞ストック開発拠点」)
- 日本学術振興会(JSPS)科研費(17K13014, 19K20271, 21K08528)
- 文部科学省(MEXT)科研費 学術変革領域研究A(23721401)
- 重慶医科大学プログラム(W0144)
注1)細胞外マトリックス
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカン、ラミニンなど)の集合体。骨・軟骨、歯、皮膚などに多く含まれている。細胞の足場となり、細胞の増殖や分化の制御にも関わる。
注2)ラミニンE8フラグメント
細胞外マトリックスの一つで、基底膜を構成するラミニンの細胞接着活性を保持した組換えタンパク質。iPS細胞を始め細胞を培養する際に、細胞をディッシュと接着するための成分として広く使われている。
注3)ヘパラン硫酸鎖
細胞表面に存在する糖鎖で、細胞の機能を調節する役割を果たす。特にbFGF(塩基性線維芽細胞成長因子)のシグナル伝達に関与し、iPS細胞の分化誘導に影響を与える。
注4)沿軸中胚葉
脊椎動物の個体発生の一時期に現れる細胞集団で、体を支持するような組織(筋肉や骨、軟骨、真皮など)を生み出す。
注5)骨格筋幹細胞
骨格筋が損傷したとき、損傷部を修復するために骨格筋系の細胞に分化する幹細胞。
注6)bFGF
塩基性線維芽細胞成長因子(basic fibroblast growth factor)。多様な作用を持つ小型のタンパク質。細胞の表面にある線維芽細胞増殖因子受容体(FGFR)と結合して効果を発揮する。
注7)マトリゲル
マウスの肉腫細胞から抽出した細胞外マトリックス。動物由来の様々な成分を含む。






















