
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2024年9月30日
ヒトiPS細胞由来大腸オルガノイドを用いた潰瘍性大腸炎モデルの開発と応用
ポイント
- ヒトiPS細胞から大腸上皮細胞および間質細胞を含む大腸オルガノイドを作製した。
- 複数種の炎症性サイトカインを大腸オルガノイドに作用させ、潰瘍性大腸炎の病態を再現した。
- 本モデルを用いて、潰瘍性大腸炎に対する治療薬の有効性を評価した。
横井歩希大学院生(CiRA増殖分化機構研究部門)、高山和雄講師(CiRA同部門)らの研究グループは、ヒトiPS細胞から作製した大腸オルガノイド注1)に、炎症性腸疾患(IBD)の病態進行と関連が示唆されるサイトカイン注2)を作用させることで、IBDのサブタイプの一つである潰瘍性大腸炎(UC)モデルを開発することに成功しました。
IBDとは腸に慢性的な炎症が生じる疾患です。患者さんの数は増加傾向にあり、より効果的な治療薬の開発が求められています。研究グループは、ヒトiPS細胞から作製した大腸オルガノイドにIBD患者さんの血清中で高い濃度の炎症性サイトカインを作用させることで、IBDの病態再現を試みました。作製した大腸オルガノイドは、大腸上皮細胞だけでなく、間質細胞や血管内皮細胞などの非上皮細胞を含む多様な細胞から構成されていました。炎症性サイトカインの作用により、上皮細胞障害、ならびに、間質細胞や血管内皮細胞における炎症応答が引き起こされました。IBD患者さんの組織との比較により、本モデルはIBDのサブタイプの一つであるUC患者さんの大腸と似た特徴を持つことが分かりました。本モデルにUCの治療薬を作用させたところ、炎症応答や上皮細胞障害が抑制され、治療効果が確認されました。本モデルはUCの発症メカニズムの解明や創薬研究への応用が期待されます。
この研究成果は米国東部時間9月26日に「iScience」で公開されました。
炎症性腸疾患(IBD)とは腸に慢性的な炎症が生じる疾患であり、下痢や腹痛が主な症状です。近年の研究により遺伝的背景や環境要因、腸内細菌叢の乱れなどが発症に関与することが明らかになってきましたが、発症原因は未だ十分には解明されていません。既存のIBD治療薬は症状を一時的に緩和するために使用されており、根治療法の開発が求められています。そのためIBDの病態研究および創薬研究に使用できるヒトモデルの開発が必要です。
ヒトの大腸は上皮細胞や間質細胞など多種類の細胞から構成されています。IBD患者さんの大腸では、それらの細胞が過剰に分泌された炎症性サイトカインに応答し、相互作用することで、病態が進行します。従来の大腸モデル、例えば結腸癌由来細胞株(Caco-2細胞等)や生検由来腸管オルガノイドなどは、主に上皮細胞から構成されており、間質細胞などの非上皮細胞をほとんど含まないため、病態を正確に再現することが困難です。
ヒトiPS細胞は内胚葉細胞や中胚葉細胞へと分化できるため、研究グループはヒトiPS細胞を用いることで、内胚葉由来の上皮細胞だけでなく、中胚葉由来の間質細胞などを含んだ大腸モデルを開発できると考えました。本研究では、ヒトiPS細胞から作製した大腸オルガノイドに、IBDの病態進行に関連する炎症性サイトカインを作用させることで、その病態再現を試みました。
1. 上皮細胞や間質細胞を含む大腸オルガノイドの作製
ヒトiPS細胞を大腸オルガノイドへと分化誘導しました(図1A)。分化誘導8日目に細胞をゲル中に包埋し、三次元的なオルガノイドを作製しました。分化誘導13日目にオルガノイドをクランプ状に破砕し、ウェルプレート上に再播種しました。作製したヒトiPS細胞由来大腸オルガノイドのシングルセルRNA-seq解析注3)により、腸管上皮細胞や間質細胞などの大腸を構成する多様な細胞が含まれていることが分かりました(図1B)。
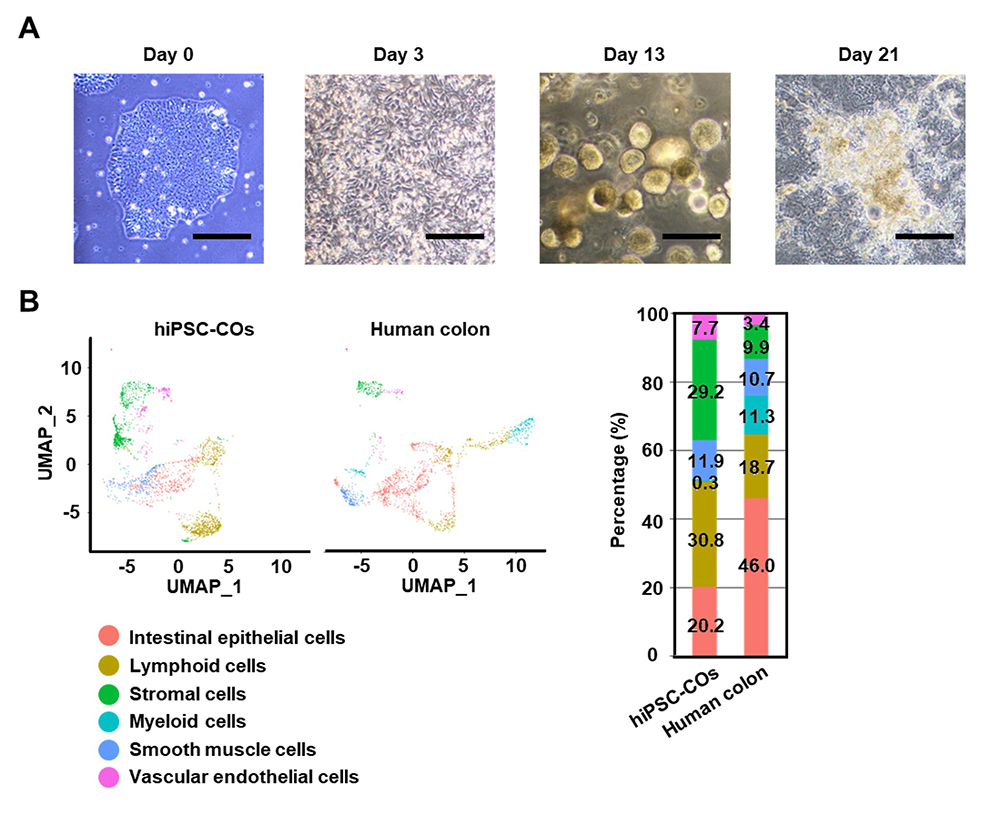
図1 上皮細胞や間質細胞を含むヒトiPS細胞由来大腸オルガノイドの作製
(A)分化誘導後0、3、13、21日目におけるヒトiPS細胞由来大腸オルガノイドの位相差画像。
(B)ヒトiPS細胞由来大腸オルガノイド(hiPSC-COs)及びヒト生体大腸(Human colon)におけるシングルセルRNA-seq解析。
2. 3種の炎症性サイトカインが大腸オルガノイドに及ぼす影響の評価
IBD患者さんの血清中に高濃度で存在する炎症性サイトカインTNF-α、IFN-γ及びIL-1β(3CK)を、ヒトiPS細胞由来大腸オルガノイドに作用させることで、IBD患者さんでみられる病態の再現を試みました(図2A)。3CKを作用させたところ、IL-8などIBD患者さんの大腸で発現が高い炎症性サイトカインの産生量が増加しました(図2B)。タイトジャンクション注4)の構成分子であるZO-1の免疫染色の結果、3CK作用により細胞が膨張し、ZO-1の局在が変化しました(図2C)。また、大腸オルガノイドの経上皮電気抵抗 (TEER) 注5)を測定したところ、3CKの作用によりTEERが減少したことから、上皮バリア機能が低下することが示唆されました(図2D)。さらに、3CKの作用により、大腸上皮細胞のマーカータンパク質であるVillinの発現量が減少しました(図2E)。以上の結果より、3CKを作用させた大腸オルガノイドでは炎症応答及び上皮細胞障害が生じていることが示唆されました。
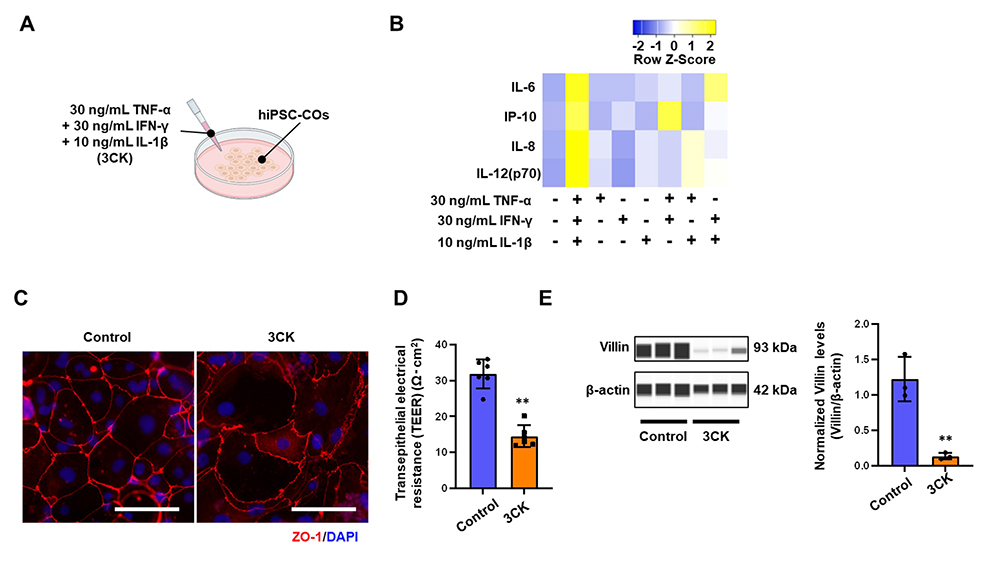
図2 3CK作用が大腸オルガノイドに及ぼす影響の評価
(A)ヒトiPS細胞由来大腸オルガノイドに30ng/mL TNF-α、30ng/mL IFN-γ及び10ng/mL IL-1β(3CK)を作用した。
(B)サイトカインを作用させたヒトiPS細胞由来大腸オルガノイドの培養上清において、炎症性サイトカインの産生量を計測した。
(C)3CKを作用させた大腸オルガノイドを用いて蛍光染色を行った。ZO-1: タイトジャンクションマーカー(赤)、DAPI: 細胞核(青)。
(D)3CKを作用させた大腸オルガノイドのTEERを計測し、上皮バリア機能の評価を行った。
(E)3CKを作用させた大腸オルガノイドにおけるVillinのタンパク質量を解析した。
3. シングルセルレベルでの炎症応答の解析
3CKを作用させた大腸オルガノイドを用いてシングルセルRNA-seq解析を実施し、各細胞種における炎症性サイトカインの遺伝子発現を調べました(図3)。3CKを作用させた大腸オルガノイドでは間質細胞と血管内皮細胞において炎症性サイトカインの遺伝子発現量が高くなっており、これら二種類の細胞が主な炎症性サイトカインの産生源であることが示唆されました。
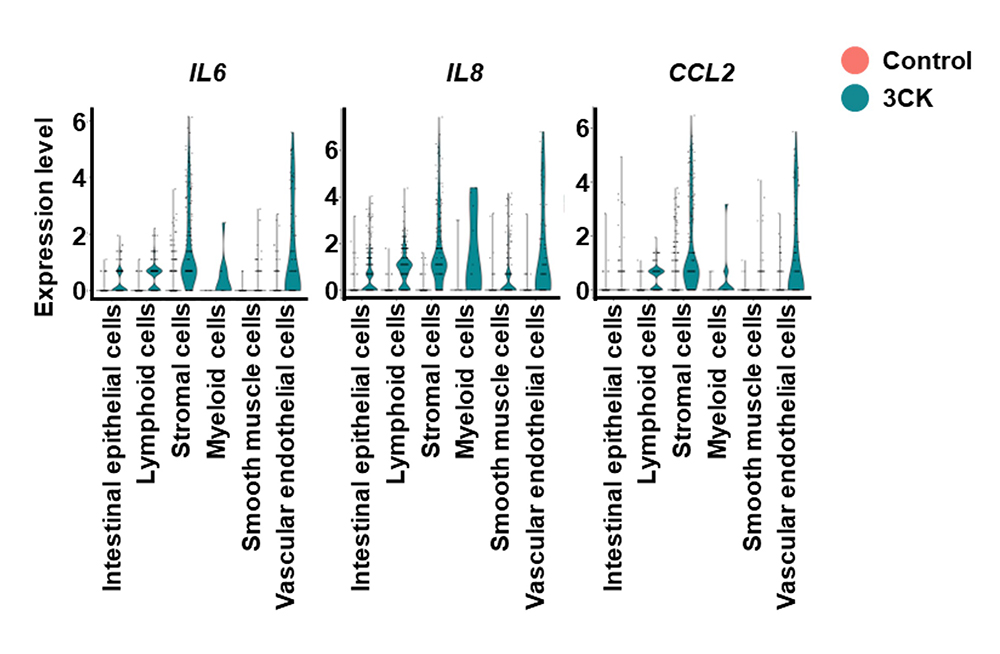
図3 シングルセルレベルでの炎症応答の解析
3CKを作用させた大腸オルガノイドを用いてシングルセルRNA-seq解析を行い、各細胞種における炎症性サイトカインの遺伝子発現量を調べた。
4. 3CKを作用させた大腸オルガノイドとUC大腸の比較解析
3CKを作用させた大腸オルガノイドとIBDのサブタイプの一つであるUC患者さんの大腸の遺伝子発現プロファイルを比較しました。GOエンリッチメント解析注6)の結果、大腸オルガノイドの間質細胞において、3CK作用によって炎症応答や自然免疫応答に関する遺伝子群の発現が上昇していました(図4A)。UC患者さんの大腸の間質細胞においても、健常な方の大腸の間質細胞と比較して、炎症応答や自然免疫応答に関する遺伝子群の発現が上昇していました(図4B)。これらの結果より、3CKを作用した大腸オルガノイドの間質細胞における炎症応答は、UC患者さんの大腸に類似した応答を再現していることが示唆されました。
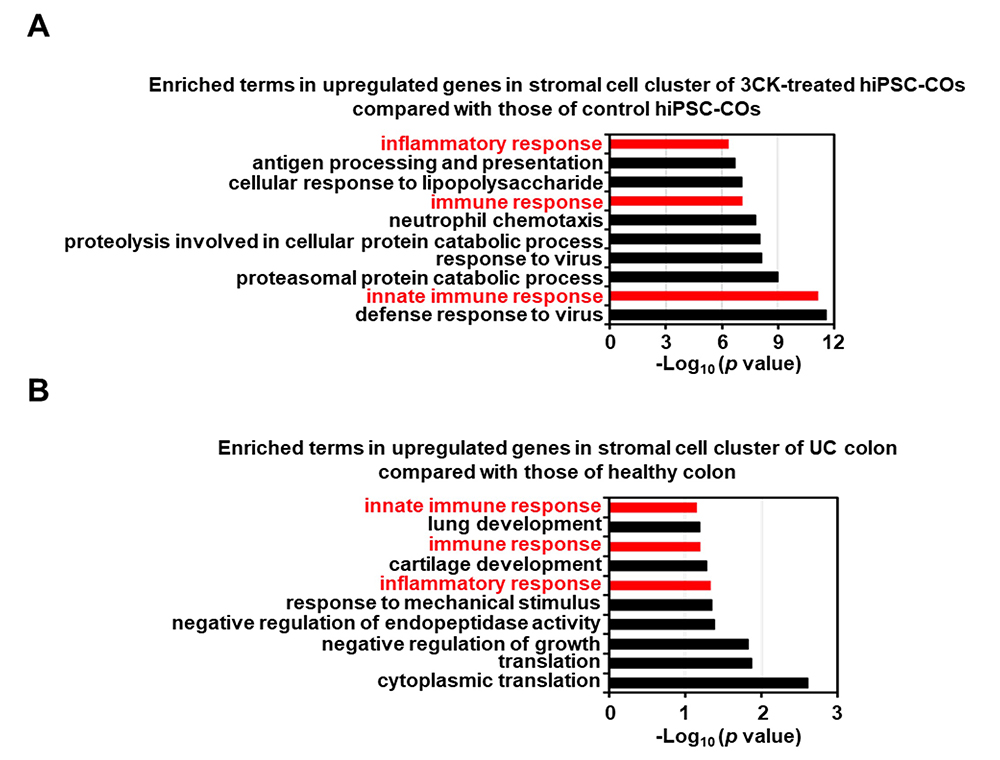
図4 3CKを作用した大腸オルガノイドと潰瘍性大腸炎患者さんの大腸の比較解析
(A)ヒトiPS細胞由来大腸オルガノイドの間質細胞において、3CKの作用により発現量が増加した遺伝子群のGOエンリッチメント解析を行った。
(B)UC患者さんの大腸の間質細胞において、健常な方の大腸の間質細胞より発現量が高かった遺伝子群のGOエンリッチメント解析を行った。
5. 大腸オルガノイドを用いたUC治療薬の評価
開発したUCモデルを用いて、UCの治療薬であるトファシチニブ注7)の薬効を評価しました。3CKの作用により上昇した炎症性サイトカインの産生量は、トファシチニブの作用により抑制されました(図5A)。3CKの作用により減少した大腸上皮細胞マーカーの遺伝子発現量は、トファシチニブの作用により回復しました(図5B)。これらの結果より、本モデルはトファシチニブの治療効果を評価でき、UCの創薬研究に使用できる可能性が示唆されました。
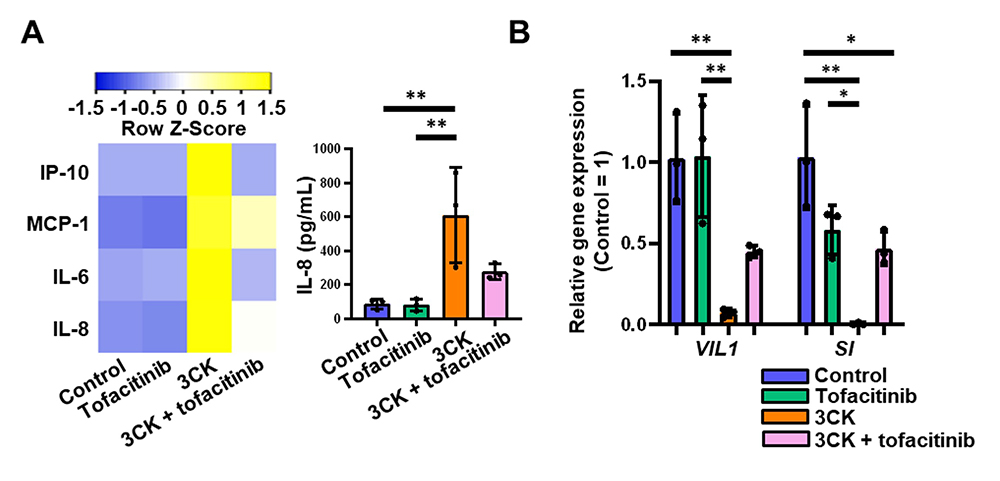
図5 大腸オルガノイドを用いたUC既存薬の評価
(A)3CK及びトファシチニブを作用した大腸オルガノイドの培養上清中に含まれる炎症性サイトカインの濃度を測定した。
(B)3CK及びトファシチニブを作用した大腸オルガノイドにおける大腸上皮細胞マーカー(VIL1、SI)の遺伝子発現量を解析した。
本研究では、ヒトiPS細胞を用いることで上皮細胞だけでなく非上皮細胞を含んだ大腸オルガノイドを開発しました。ヒトiPS細胞由来大腸オルガノイドを用いることで、上皮細胞の障害や間質細胞における炎症応答を再現したUCモデルを構築しました。本モデルを用いてUC治療薬の薬効を評価することができました。開発したUCモデルが、疾患原因の究明や新規治療薬開発に貢献することを期待しています。
- 論文名
Establishment of an ulcerative colitis model using colon organoids derived from human induced pluripotent stem cells - ジャーナル名
iScience - 著者
Fuki Yokoi1,2, Sayaka Deguchi1, Yukio Watanabe1, Kazuo Takayama1,3*
* 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学 大学院医学研究科
- 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)
本研究は、下記機関より支援を受けて実施されました。
- 科学技術振興機構(JST) ACT-X(JPMJAX222A)
-
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究中核拠点(JP23bm1323001)
- 革新的先端研究開発支援事業(CREST)
「仮想人体モデルを基盤とした感染症創薬プラットホームの構築」(JP21gm1610005) - iPS細胞研究基金
注1)オルガノイド
自己複製能及び分化能を持つ幹細胞を三次元的に培養し、自己組織化させた臓器様モデル。
注2)サイトカイン
細胞から分泌されるタンパク質のことであり、細胞同士の情報伝達に使われている。免疫や炎症に関連したものが多い。
注3)シングルセルRNA-seq解析
発現する遺伝子の種類と発現量を一細胞ごとに網羅的に調べる解析手法。
注4)タイトジャンクション
隣り合う上皮細胞同士を密接に繋ぐ構造のこと。細胞同士の隙間を最小限にすることで異物が体内へと侵入することを防ぐ。
注5)経上皮電気抵抗(TEER)
細胞層に交流電圧を加えて得られる抵抗値のこと。上皮バリア機能を評価する指標として用いられる。上皮細胞同士が密接に隣合いバリア機能が正常である場合、イオンは細胞の間を通り抜けづらくなるためTEER値は高くなる。一方、バリア機能が失われると、イオンは細胞の間を透過できるためTEER値は低くなる。
注6)GOエンリッチメント解析
特定の遺伝子群にどのような機能に関与する遺伝子が多く含まれているかを調べる解析手法。
注7)トファシチニブ
UCの治療に使用される低分子化合物。ヤヌスキナーゼ(JAK)の働きを阻害することで、炎症を抑制することができる。






















