
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年4月3日
慢性腎臓病(CKD)に対する細胞治療の効果をマウスで確認 ―数年以内の臨床試験開始を目指す―
ポイント
- ヒトiPS細胞から作製した腎前駆細胞(ネフロン前駆細胞)注1)を効率よく増やす培養方法を開発した。
- 移植に適した腎前駆細胞の純化に有用な細胞膜タンパク質を同定した。
- 慢性腎臓病(chronic kidney disease; CKD)注2)のモデルマウスにiPS細胞由来腎前駆細胞を移植すると、腎機能の低下や線維化注3)および老化の進行が抑制された。
- 移植したiPS細胞由来腎前駆細胞は、血管内皮増殖因子A(vascular endothelial growth factor A; VEGF-A)注4)を含むさまざまな因子を分泌することで、腎障害を軽減する作用があることを見出した。
荒岡利和講師、豊原光佑研究生、長船健二教授(CiRA増殖分化機構研究部門)らの研究グループは、iPS細胞から作製した腎前駆細胞(ネフロン前駆細胞)を慢性腎臓病モデルマウスに移植すると、腎機能の低下や線維化の進行が抑制されることを示しました。
慢性腎臓病は、有効な治療法が少なく、病状が進行し末期腎不全になると人工透析が必要となります。研究グループは、これまでにiPS細胞から腎臓の細胞のもととなる腎前駆細胞を作製し、慢性腎臓病に対する細胞移植治療の実現に必要な研究を続けてきました。しかし、開発した技術を臨床で使用できるようにするためには、治療効果が期待できる品質の高いiPS細胞由来腎前駆細胞を大量に作製する技術が必要でした。また、これまで、慢性腎臓病の状態を再現できる実験動物が存在せず課題となっていました。
本研究では、iPS細胞由来腎前駆細胞を効率よく増やす培養方法の開発と移植に適した腎前駆細胞を純化できる細胞表面マーカーの同定、慢性腎臓病の症状を再現したモデルマウス(慢性腎臓病マウス)の作製、そして慢性腎臓病マウスへの細胞移植の効果の検証を行いました。臨床レベルでの使用を想定した方法で作製したiPS細胞由来の腎前駆細胞を慢性腎臓病マウスに移植したところ、治療効果が認められました。これは、慢性腎臓病に対するiPS細胞由来腎前駆細胞を用いた治療の実現に向けた重要な研究成果と位置づけられます。
また、移植したiPS細胞由来腎前駆細胞がどのように移植したマウス体内で作用したのかを解析しました。その結果、血管内皮増殖因子A(vascular endothelial growth factor A; VEGF-A)を含む、移植した細胞から分泌される複数の因子が腎機能の低下や線維化および老化の進行を抑える効果をもつことがわかりました。今後、さらに研究を進めていくことで、慢性腎臓病に対する細胞療法の開発に加え、急性腎障害(acute kidney injury; AKI)注5)など細胞治療が困難な腎疾患にも役立つ、腎機能の回復のための基盤となる新たな知見が得られる可能性があります。
この研究成果は2025年4月2日(米国時間)に、国際科学誌「Science Translational Medicine」でオンライン公開されました。
慢性腎臓病は、腎障害の症状や腎機能の低下が慢性的に続く状態で、人工透析や腎移植を受けなければ生命の維持が困難になる末期腎不全へとつながります。日本には、慢性腎臓病の患者さんが約2,000万人いると推計されており、人工透析を受ける患者さんも毎年増え続けています。末期腎不全の患者さんのQOL(クオリティ・オブ・ライフ:生活の質)を改善するとともに、透析医療費の削減につながるとして、iPS細胞などを利用した再生医療の実現に期待が寄せられています。
研究グループはこれまでに、iPS細胞から腎臓の細胞へと変化する途中段階にあたる腎前駆細胞を作製し、急性腎障害の状態を再現したモデルマウス(急性腎障害マウス)への細胞移植実験で治療効果を確認しました(CiRAニュース2015年7月22日)。さらに、より高効率に腎前駆細胞へと誘導するための培養方法の改善(CiRAニュース2020年4月8日)など、慢性腎臓病の細胞治療のための研究を進めてきました。
しかし、これまでの研究では、細胞移植の効果を検証する方法として、従来から研究で使われてきた急性腎障害マウスを用いていました。そのため、慢性腎臓病に対する細胞治療の実現に向けて、慢性腎臓病の動物モデルを新たに作製して実験を行う必要がありました。また、移植治療には1人あたり約10億個の腎前駆細胞が必要ではないかと推計され、実用化には治療効果の期待できる品質の高いiPS細胞由来腎前駆細胞を従来よりも効率よく大量に作製することのできる方法が必要と考えられました。
本研究ではこれらの課題に取り組むことを目的として実験を行い、iPS細胞由来の腎前駆細胞移植に慢性腎臓病マウスに対する治療効果が認められることを示しました。また、慢性腎臓病マウスへの治療効果の仕組みの一端を解明しました。研究グループは、本成果をもとにした臨床試験を数年以内に開始することを目指し、将来的には、慢性腎臓病の進行を防ぐ新規の細胞療法の実現により、人工透析治療へ移行する患者さんを減らすことを目指します。
1. 腎前駆細胞を大量に作製するための培養法の開発
細胞培養では、培養容器の中の細胞が増え、過密になったときに、より多くの新しい容器に細胞を移し分ける「継代」という培養操作を行い、細胞数を増やします。しかし、iPS細胞由来腎前駆細胞を既存の方法で継代すると、増殖率と分化能力が徐々に低下してしまい、大量の腎前駆細胞を作製するための技術的課題となっていました。
研究グループは、2020年に発表した腎臓オルガノイド注6)の培養方法を参考に、新たな培養条件を考案しました。新たな培養方法では、96ウェル(穴)プレートに1ウェルあたり2万個のiPS細胞由来腎前駆細胞を入れ、3種類の物質(CHIR99021、FGF9、Y-27632)を含む培養液(CFY培養液)で細胞の凝集体を形成させます。この方法で継代させたところ、継代後も増殖率が低下しにくく、2回の継代後に腎前駆細胞を元の100倍以上増やすことができました(図1A)。また、この方法で2回継代したiPS細胞由来腎前駆細胞から、腎臓オルガノイドを作製したところ、糸球体や尿細管の細胞へと分化することがわかりました。加えて、この方法を用いて、異なるヒトiPS細胞株から腎前駆細胞を作製した場合も、他の研究室で作製した場合でも、同様の結果が得られることを確認しました。
次に、シスプラチン(薬剤)を投与して急性腎障害の状態にさせたモデルマウス(急性腎障害マウス)において、腎臓を覆う被膜(腎被膜注7))とその内側の腎実質とのあいだ(腎被膜下)に、CFY培養液を用いた継代で増殖させたiPS細胞由来腎前駆細胞を移植しました。その結果、シスプラチンにより誘導される急性腎障害が、細胞移植によって軽減されました(図1B)。
これらの結果から、新たな培養条件により従来よりも効率的に増殖させたiPS細胞由来腎前駆細胞が、腎臓の各種細胞へと分化する能力と急性腎障害に対する治療効果を発揮する品質をもつことが示されました。
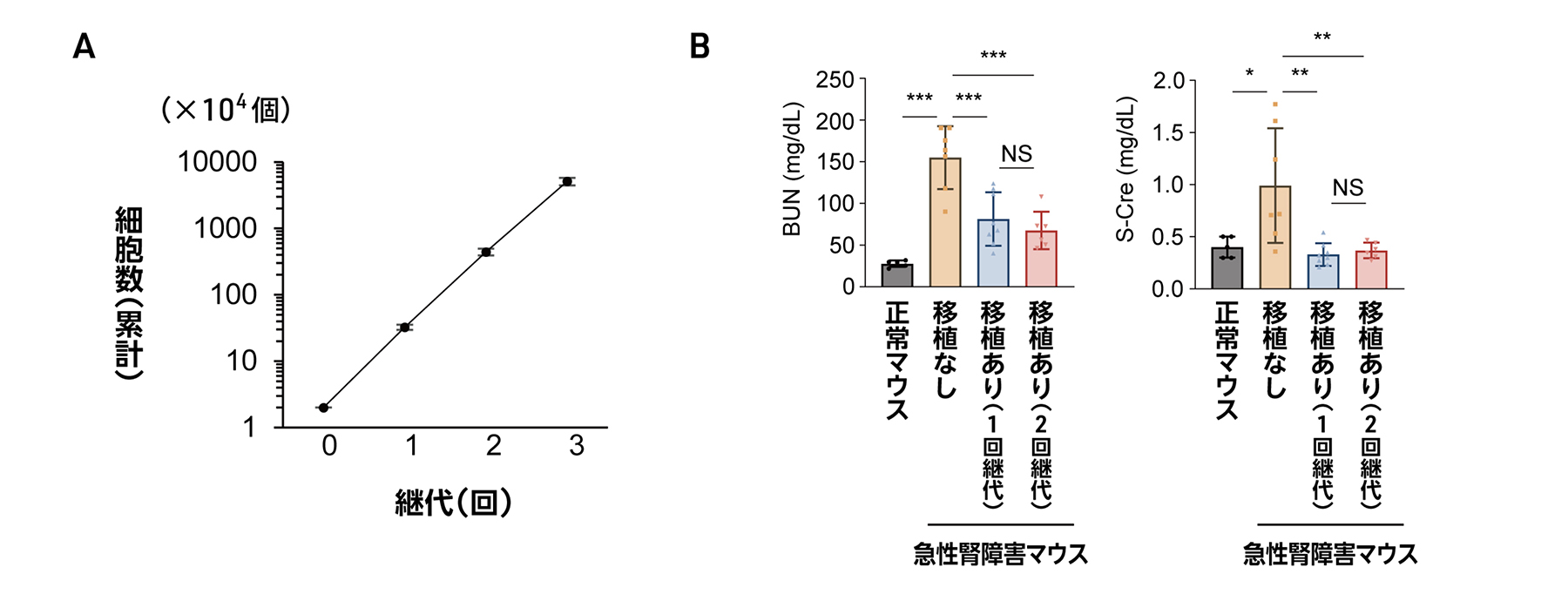
図1 CFY培養液を用いた腎前駆細胞の継代
A:ヒトiPS細胞から作製した腎前駆細胞をCFY培養液を用いて培養した場合の、継代を経た細胞数の変化(累計)。
B:急性腎障害マウスにCFY培養液を用いて培養したiPS細胞由来腎前駆細胞を移植して3日後の血中尿素窒素(BUN)および血清クレアチニン(S-Cre)値の評価。どちらの指標も、値が高いほど、腎機能が低下していることを示す。
2. 目的細胞の純化に用いる細胞表面マーカーの同定
iPS細胞から腎前駆細胞を作製する過程では、未分化なiPS細胞が培養皿上に残っていたり、移植に不要な目的外の細胞が一部誘導されたりします。研究グループは、未分化なiPS細胞や目的外の細胞を除外し、移植に用いる腎前駆細胞だけを選別・純化するために有用な目印となる細胞膜上に存在するタンパク質(細胞表面マーカー)を探索しました。
その結果、目的の腎前駆細胞に特徴的な2種類の遺伝子(いずれも細胞内に存在するタンパク質OSR1とSIX2の遺伝子)が両方とも存在する細胞で特異的に発現し、細胞膜上に存在するc-METタンパク質を見出しました。
実際にc-METを発現する腎前駆細胞とc-METを発現しない細胞を単離し、それぞれを急性腎障害マウスに移植したところ、c-METを発現する腎前駆細胞のほうが治療効果が強く、目的細胞の純化が可能であることを実証しました。
3)慢性腎臓病マウスへの腎前駆細胞の移植実験
研究グループは、慢性腎臓病に対するiPS細胞由来腎前駆細胞の移植効果を検証するため、腎毒性をもつアリストロキア酸を実験用マウスにくりかえし投与することで、慢性腎臓病を再現したモデルマウス(慢性腎臓病マウス)を新たに作製しました。この慢性腎臓病マウスは、1〜6カ月にわたり徐々に腎障害や腎臓の線維化が進行します。
ヒトiPS細胞由来の腎前駆細胞を、慢性腎臓病マウスの腎被膜下に移植した結果、コントロール群でみられる腎機能の低下(図2A)や線維化(図2B)が抑えられることを確認しました。さらに、ヒトiPS細胞由来の腎前駆細胞は、慢性腎臓病によって誘発される腎臓老化を抑制することが明らかになりました(図2C)。
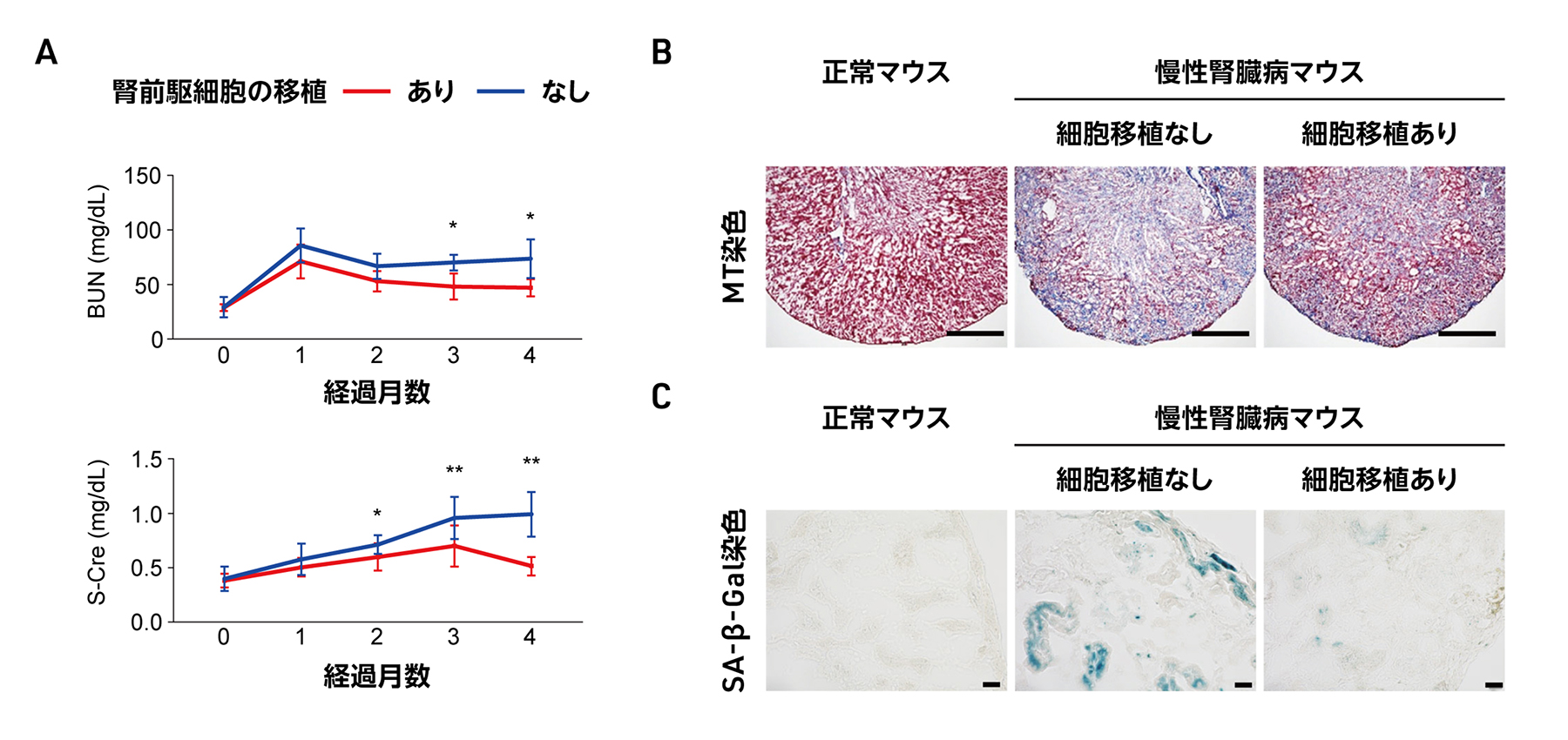
図2 慢性腎臓病マウスへの腎前駆細胞の移植の効果
A:腎機能の指標である血中尿素窒素(BUN)および血清クレアチニン(S-Cre)値の移植後の変動。青色の線で示す症例は、慢性腎臓病マウスに生理食塩水を投与したコントロール群。横軸は移植後の経過月数を示す。
B:各マウスの腎臓の切片に対して、線維化を評価できるMT(マッソントリクローム)染色を行った。慢性腎臓病マウス(中央および右)は、生理食塩水(中央;コントロール群)と腎前駆細胞(右)をそれぞれ投与後4ヶ月時点の染色像。MT染色では、線維が青色に染まる。慢性腎臓病マウスに対して、腎前駆細胞を移植していないコントロール群で、青色がより強く染色されている。
C:各マウスの腎臓の切片に対して、老化を評価するsenescence-associated (SA)-β-Gal染色を行った。慢性腎臓病マウス(中央および右)は、生理食塩水(中央;コントロール群)と腎前駆細胞(右)をそれぞれ投与後4ヶ月時点の染色像。SA-β-Gal染色では、老化細胞が青色に染まる。慢性腎臓病マウスに対して、腎前駆細胞を移植していないコントロール群で、青色に染色されている箇所が多くみられる。
4)腎前駆細胞の凝集体から分泌される因子は腎機能を保護する作用をもつ
研究グループは、iPS細胞由来腎前駆細胞が何らかの因子を分泌することで移植時に腎機能の低下や線維化および老化を抑制すると考えました。これを確かめるため、移植時に腎臓の被膜下の状況に近いと考えられる、腎前駆細胞の巨大な凝集体を培養皿上で再現しました。そして、その凝集体を培養している容器から得られる上清液のみを急性腎障害マウスに投与しました。その結果、上清液を投与した急性腎障害マウスのグループでは、単にCFY培養液を投与したグループと比較して、腎機能の低下(図3A)や生存率の減少(図3B)が大幅に改善することが明らかになりました。
さらに、この腎前駆細胞の凝集体で特異的に存在する分泌タンパク質を網羅的に探索し、複数の候補の中から、血管内皮細胞増殖因子A(VEGF-A)タンパク質に着目しました。
そして、VEGF-Aタンパク質の遺伝子VEGFAを欠損したiPS細胞由来腎前駆細胞を急性腎障害および慢性腎臓病マウスに移植したところ、iPS細胞由来腎前駆細胞の移植でみられた治療効果が減弱しました。研究グループはさらなる解析を行い、慢性腎臓病および急性腎障害のモデルマウスの腎被膜下に移植されたiPS細胞由来腎前駆細胞による治療効果の一部は、移植片から分泌されるVEGF-Aタンパク質による血管新生の促進作用の結果と考えられることを示しました。
今後、iPS細胞由来腎前駆細胞の凝集体から分泌されるその他の因子の作用なども対象に研究を進めることで、急性腎障害に対する治療法の基盤となる知見が得られる可能性があります。
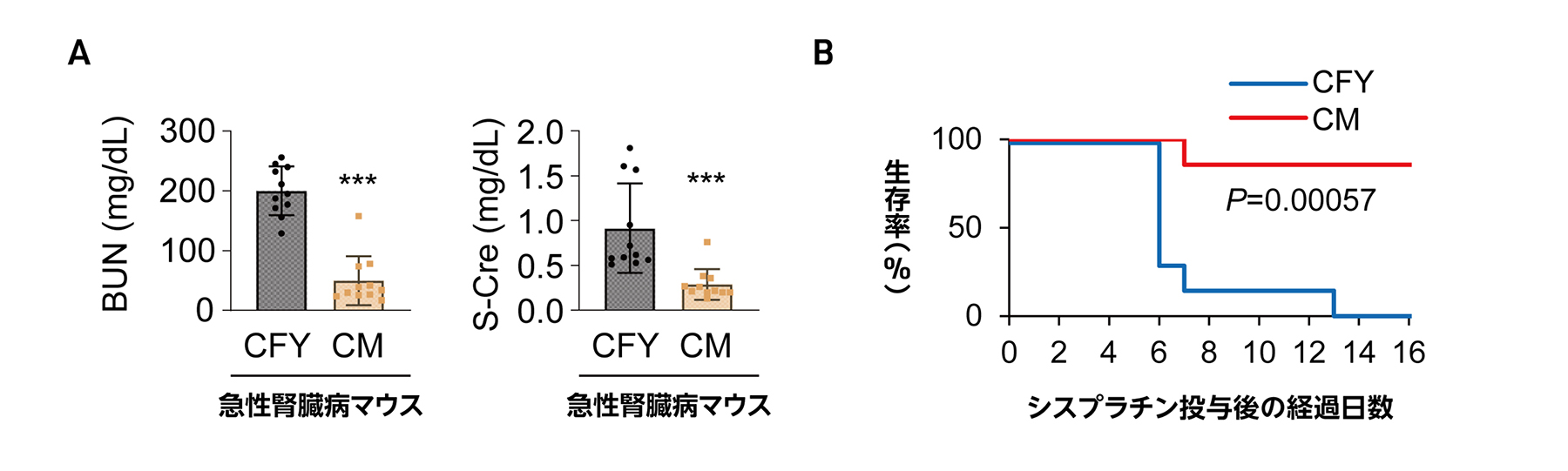
図3 急性腎障害マウスに対するiPS細胞由来腎前駆細胞の凝集体の培養上清液の投与実験
A:シスプラチン(cisplatin)の投与による急性腎障害マウスに対して、腎前駆細胞の凝集体から分泌される因子を含む上清液(CM)または分泌因子を含まないCFY培養液(CFY)をそれぞれ腹腔内にシスプラチン投与1日後から4日後まで投与したときの血中尿素窒素(BUN)および血清クレアチニン(S-Cre)値を測定した。
B:急性腎障害マウスにCMまたはCFYを投与した場合の生存率の変化。
本研究では、慢性腎臓病に対する細胞治療の臨床応用に向けて、ヒトiPS細胞から作製した腎前駆細胞を増殖させる培養法の開発と目的細胞のみを選別する細胞表面マーカーの同定を行いました。さらに、慢性腎臓病マウスに対する移植実験を行い、細胞移植が腎機能の低下や繊維化および老化を抑制する効果があることを確認しました。これらの成果は、今後の臨床試験の基盤となるデータと位置付けられます。研究グループは、今後、実際の移植を想定した安全性の評価などを進めて、数年以内の臨床試験開始につなげることを目指しています。
また、今後、腎前駆細胞の凝集体が分泌する因子の作用について研究を進めることで、移植まで時間のかかる細胞療法では対処できない急性腎障害の治療法開発にも役立つ知見が得られることが期待されます。
- 論文名
Human iPSC-derived nephron progenitor cells treat acute kidney injury and chronic kidney disease in mouse models - ジャーナル名
Science Translational Medicine - 著者
Toshikazu Araoka1,*, Kosuke Toyohara1,*, Makoto Ryosaka1, Chihiro Inui1, Maasa Matsuura1, Chen Ma2, Jun Watahiki3, Zhongwei Li4, Mio Iwasaki1, Akira Watanabe3, Ryuji Yokokawa2, Yasuhiko Tabata5, Juan Carlos Izpisua Belmonte6, Kenji Osafune1,**
*:共同筆頭著者
**:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院工学研究科
- 京都大学大学院医学研究科
- ケック医科大学
- 京都大学医生物学研究所
- Altos社
本研究は、下記機関より支援を受けて実施されました。
- ライフサイエンス振興財団
- テルモ生命科学振興財団
- 持田記念医学薬学振興財団
-
日本学術振興会(JSPS)
- 科研費(JP23K07670)
-
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム「再生・細胞医療・遺伝子治療研究中核拠点」
- 再生医療実現拠点ネットワークプログラム、再生・細胞医療・遺伝子治療研究開発課題(基礎応用研究課題)「発生学的ニッチと人為的遺伝子改変を用いたヒトiPS細胞からの臓器の再生」
- 再生医療・遺伝子治療の産業化に向けた基盤技術開発事業、再生・細胞医療・遺伝子治療産業化促進事業「ヒトiPS 細胞由来腎前駆細胞を用いた慢性腎臓病(CKD)に対する細胞療法の開発」
- iPS細胞研究基金
- リジェネフロ株式会社
注1)腎前駆細胞(ネフロン前駆細胞)
ヒトやマウスでは発生期の腎臓にのみ存在し、糸球体と尿細管に分化することによって腎臓の機能の最小単位であるネフロンをつくる前駆細胞のこと。
注2)慢性腎臓病(chronic kidney disease; CKD)
原因はさまざまであるが、腎臓の機能の低下が持続している状態。日本に約2,000万人の患者さんがいるとされ、成人の5人に1人はCKDであると推定される。治癒することはほとんどなく、多くの場合は原因疾患の持続や加齢により徐々に進行する。進行すると、人工透析や腎移植が必要になる。
注3)線維化
線維芽細胞が増殖し、コラーゲンなどを作って障害を受けた部分を補う反応。細胞の機能までは補えないため、線維化した部分が多くなってしまうと、組織として機能しなくなる。
注4)血管内皮増殖因子A(vascular endothelial growth factor A; VEGF-A)
細胞が分泌するタンパク質の一種で、主に新しい血管の形成(血管新生)を促す働きを持つ。組織の再生や発生など、さまざまな生理現象に重要な役割を果たしている。細胞治療では、移植した細胞が移植部位の組織に新規に加わって働くだけでなく、VEGF-Aなどを分泌することで周囲の(宿主の)細胞に影響を与える「パラクライン効果」により治療効果を発揮すると考えられている。
注5)急性腎障害(acute kidney injury; AKI)
何らかの原因により急激に腎臓が働かなくなる状態のこと。以前は急性腎不全と呼ばれていた。早急な治療が必要なため、移植までに時間のかかる細胞治療のアプローチは困難である。
注6)腎オルガノイド
iPS細胞などの多能性幹細胞から分化誘導を経て形成される腎臓様の構造体。内部に尿細管や糸球体の構造がみられ、胎児期の腎臓に類似するとされる。
注7)腎被膜
腎臓を覆っている膜のこと。腎被膜下は腎臓の中で血液等によって細胞が流されにくいところであり、細胞等の移植場所として使われている。






















