
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年5月27日
iPS細胞由来間葉系幹細胞によるACVR2B-Fc送達とラパマイシンの併用による進行性骨化性線維異形成症に対する新規治療戦略の開発
ポイント
- 研究チームはこれまでの研究で、FOP注1)の異所性骨形成に対してmTORシグナル阻害剤ラパマイシン注2)が進行抑制効果を持つこと、および骨形成タンパク質阻害物質ACVR2B-Fc注3)をiMSC注4)に搭載することで効率的に標的組織へ届ける方法を開発していました。
- 今回、ACVR2B-Fc搭載iMSCとラパマイシンを併用することで、FOPの異所性骨化の進行抑制効果が高まることを動物モデルで確認しました。
- 併用療法が外科的切除後の再骨化(二次骨化)注5)抑制にも有効性があることを確認しました。
Pan Gao研究員、池谷真准教授(CiRA臨床応用研究部門)らの研究グループは、進行性骨化性線維異形成症(Fibrodysplasia ossificans progressiva: FOP)の異所性骨化に対する新規治療法として、iPS細胞由来間葉系幹細胞(iMSC)によるACVR2B-Fc送達と低用量ラパマイシンの併用の可能性について検討しました。その結果、併用療法が一次骨化(初発病変)だけでなく、外科的切除後の再発(二次骨化)にも一定の抑制効果があることを確認しました。
この研究成果は2025年4月21日(米国時間)に国際科学誌「JBMR Plus」でオンライン公開されました。
FOPは、筋肉をはじめとする軟部組織内で異常な骨形成が進行する難治性骨疾患で、患者さんのQOLを著しく低下させます。十分な効果が得られる治療法がいまだに開発されておらず、新たな治療戦略の開発が求められています。本研究では、研究グループがこれまでに開発してきた、FOP進行抑制剤としてのラパマイシン(CiRAニュース 2017年8月1日)と、iMSCを活用した治療タンパク質ACVR2B-Fcを患部に送達する技術(CiRAニュース 2024年3月26日)の併用による治療効果の向上を目指しました。
1)低用量ラパマイシンの異所性骨抑制効果の検証
本研究ではまず、FOPモデルマウスに対してラパマイシンの濃度を変化させて単独で投与し、その効果を検証しました。その結果、ラパマイシンの投与量依存的に異所性骨抑制効果が変化することを確認しました。

図1. FOPモデルマウスへのラパマイシン投与による異所性骨抑制効果の濃度依存性
左:FOP原因遺伝子(ACVR1)の変異を誘導したマウスに、骨形成刺激を与えると同時に様々な濃度のラパマイシンを投与して、2週間後に異所性骨の量を比較した。上がレントゲン画像、下がµCT画像。
右:ラパマイシンの異所性骨抑制効果には用量依存性があることが示された。0.1mg/kgで約40%、0.3mg/kgで約70%、それ以上ではほぼ100%の異所性骨抑制効果が観察された。
2)併用療法による一次骨化の抑制
続いて、ACVR2B-Fcを搭載したiMSCを動物モデルへ移植し、さらに低用量ラパマイシンを併用投与することで、単独治療と比較して異所性骨化抑制効果が増強されることを示しました。

図2. FOPモデルマウスへの低用量ラパマイシンとACVR2B-Fc搭載iMSCの
併用による異所性骨抑制効果の検証
左:FOP原因遺伝子(ACVR1)の変異を誘導したマウスに、骨形成刺激を与えると同時に低用量ラパマイシンとACVR2B-Fc搭載iMSCを投与して、2週間後に異所性骨の量を比較した。上がレントゲン画像、下がµCT画像。
右:低用量ラパマイシンとACVR2B-Fc搭載iMSCの併用により、単独投与よりも異所性骨抑制効果が増強されることを確認した。iMSC2B-Fc/LuciはACVR2B-Fc搭載iMSC、iMSCEiP/LuciはACVR2B-Fc非搭載iMSC投与群。Rapaは0.3mg/kgラパマイシン投与群。
3)併用療法による二次骨化の抑制
さらに、一次骨化(初発病変)の後に外科的に異所性骨を切除し、その後の再発(二次骨化)を観察するモデルにおいても同様に、併用療法に再骨化抑制効果があることを確認しました。また、ラパマイシンの併用はiMSCの局所での生存と機能維持に寄与していることを示唆するデータも得ました。
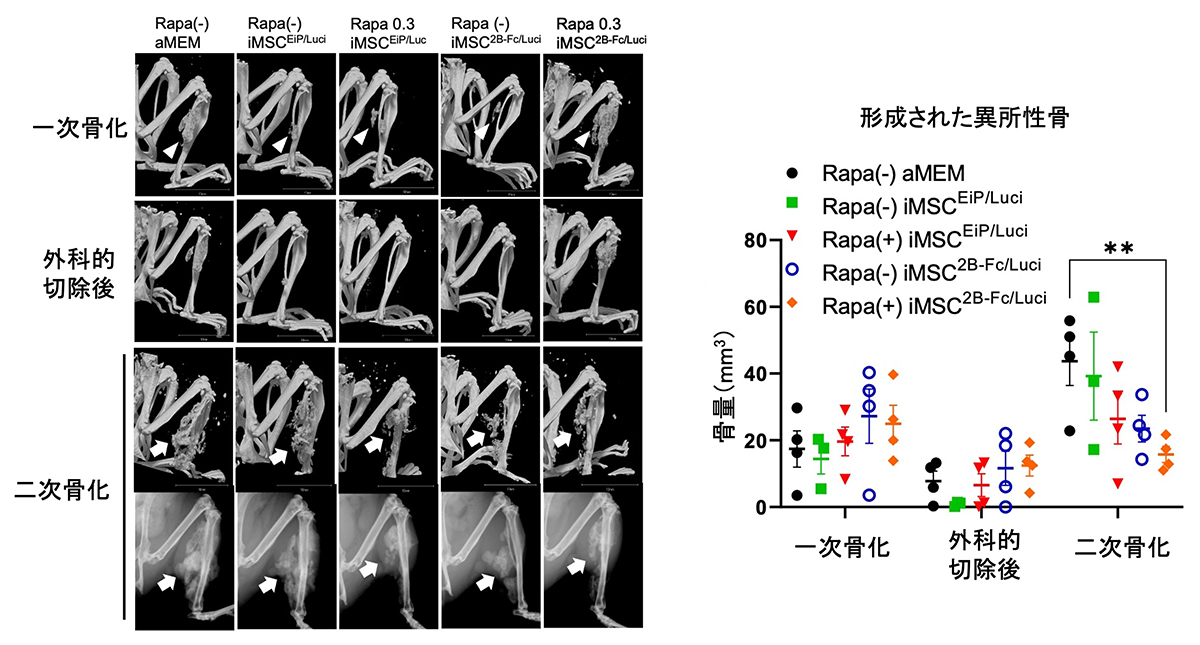
図3. FOPモデルマウスの再骨化に対する、低用量ラパマイシンとACVR2B-Fc搭載iMSCの
併用による異所性骨抑制効果の検証
左:FOP原因遺伝子(ACVR1)の変異を誘導したマウスに、骨形成刺激を与えて異所性骨を形成させ(primary HO)(最上段)、異所性骨を外科的に除去後(Post-resection)(2段目)に形成される二次的な再骨化(二次骨化)(Recurrent HO)(2、4段目)に対し、外科手術と同時に低用量ラパマイシンとACVR2B-Fc搭載iMSCを投与して、2週間後に異所性骨の量を比較した。上がレントゲン画像、下がµCT画像。
右:二次骨化に対しても、低用量ラパマイシンとACVR2B-Fc搭載iMSCの併用(オレンジ色)により、単独投与よりも異所性骨抑制効果が増強されることを確認した。iMSC2B-Fc/LuciはACVR2B-Fc搭載iMSC、iMSCEiP/LuciはACVR2B-Fc非搭載iMSC投与群。Rapaは0.3mg/kgラパマイシン投与群。
以上より、iMSCによる治療タンパク質の局所送達とラパマイシンの併用が、FOPの一次骨化だけでなく、外科的切除後の二次骨化の抑制にも有効である可能性が示されました。
本研究は、FOPに対する新たな治療戦略として、iMSCを利用したACVR2B-Fc融合タンパク質の局所送達とラパマイシンの併用療法の有効性を明らかにしました。これまで困難とされてきた外科的切除後の再発(二次骨化)に対しても、骨化抑制効果が認められたことは意義があります。これらの成果は、FOPのみならず、他の異所性骨化疾患や再生医療分野にも応用可能な新しい細胞・分子ハイブリッド治療の基盤となることが期待されます。しかし、今回の実験結果によれば併用療法による再骨化の効果は限定的であり、完全に抑制されるまでの効果は発揮できていません。他の治療薬との組み合わせ、投与経路、投与量など、さらなる戦略の検討が必要と考えられます。
- 論文名
Combined rapamycin and iMSC-mediated delivery of ACVR2B-Fc fusion protein reduces heterotopic ossification in a mouse model of fibrodysplasia ossificans progressiva - ジャーナル名
JBMR Plus - 著者
Pan Gao1,2, Yoshiko Inada2, Maria José López-Iniesta2, Chengzhu Zhao2,3, Megumi Goto2, Akitsu Hotta2, Hidetoshi Sakurai2, Makoto Ikeya2*
*: 責任著者 - 著者の所属機関
- 四川大学華西口腔医学院
- 京都大学iPS細胞研究所(CiRA)
- 重慶医科大学 検査医学院
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
- 「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」(JP15bm0104001)
- 「再生医療実現拠点ネットワークプログラム 再生・細胞医療・遺伝子治療研究開発課題」(JP22bm1123006)
- 「再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究中核拠点」(23bm1323001h0001)
- 京都大学教育研究振興財団
- 公益財団法人ひょうご科学技術協会(#5024)
- iPS細胞研究基金
- 日本学術振興会 科学研究費 基盤B(23H03028)
- 中国国家留学基金(202008510007)
注1)FOP
進行性骨化性線維異形成症(Fibrodysplasia ossificans progressiva)の略。軟部組織に異所性に骨ができる希少難病。
注2)ラパマイシン
移植した臓器が拒絶される事を防ぐため等に使われている免疫抑制剤。細胞内ではmTORの活性を阻害する効果がある。
注3)ACVR2B-Fc
FOPの増悪因子の1つであるBMPタンパク質の受容体の細胞外部分に、抗体の定常領域の一部であるFc領域を融合したタンパク質。偽受容体として機能するため、BMPによって引き起こされるシグナルを止める働きがある。Fcと融合することにより、血液中で分解される速度が遅くなることが期待される。
注4)iMSC
induced mesenchymal stromal cellsの略。日本語で誘導間葉系間質細胞。間葉系間質細胞は骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。本報では、iPS細胞から誘導して作製したものをiMSC(induced Mesenchymal Stromal Cell)としている。
注5)再骨化(二次骨化)
FOPでは、形成された異所性骨を外科手術で取り除くと、さらに強い炎症反応を引き起こし、再度異所性骨が形成される。これを再骨化、あるいは二次骨化と呼んでいる。






















