
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年6月5日
ヒト心臓への作用を評価する創薬のための培養系プラットフォーム
―人工心臓組織デバイスを低吸着素材に変えて精度向上―
ポイント
- 薬剤を吸着しにくいポリスチレンフィルムを用いてiPS細胞由来人工心臓組織 (Engineered Heart Tissue: EHT) 注1)デバイスを開発し、このデバイスを用いた心機能の解析プログラムを構築した。
- 本研究で開発された低収着EHTデバイスを用いることで、低濃度のドキソルビシンによる心毒性を検出できる高精度な測定が可能になった。
吉田善紀准教授(京都大学iPS細胞研究所(CiRA)増殖分化機構研究部門、T-CiRAプログラム主任研究員)、藤原侑哉(CiRA同部門特命助教、T-CiRAプログラム研究員)らの研究グループは、人工心臓組織 (Engineered Heart Tissue: EHT) デバイスを低収着素材を用いて新たに開発し、精度の高い心機能評価系をin vitro(生体外)で構築しました。
ヒトiPS細胞由来心筋細胞を用いて作製されるEHTはin vitroで心臓の機能を評価するプラットフォームとして、心疾患に対する薬剤開発や心毒性試験での利用が期待されています。EHTデバイスは、2本の支柱を含む特殊な構造のデバイスの中で、2本の支柱の先をつなぐような形で保持されています。従来、ポリジメチルシロキサン (PDMS) がこのデバイスの素材として用いられていました。しかし、PDMSは低分子化合物を収着する性質を持つため、EHTを用いた薬理学的な評価の正確性に影響を与えると考えられました。
本研究では、薬剤の収着を抑えたポリスチレン製の低収着デバイスを開発し、EHTデバイスでみられる心臓組織の収縮を自動的に解析できるプログラムを作製構築しました。これにより、心毒性作用をもつドキソルビシンを低濃度域でも検出できる、高精度なプラットフォームの構築に成功しました。また、デバイス材料による化合物の収着がEHTの薬剤評価に影響することを明らかにしました。本プラットフォームは心機能への正確な薬理作用をin vitroで検証できるプラットフォームとして創薬に有用であると考えられます。
この研究成果は2025年5月30日(日本時間)に国際学術誌「Lab on a Chip」にオンライン公開されました。
人工心臓組織(EHT)のイメージ図
新薬開発では、主にマウスやサルなどのモデル動物により薬効や安全性を確認する非臨床試験を行い、効果と安全性ともに問題がなさそうであれば、実際にヒトで確認する臨床試験へと進みます。しかし、非臨床試験で問題がみられなかった薬剤でも、臨床試験において効果や安全性が確認できずに開発中止となることがあります。その主な原因として、非臨床試験の段階で、ヒトとモデル動物との種差などにより、臨床試験と同等の結果が再現できないことが考えられます。このようにモデル動物での試験では薬剤の有効性や安全性の予測に限界があることが指摘されています。
ヒトiPS細胞由来心筋細胞によるEHTデバイスは、生体外でヒト心臓の機能への作用を評価できる創薬のためのプラットフォームになると期待されています。EHTデバイスを心毒性試験や循環器疾患の治療薬探索に利用することで、臨床試験の効果や安全性、薬物動態などのより正確な予測が可能になると考えられます。
EHTデバイスでは、EHTが2本の支柱の先につながっており、EHTが収縮すると2本の支柱がたわみます。このとき、収縮に伴う支柱の先端の移動距離をもとに、EHTが生み出す収縮力を簡便に算出することができます。
これまでPDMSは生体内や培養上で細胞への反応性が低く、柔らかく変形しやすい素材であることから収縮力を感度よく測定できる素材として、EHTデバイスの材料に用いられてきました。しかし、PDMSは低分子化合物を収着する性質があり、添加した薬剤がPDMSに収着することで、薬効評価の正確性に影響を与える可能性がありました。
本研究では、PDMSを用いない薬剤を収着しにくいデバイスを作製し、デバイスの素材が与える影響を検証し、より精度の高いEHTデバイスによる創薬プラットフォームを構築しました。
1)ポリスチレンを用いた低収着デバイスの作製
デバイスに従来使用していた素材であるPDMSの代替として、ポリスチレン(PS)に着目し、ポリスチレンでは蛍光を発する化合物Rhodamine Bが収着しないことを確認しました(図1A)。低吸着性の確認されたポリスチレンを素材として用いて、新たにデバイスを作製し(図1B)、細胞数等のEHTの作製条件を最適化することで、EHTが問題なく作製できることを確認しました(図1C)。
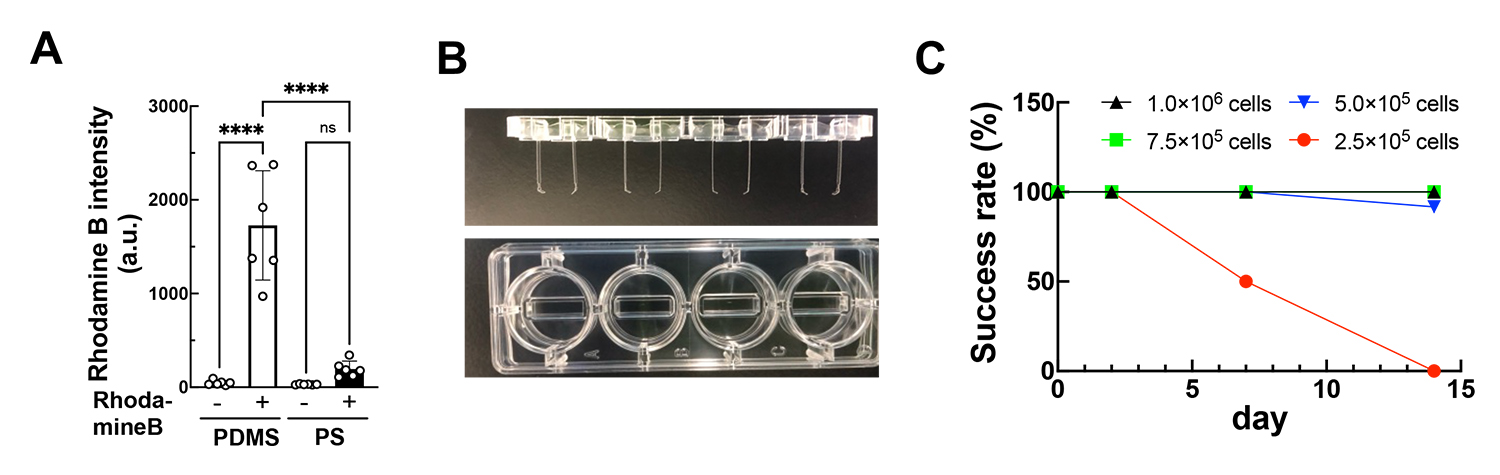
図1:ポリスチレンの薬剤収着の評価とデバイス開発
A:PDMSとポリスチレン(PS)に対する化合物(Rohodamine B)の収着を測定した。
B:ポリスチレン(PS)を用いて開発したデバイス。
C:開発したデバイスを用いてEHTの形状を維持できた経時的な成功確率。
2)解析プログラムの作成
支柱の先端の移動距離を手動で測る場合、多くの労力と解析時の意図しないバイアスがかかる可能性があります。そのため、画像データから自動で支柱の位置を認識し、解析結果を出力するプログラムを開発しました。このプログラムを用いることで簡便かつバイアスなく支柱の位置の変化を追跡し、EHTの成熟化に伴う移動距離の増大を捉えることが可能になりました(図2)。
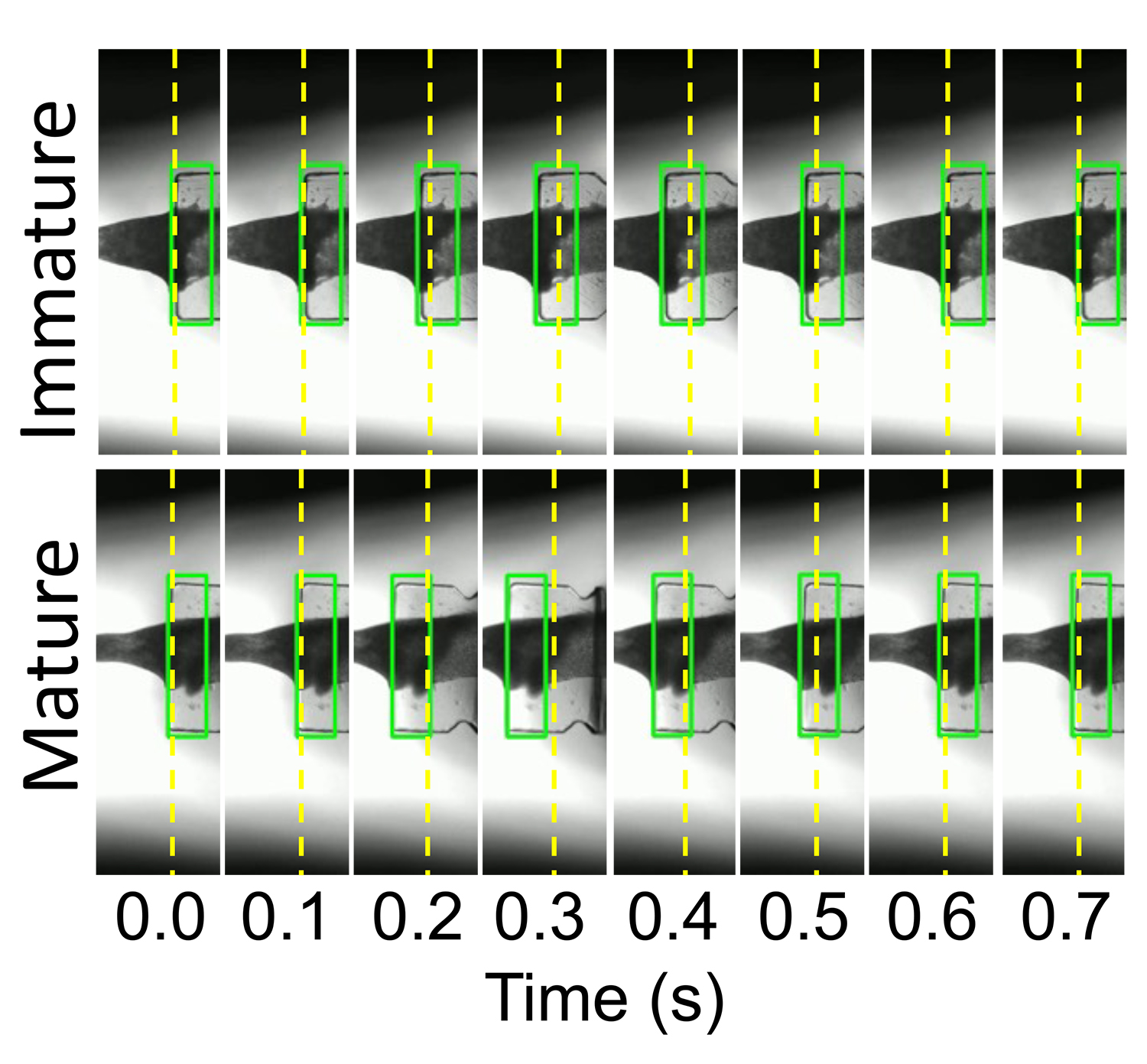
図2:未熟(Immature)と成熟(Mature)EHTの収縮に伴う支柱の位置の変化
拡張時の支柱の位置(黄色の点線)、プログラムで認識されている支柱の位置(緑色の四角)
3)薬剤反応性の評価
次にポリスチレン製デバイスとこのプログラムを用いて、様々な薬剤の濃度依存的な収縮力の変化を検出できるかを評価しました。心筋の収縮力を低下させる薬剤(ブレビスタチンおよびジルチアゼム)の濃度依存的な収縮力の低下を検出することができ(図3A, B)、さらに心毒性作用をもつドキソルビシンによる濃度依存的な収縮力の低下を検出することができました(図3C)。
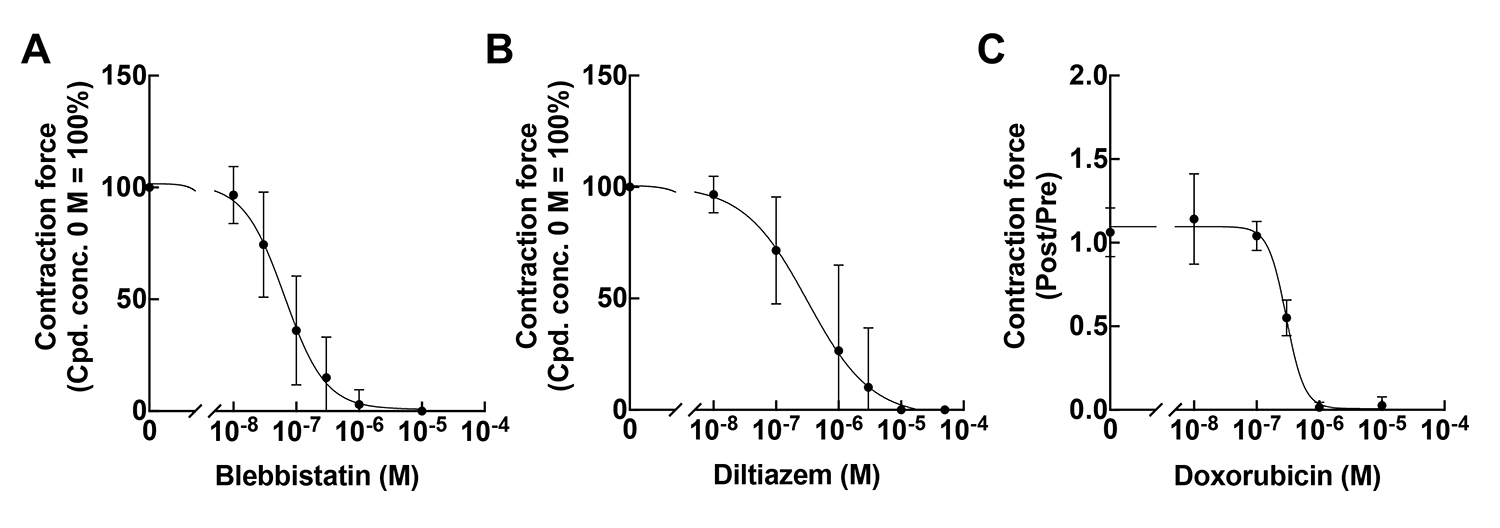
図3:濃度依存的な薬剤反応性を検証した結果
A:ブレビスタチン(Myosin II 阻害剤)の濃度依存的な収縮力の変化。
B:ジルチアゼム(カルシウムブロッカー)の濃度依存的な収縮力の変化。
C:心毒性作用をもつドキソルビシンの濃度依存的な収縮力の変化。
4)デバイス材料が与える薬剤感受性の差異の検証
最後に、PDMSを素材とする従来のデバイスとポリスチレン製の低収着デバイスを用いて作製されたEHTを用いて、ドキソルビシンによる薬剤反応性を比較しました。0.3μmのドキソルビシンを添加した場合、低収着デバイスを用いて作製されたEHTは収縮力の低下を示したのに対し、PDMSを素材とするデバイスを用いて作製されたEHTは収縮力の低下を示しませんでした(図4)。ドキソルビシンはPDMSに収着することが知られており、デバイス間でEHTの形状や成熟度、培地成分への影響は確認されなかったことから、この薬剤反応性の差はPDMSによる収着が原因であると結論づけられました。
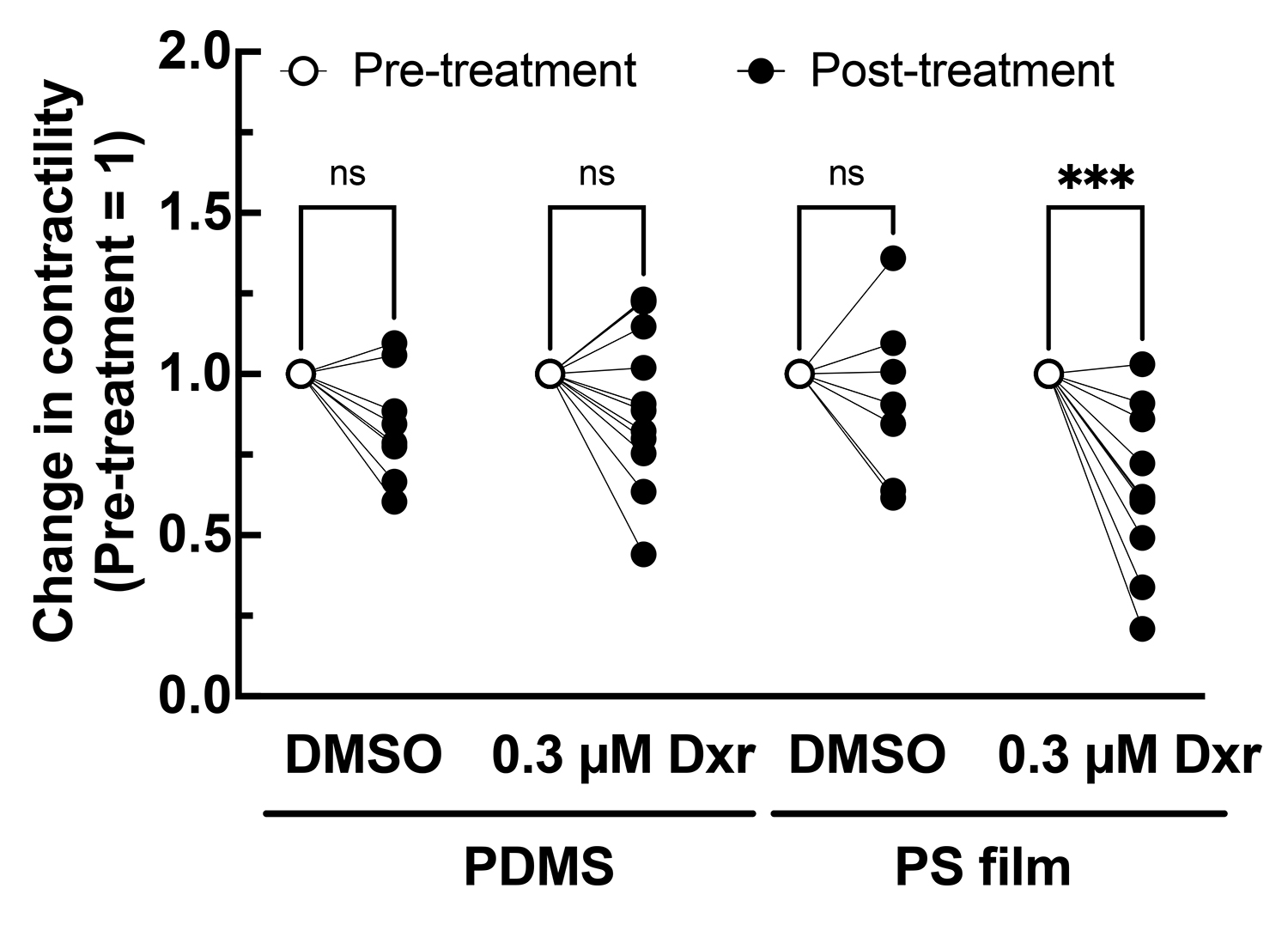
図4:PDMSもしくは低収着 (PS film) デバイスにより作製されたEHTのドキソルビシン感受性
今回、低収着EHTデバイスとその解析プログラムを作製しました。これにより、デバイスの素材が薬剤評価に影響することを明らかにし、本研究で開発されたプラットフォームは心機能に対する正確な薬理作用を試験管内で検証することを可能とするものであると期待されます。今後、本プラットフォームを用いて心筋症に対する治療薬開発や心毒性評価系の構築を行っていく予定です。
- 論文名
A polystyrene-film-based device for engineered cardiac tissues enables accurate analysis of drug response on contractile properties - ジャーナル名
Lab on a Chip - 著者
Yuya Fujiwara1,2*, Masako Sasaki1,2, Sohei Funaoka3, Takuro Yoshikuni3, Yuki Naka1,2, Kazumi Ida1,2, Taichi Aihara3, Shunsuke Funakoshi1,2, Kenichi Imahashi2,4, Yoshinori Yoshida1,2*
*:共同責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA共同研究プログラム(T-CiRA)
- 住友ベークライト株式会社
- 武田薬品工業株式会社 Target Validation Sciences
本研究は、下記機関より支援を受けて実施されました。
- タケダ-CiRA共同研究プログラム(T-CiRA)
- 武田薬品工業株式会社
- 住友ベークライト株式会社
- 日本学術振興会科研費(20K16218, 24K19055)
- 京都大学教育研究振興財団
- Leducq財団(18CVD05)
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
「再生医療用iPS細胞ストック開発拠点」
「iPS細胞を用いたサブタイプ別心筋組織構築による心疾患研究」- 再生・細胞医療・遺伝子治療実現加速化プログラム
「心臓の病理を統合的に再現する領域特異的心筋組織モデルの構築」
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」
「心筋細胞と心外膜細胞を用いた心臓オルガノイドによる心筋組織再建治療の開発」- 医薬品等規制調和・評価研究事業
「重篤副作用患者由来iPS細胞バンクの構築に向けたフィージビリティ研究」
「ヒトiPS細胞技術とAI・機械学習を用いた統合的な抗がん剤心毒性評価法の開発と国際標準化」 - iPS細胞研究基金
- ディープテック・スタートアップ国際展開プログラム(D-Global) (JPMJSF2323)
注1)人工心臓組織(Engineered heart tissue, EHT)
実際の心臓は心筋細胞と線維芽細胞などさまざまな種類の非心筋細胞から構成されている。これを模倣するため、ヒトiPS細胞由来心筋細胞と心臓線維芽細胞を混ぜて作製する人工心臓組織のこと。






















