
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月1日
Ca²⁺依存性K⁺チャネルKCNN4が血小板産生に寄与する仕組みを解明
ポイント
- 巨核球の成熟過程におけるKCNN4(KCa3.1)によるカリウムイオン(K+)の流出は、細胞内K+濃度の低下を引き金とし、血小板産生を促進する。
- KCNN4の阻害またはノックダウンによるK+流出の抑制は、血小板前駆体(プロプレートレット)の形成不全を伴って血小板放出量の60〜80%の減少を引き起こす。
- K+流出の抑制は、微小管の正常な再構築を妨げ、ミトコンドリア機能の低下および活性酸素種(ROS)の蓄積を誘導する。
- KCNN4による血小板産生制御機構は、iPS細胞およびヒト臍帯血から分化させた巨核球の双方で共通しており、将来的な血小板製造技術の改良に寄与しうる。
血小板注1)製剤の供給の課題を解決する手段として、iPS細胞由来の高効率な血小板産生技術の確立が求められています。本研究では、血小板産生細胞である巨核球の成熟期において、カルシウムイオン(Ca2+)依存性カリウムイオン(K+)チャネルKCNN4(KCa3.1)を介した細胞外へのK+流出が、正常な微小管の再構築、次いでミトコンドリアの適切な融合・分配、活性酸素種(ROS)の恒常性維持に寄与し、血小板産生を駆動することを明らかにしました。
iPS細胞から作製した不死化巨核球細胞株(imMKCL)注2)(CiRAニュース 2014年2月14日)を用いた解析では、KCNN4を薬理学的または遺伝学的に阻害することで、血小板前駆体(プロプレートレット)注3)の形成が抑制され、血小板産生が著しく低下することが示されました。さらに、ヒト臍帯血造血幹細胞由来の巨核球(CB-MK)においても同様のメカニズムが存在することを確認しました。
生体外での血小板製造工程における培地の改良や、血小板減少症に対する新たな治療標的の提案につながるものと期待されます。
この研究成果は2025年5月22日に国際科学誌「Journal of Thrombosis and Haemostasis」にオンライン掲載されました。
血小板製剤は有効期間が約4-7日と短いため、需要と供給のバランス調整が困難であることが知られています(例:冬季には不足し、夏季には供給過剰になる傾向)。加えて、高齢患者さんの増加および献血人口の減少から、将来的には慢性的な供給不足が懸念されています。特に、ヒト白血球抗原(HLA)の適合を必要とする患者さんに対しては、HLAを欠失させたユニバーサル血小板のニーズが高まることが予想されます。
こうした課題に対し、私たちの研究室では、iPS細胞から作製した不死化巨核球細胞株(imMKCL)を用いた血小板の大量製造技術の開発と臨床応用を進めてきました(CiRAニュース 2018年7月13日、CiRAニュース 2022年9月30日)。しかしながら、巨核球の成熟および血小板放出を支える分子メカニズムは、これまで十分に解明されていませんでした。
imMKCLでは、ドキシサイクリン添加の有無により細胞の増殖と成熟のスイッチを切り替えるシステムを採用しており、切り替えの際には培養液の置換が必要です。培養液の成分に関しては、アミノ酸組成、脂質、増殖因子などの影響を検討した多数の報告がありますが、イオンの調節機構に着目した血小板造血研究は、これまでほとんど行われていませんでした。
一方で、カルシウムイオン(Ca2+)とカリウムイオン(K+)の細胞内外のバランス調整に重要な役割を果たすCa2+依存性K+チャネルKCNN4(KCa3.1)は、多くの細胞において多様な生理機能に関与することが報告されています。本研究では、KCNN4が巨核球の成熟および血小板産生に果たす役割について、詳細に検証しました。
imMKCLをドキシサイクリン非存在下(Dox-OFF)の巨核球成熟培養条件で6日間培養したところ、細胞内のK+濃度が段階的に低下し(図1)、同時に培養上清中のK+濃度が上昇する現象を見出しました。一方で、Ca2+、マグネシウムイオン(Mg2+)、ナトリウムイオン(Na+)など他の主要なイオンには有意な変化は認められませんでした(図1)。
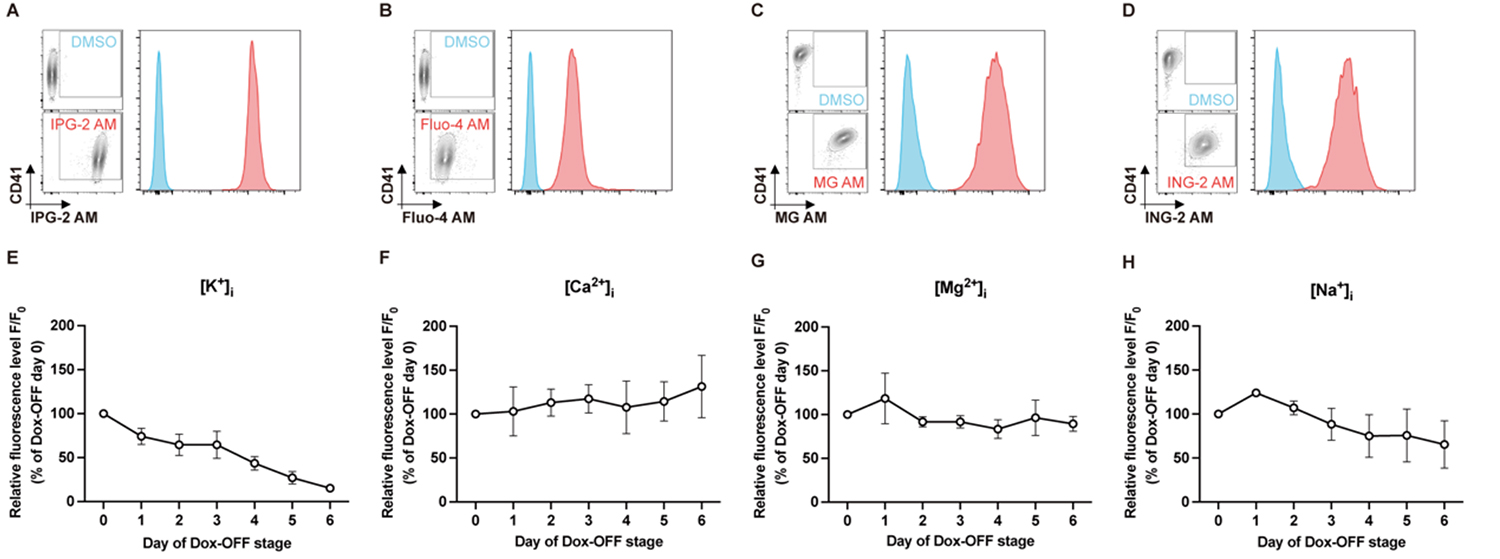
図1:iPS細胞から作製した不死化巨核球細胞株(imMKCL)における、(A) カリウムイオン(K+)、(B) カルシウムイオン(Ca2+)、(C) マグネシウムイオン(Mg2+)、(D) ナトリウムイオン(Na+)の細胞内濃度を示すフローサイトメトリーヒストグラム例。Dox-OFF成熟条件下での培養期間に伴い、細胞内(E) K+濃度が時間依存的に継続して減少していった。一方、(F) Ca2+、(G) Mg2+、(H) Na+の濃度には顕著な変化は認められなかった。
このことから、imMKCL成熟初期におけるK+の流出が重要であることが示唆され、発現パターンからCa2+依存性K+チャネルであるKCNN4は関与因子の候補の一つと考えられました(図2)。
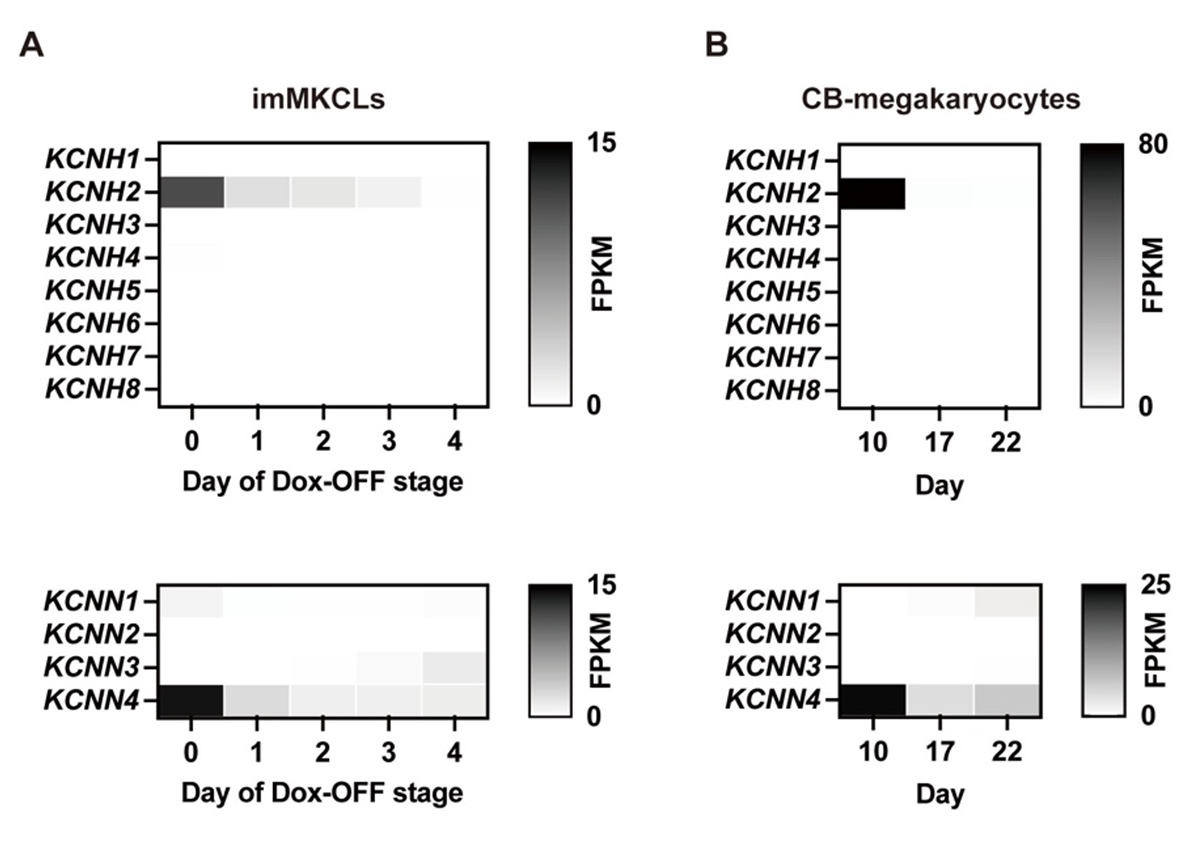
図2:(A)Dox-OFF条件下におけるimMKCLおよび(B)ヒト臍帯血造血幹細胞由来巨核球(CB-MK)のRNA発現プロファイル。KCNH2(hERG、致死的な不整脈を引き起こすLong QT症候群の原因遺伝子)およびKCNN4は、両細胞において増殖期から成熟期への移行過程で一過性に発現が上昇し、その後減少するパターンを示した。機能解析の結果、KCNN4の阻害のみが血小板産生の有意な抑制を引き起こした。
候補因子の中で、KCNN4は特異的阻害剤(SenicapocまたはTRAM-34)あるいはshRNAによるノックダウンで機能抑制したところ、血小板前駆体(プロプレートレット)形成が著しく阻害され(図3)、止血機能を有するCD41+CD42b+血小板の産生数は20〜40%にまで減少しました。
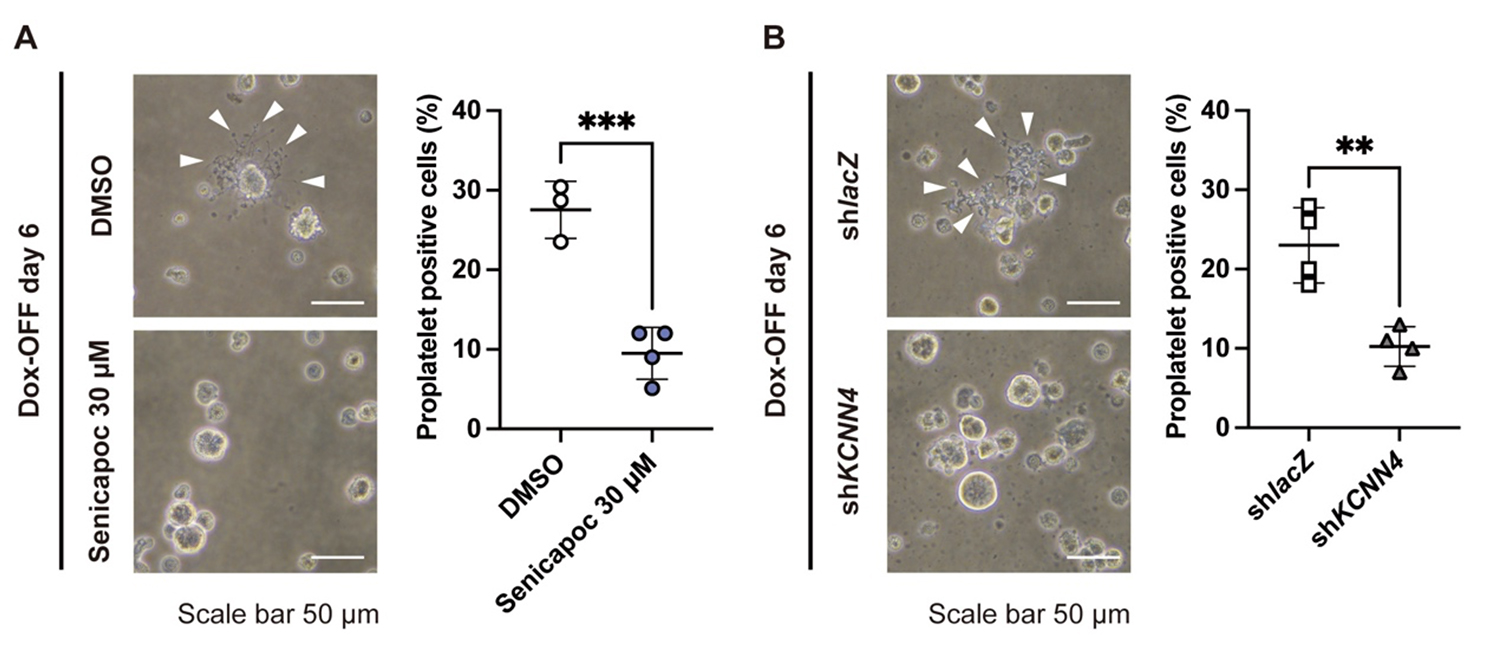
図3:Dox-OFF条件下で6日間培養したimMKCLにおける、血小板前駆体(プロプレートレット)形成の位相差顕微鏡像。
(A)30 μMのSenicapoc(KCNN4阻害剤)処理群および溶媒対照(DMSO)群。
(B)KCNN4ノックダウン(shKCNN4)およびコントロール(shLacZ )imMKCL。白矢頭は形成されたプロプレートレットを示す。スケールバー:50 μm。
それぞれの右側の棒グラフは、各条件におけるプロプレートレット数の定量結果を示す。KCNN4の阻害またはノックダウンにより、血小板形成過程の一段階であるプロプレートレット形成が有意に抑制された。
さらに、細胞骨格およびミトコンドリア機能の解析から、KCNN4活性の抑制は巨核球成熟の初期から後期にかけて、微小管構造およびその形成に関与するチューブリン(tubulin)の正常な分布を妨げることが分かりました。また、ミトコンドリアの偏在化(図4)、ミトコンドリア膜電位(MMP)の低下も併せて観察されました。これらの細胞内構造異常の背景には、活性酸素種(ROS)の異常蓄積が関与していることも明らかとなりました。
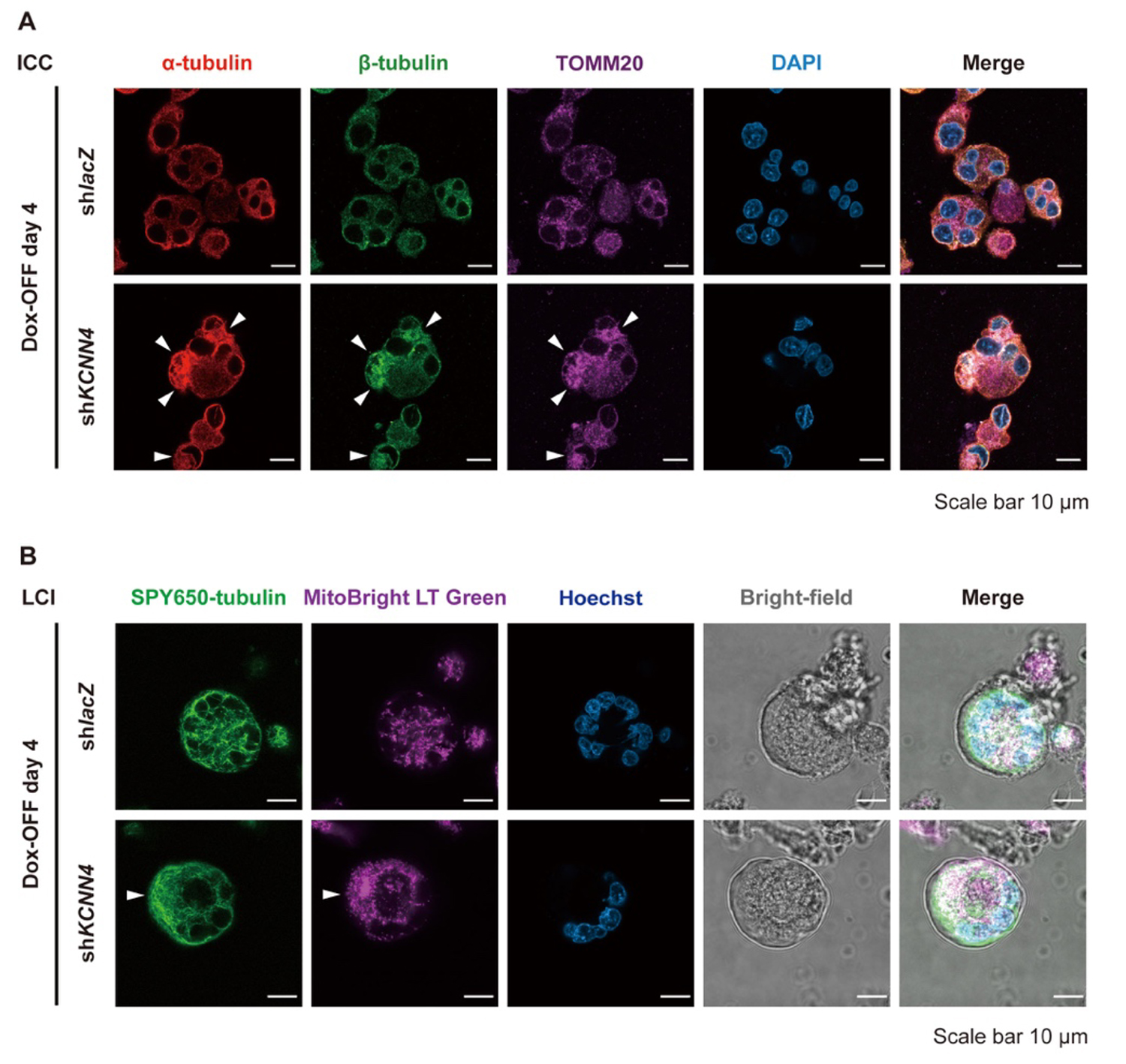
図4:KCNN4 ノックダウンしたimMKCLにおけるミトコンドリアの障害と微小管構造の変化。
(A)Dox-OFF期4日目におけるコントロール(shLacZ )およびKCNN4ノックダウン(shKCNN4)imMKCLの代表的免疫細胞化学(ICC)像。
(B)同条件下でのライブセルイメージング(LCI)画像。
白矢頭は、shKCNN4 処理群においてチューブリン(tubulin)およびミトコンドリアが偏った局在を示している箇所を指す。
さらに、このKCNN4が関与する血小板造血機構は、ヒト臍帯血造血幹細胞由来の巨核球(CB-MK)においても同様に確認され、KCNN4の機能がiPS細胞由来モデルと生体由来細胞モデルの双方で寄与していることが示されました。
以上の結果から、KCNN4によるK+流出が、微小管リモデリングおよびミトコンドリアの恒常性維持を協調的に制御することで、血小板産生を支えているという新たな分子メカニズムが浮かび上がりました。
本研究により、KCNN4を介したK+の排出が、巨核球における細胞骨格のリモデリングおよび、それと密接に連関するミトコンドリア機能の保護を通じて、血小板産生を制御する新たなメカニズムを担っていることが明らかとなりました。今後は、KCNN4活性の精密な制御により、iPS細胞由来血小板の製造工程における培養液の最適化やスケールアップ時の品質維持が可能となるほか、血小板減少症に対する新たな治療法の開発にもつながることが期待されます。
- 論文名
KCNN4-mediated potassium ion efflux maintains mitochondrial functions leading to platelet biogenesis - ジャーナル名
Journal of Thrombosis and Haemostasis - 著者
Qihao Chen1, Sou Nakamura1*, Takuya Yamamoto1,2,3, Naoya Takayama4, Naoshi Sugimoto1, Koji Eto1,4*
*:共同責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所革新知能統合研究センター(AIP)
- 千葉大学大学院医学研究院
本研究は、下記機関より支援を受けて実施されました。
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
「再生医療用iPS細胞ストック開発拠点」- 再生・細胞医療・遺伝子治療実現加速化プログラム
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」 -
新エネルギー・産業技術総合開発機構(NEDO)
経済安全保障重要技術育成プログラム/有事に備えた止血製剤製造技術の開発・実証「汎用性の高い人工血小板の開発」(課題番号:JPNP23028) -
日本学術振興会(JSPS)
- 基盤研究(S)(21H05047)
- 萌芽研究(23K18299)
- 若手研究(22K18169)
- 科学技術振興機構(JST) 創発的研究支援事業(FOREST)(JPMJFR225K)
- iPS細胞研究基金
- キヤノン財団
注1)血小板
止血に重要な役割を果たす核のない直径2〜3μmの血液細胞で、巨核球から分離して作られる。トロンビン等の作用で凝集する性質がある。
注2)iPS細胞由来巨核球株(imMKCL)
巨核球は造血幹細胞から作られ、血小板を生み出す細胞。巨核球は成熟すると核分裂はするが細胞分裂はしないという特殊な分裂を行い、大型で多核の細胞になる。imMKCLは、iPS細胞から出来る巨核球に遺伝子導入をすることにより樹立された、増幅と成熟の切り替えが可能な細胞株。
注3)血小板前駆体(プロプレートレット)
成熟に伴って巨核球から伸びる細胞質の突起構造体で、先端から血小板が千切り出される。






















