
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月2日
微小管の不安定化がiPS細胞由来巨核球からの血小板産生を促進
-最終分化段階における新たなメカニズムを解明-
ポイント
- 血小板産生を促進する薬剤のスクリーニングにより、微小管阻害剤がプロプレートレット(血小板前駆体)の形成を促し、血小板の産生を促進することを見出した。
- 乱流刺激と微小管阻害剤(ビンクリスチン)を組み合わせることで、iPS細胞由来血小板の産生数が最大で約3倍に増加した。
- 今回の手法で産生された血小板の止血能は、無添加条件で製造された血小板と同等であることが確認された。
中村英美里大学院生および江藤浩之教授(CiRA臨床応用研究部門)、George Daley教授(ハーバード大学医学部 学部長)、Thorsten Schlaeger博士(ボストン小児病院/ハーバード大学医学部)らの国際共同研究グループは、iPS細胞からの血小板産生に関して、新たなメカニズムを明らかにしました。
本研究では、不死化巨核球細胞株(imMKCL)注1)を用いて、従来の定説とは異なり、血小板が最終的に放出される段階において、微小管注2)構造の脱重合注3)(構造の分解)がむしろ血小板の産生を促進することを発見しました。
特に、微小管脱重合を促進するビンカアルカロイド系抗がん剤であるビンクリスチンおよびビンブラスチン注4)を用いたところ、iPS細胞由来血小板の産生量が最大で3倍に増加しました。加えて、これら薬剤を添加して製造した血小板は、マウスモデルにおける輸血試験で、止血機能が保持されていることが確認されました。
本成果は、巨核球の成熟および血小板の生成における微小管構造の役割を再考するものであり、従来「微小管の維持が不可欠」とされてきた定説に一石を投じる内容です。同時に、iPS細胞由来血小板の産生効率を高める新たな手法として、今後の実用化や臨床応用への貢献が期待されます。
本研究成果は、2025年6月25日に国際科学誌「PLOS ONE」にオンライン掲載されました。
輸血用血小板は、現在その100%を献血ドナーに依存しており、保存期間も最大5日間と非常に短いため、需要と供給のバランスを柔軟に調整することが難しい医薬品の一つです。
CiRAの江藤研究室では、iPS細胞由来血小板製剤の開発を進めてきました。その一環として、米国ハーバード大学・ボストン小児病院のThorsten Schlaeger博士およびGeorge Daley教授の研究グループと連携し、米国内での治験実施を目指した共同研究を行ってきました。
当該プロジェクトには、スタートアップ企業による研究投資も行われていましたが、同企業による治験計画は途中で中止されました。ただし、血小板を効率的に製造するための基礎的な検証は、米国の研究グループによって継続されていました。
その後、江藤研究室では米国側からの要請に基づき、血小板放出促進剤のスクリーニングアッセイにより見出された微小管阻害剤(ビンカアルカロイド系抗がん剤)であるビンクリスチンおよびビンブラスチンについて、iPS細胞由来巨核球への実用的な使用濃度の検証実験および、得られた血小板の輸血適合性に関する実証実験を実施しました。
これまで本研究分野では、血小板の放出過程も含めて、巨核球の全成熟段階において安定的かつ強固な微小管構造が不可欠であると考えられてきました。しかし今回の研究では、iPS細胞由来血小板産生の効率化を目的として実施した薬剤スクリーニングとその効果検証を通じて、従来の常識とは異なる新たな血小板生成メカニズムの可能性が示唆されました。
1)血小板産生の向上をもたらす化合物の同定
本研究ではまず、不死化巨核球細胞株(imMKCL)の成熟後期において、さまざまな化合物ライブラリがiPS細胞由来血小板の産生に与える影響を検証しました。指標として、血小板放出前段階であるプロプレートレットの形成割合を用いました。その結果、微小管の脱重合を促進する2種類の化合物が、プロプレートレットの割合を有意に増加させることを明らかにしました。

図1 微小管脱重合を促進する化合物がプロプレートレットを増加させる
左・中央:各化合物を添加したimMKCLを培養し、細胞の半径および細胞面積の割合からプロプレートレットの形成を定量した。その結果、プロプレートレット(赤)が多く観察されたウェルにおいて、添加された化合物が微小管脱重合促進剤であることを確認した。
右:特定された2剤であるビンブラスチンおよびビンクリスチンをimMKCLに添加し、プロプレートレットの割合が顕著に増加することを、再現性をもって確認した。
2)iPS血小板産生が向上する乱流培養では、微小管構造が減少傾向を示す
血小板産生の促進には、適度な乱流刺激を与えることが重要であることが知られています。本研究では、以下の3つの培養条件を比較しました。
- 静置条件(培養皿)
- 中程度の乱流刺激(フラスコ)
- 高度な乱流刺激(VerMES™装置)
これらの条件下でimMKCLを6日間培養し、微小管の蛍光染色を用いて構造の変化を観察したところ、乱流条件が強くなるにつれて微小管の蛍光シグナルが減少する傾向があることが分かりました。これは、微小管構造が乱流刺激によって減弱する可能性を示唆しています。
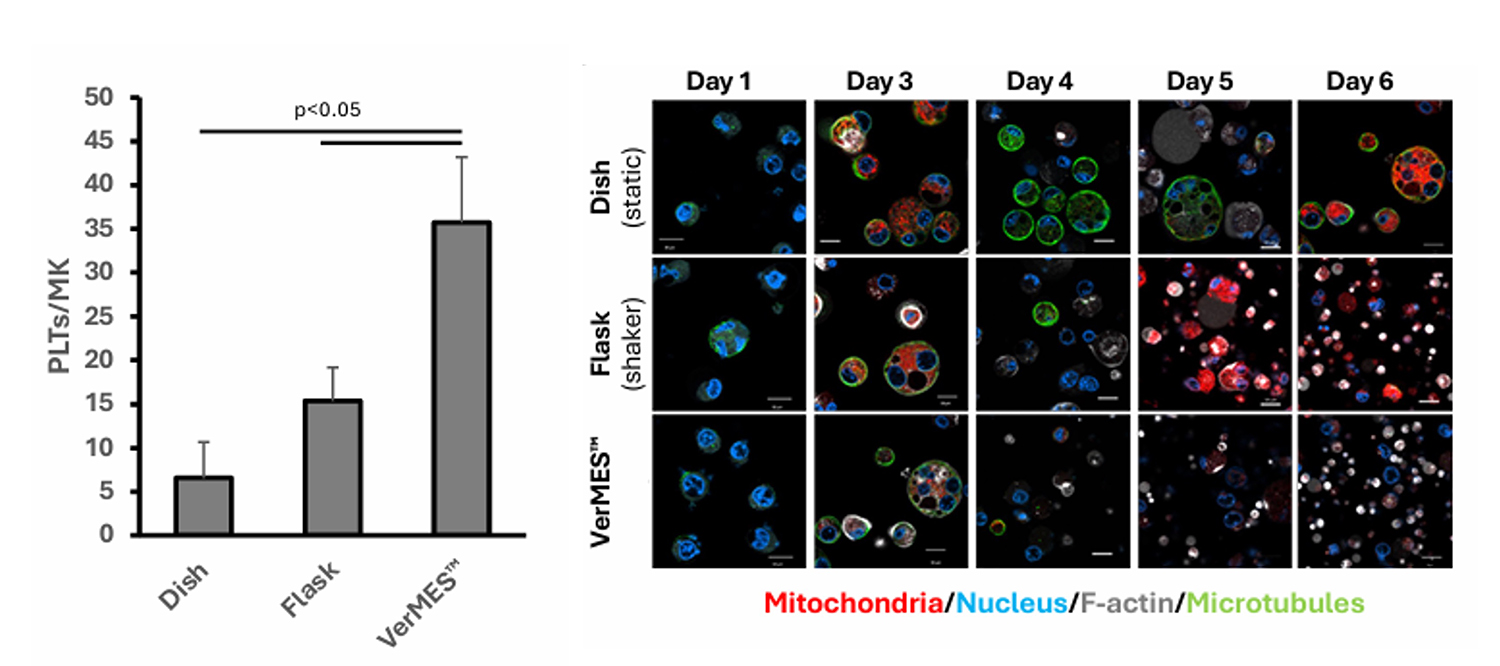
図2 血小板産生向上と反対に微小管は減少傾向にある
左:血小板産生数は静置培養⇒乱流⇒最適乱流の順に向上する。
右:血小板産生数が高い乱流培養条件下にある巨核球では微小管が減少することが確認された。
3)ビンクリスチンの添加により、血小板産生がさらに向上し、止血能も維持される
さらに、成熟過程のimMKCLに対してビンクリスチンを低濃度(10 nM)で添加することで、血小板の産生効率がさらに高まることを確認しました。VerMES™を用いた乱流培養条件下において、血小板産生数は1.7倍から最大で3.3倍まで増加しました。
また、この条件で産生された血小板を血小板減少症モデルマウスに輸注し、止血能を評価したところ、コントロール血小板と同等の止血効果を示しました(VCR Low条件)。
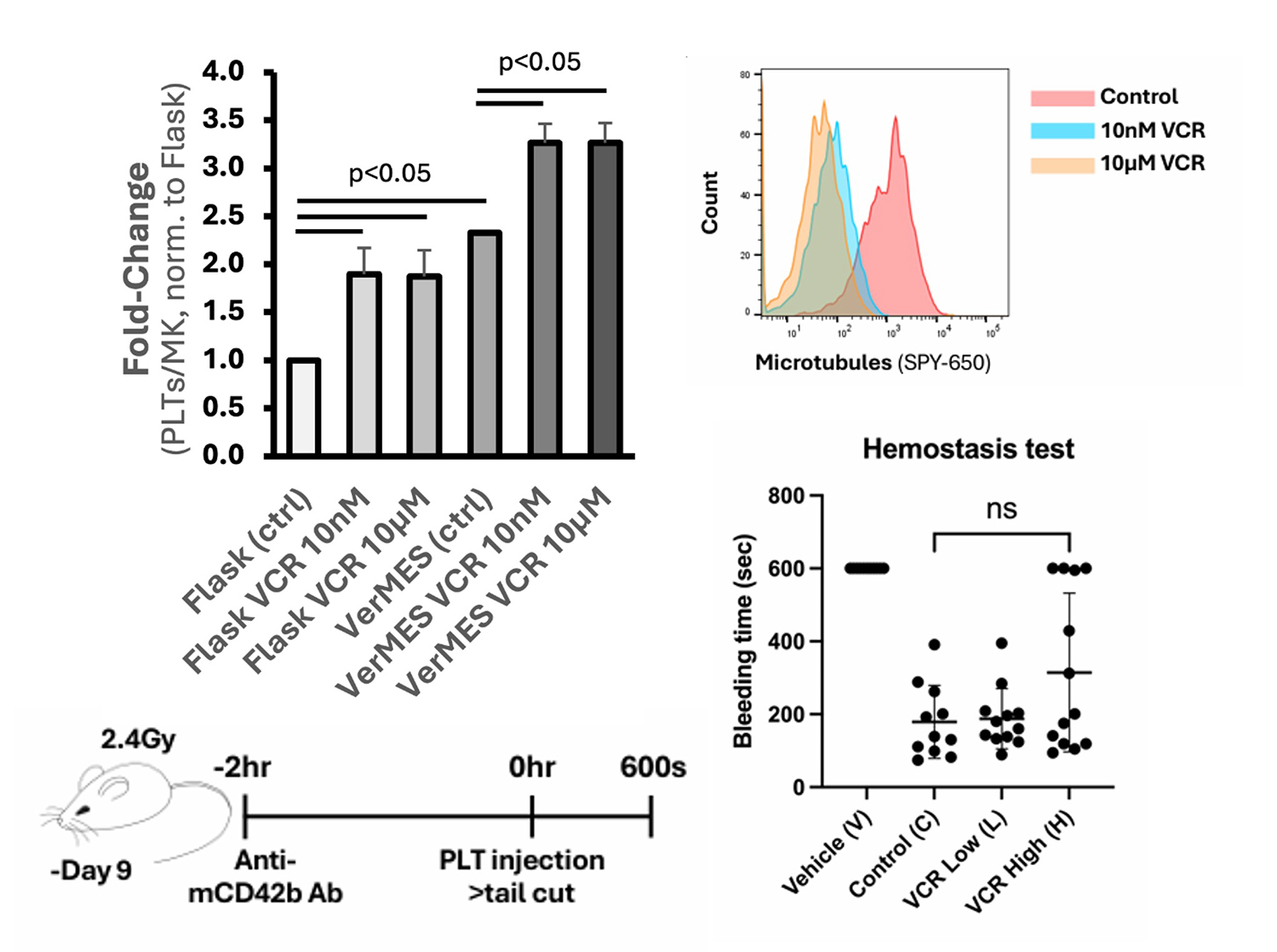
図3 乱流刺激下のimMKCLにビンクリスチンを添加し、
産生の向上が確認された血小板は止血が可能である
左上:ビンクリスチンを乱流攪拌培養中のimMKCLに添加した結果、血小板産生数が1.7倍から最大で約3倍まで上昇することが確認された。
右上:ビンクリスチンを添加したimMKCLでは、微小管の蛍光シグナルが減少しており、微小管脱重合が促進されていると考えられる。
左下・右下:ビンクリスチン添加条件で産生された血小板を血小板減少症モデルマウスに輸注した結果、コントロールのiPS細胞由来血小板と同等の止血能を示した。
本研究では、血小板産生の効率化という観点から、iPS細胞由来巨核球細胞株(imMKCL)からの血小板産生において、微小管阻害剤ビンクリスチンの効果に加え、乱流刺激によって誘導される微小管の脱重合が重要な役割を果たすことを明らかにしました。これまで、血小板の放出を含む巨核球の全成熟過程においては、安定的かつ強固な微小管構造が不可欠であるという学説が広く信じられてきました。しかし、本研究の結果は、微小管構造が成熟の前半には必要である一方、後半ではむしろその脱重合が血小板産生を促進するという新たな知見を示しています。これらの成果は、今後のiPS細胞由来血小板製剤の製造工程において、新たなプロトコルの確立に活用されることが期待されます。一方で、本研究では、なぜ微小管の脱重合が血小板産生の増加につながるのかという分子メカニズムまでは明らかにすることができませんでした。血小板産生のプロセスは依然として未解明な部分が多く残されており、今後も詳細なメカニズムの解明に向けた研究の継続が必要です。
- 論文名
Association of microtubule destabilization with platelet yields in terminally differentiating hiPSC-derived megakaryocyte lines - ジャーナル名
PLOS One - 著者
Emiri Nakamura1, Yasuo Harada1,2, Trevor Bingham3, Christian Skorik3,4, Anjali Jha3,5, John Atwater3,6, Natsumi Higashi1, Kosuke Fujio1,2, Mariko Ishiguro1, Haruki Okamoto1, Leonard I. Zon3, George Q. Daley3, Andrew L. Frelinger7, Koji Eto1, Thorsten M. Schlaeger3* - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 大塚製薬株式会社
- Boston Children's Hospital Stem Cell Program and Harvard Medical School
- STEMCELL Technologies
- Harvard T.H. Chan School of Public Health
- NYU Grossman School of Medicine
- Center for Platelet Research Studies at Boston Children's Hospital
本研究は、下記機関より支援を受けて実施されました。
- Boston Children's Hospital 幹細胞プログラム
- 米国国立糖尿病・消化器病・腎臓病研究所(NIDDK)(助成番号 U54DK110805)
- Megakaryon Inc.
-
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム「再生・細胞医療・遺伝子治療研究中核拠点」
- iPS細胞研究基金
- 日本学術振興会(JSPS)科研費 基盤研究(S) 研究課題番号:21H05047(研究代表者: K.E.)
- メガカリオン株式会社共同研究プロジェクト資金(Harvard 大学側が受領:E. K., A. F., T. S.)
注1)不死化巨核球株(imMKCL)
iPS細胞から樹立された、遺伝子改変により無制限に増殖可能な巨核球前駆細胞株。
注2)微小管
チューブリン二量体が重合して形成される細胞骨格の一種。細胞内輸送や形態の維持、細胞分裂などにおいて重要な役割を果たす。
注3)脱重合
重合状態にある微小管が分解され、チューブリン二量体へと戻る過程を指す。この過程により、微小管の構造や機能が動的に変化する。
注4)ビンクリスチン/ビンブラスチン
チューブリンの重合を阻害し、微小管を不安定化させる作用をもつ抗がん剤。いずれもビンカアルカロイド系に分類される。
注5)プロプレートレット(血小板前駆体)
巨核球が血小板を放出する直前に形成する、細長い突起状の構造を指す。前駆的な血小板形態であり、血小板産生の最終段階にあたる。






















