
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月7日
単一のmRNAで発現制御の精度を改良した「ハイブリッドmRNAスイッチ」の開発
ポイント
- メッセンジャーRNA(mRNA)注1)から遺伝子発現を誘導するON型スイッチと、発現を抑制するOFF型スイッチを単一のmRNAに統合した「ハイブリッドmRNAスイッチ」を開発した。
- ハイブリッドmRNAスイッチは、2種類の異なるマイクロRNA(miRNA)注2)を認識して、遺伝子発現を制御する。
- ハイブリッドmRNAスイッチは、従来技術の課題となっていた非標的細胞でタンパク質が合成されてしまう「翻訳漏洩」を大きく抑えることができた。
- マウスの実験により、ハイブリッドmRNAスイッチが標的とする臓器の細胞で特異的にタンパク質の合成を誘導する発現選択性をもつことを実証した。
齊藤博英 教授(京都大学iPS細胞研究所(CiRA)、東京大学定量生命科学研究所)、正木魁人 大学院生(京都大学大学院医学研究科)らの研究グループは、細胞の種類に応じて遺伝子発現を精密に制御できる単一のmRNA分子からなるハイブリッドmRNAスイッチを開発し、マウスの生体内でも機能することを示しました。
本研究では、細胞内のマイクロRNA(miRNA)を認識し遺伝子発現を制御するmRNAスイッチのON型とOFF 型それぞれの機能モジュールを単一のmRNA配列に組み込んだハイブリッド型のmRNAスイッチを設計しました。ON型とOFF型の機能モジュールは、どちらも細胞内のmiRNAを認識する部位を含みます。そのため、ハイブリッド型では一つのmRNAスイッチで二種の異なるmiRNAを同時に検出することが可能です。
実験の結果、ハイブリッド型によりmRNAスイッチ上のタンパク質合成を二重に制御することで、従来のON型スイッチと比較して非標的細胞でタンパク質が合成されてしまう「翻訳漏洩」を大幅に抑制できることがわかりました。さらに、従来の単独型と比べて、ハイブリッド型はマウスの生体内でも標的細胞のある組織をより高精度に選択してタンパク質合成を制御できることを確認しました。マウスの体内でRNAスイッチの機能を確認したのは本研究が初めてです。単一のmRNAによる遺伝子発現制御の精度の向上を実現するハイブリッド型の技術は、今後、高い安全性や製造性が求められるmRNA医薬の開発に役立つことが期待されます。
この研究成果の校正済み論文(最終版)が、2025年7月1日に、国際学術誌「Molecular Therapy Nucleic Acids」でオンライン公開されました。
mRNAは細胞内のゲノムに組み込まれる可能性が低く、細胞の中で目的のタンパク質の発現を誘導できるため、ワクチン開発を皮切りにさらなる医薬応用が期待されています。mRNA医薬の安全性を高め、より多くの病気の治療に応用するためには、標的の細胞や組織でのみmRNAを機能させる制御技術が必要です。
研究グループは、これまでに標的の細胞で特異的に発現しているmiRNAやタンパク質などの生体分子を検知して、タンパク質を合成するmRNAスイッチの技術開発を進めてきました。細胞によって存在するmiRNAの種類が異なります。標的細胞に存在するmiRNAによってmRNAの切断を誘導する配列をmRNAに組み込むことで、標的細胞で遺伝子発現を誘導するmiRNA応答性mRNAスイッチが構築できます。しかし、mRNAスイッチに特異的に作用するmiRNAが存在しない非標的細胞でも、mRNAスイッチからタンパク質が合成される「翻訳漏洩」が課題となっていました。標的細胞でのみ遺伝子発現を誘導できる精密な発現制御を実現するため、研究グループでは複数のスイッチmRNAの同時利用による解決策を開発してきました(CiRAニュース2022年1月6日、CiRAニュース2025年7月1日)。
本研究では、翻訳漏洩の課題に対して、複数のmRNAの組み合わせではなく、単一のmRNAによって性能改善を実現する方法を新たに開発しました。また、これまでの研究では主に細胞培養によってRNAスイッチの性能を評価していましたが、今回、マウスを用いて初めてmRNA医薬としての利用可能性を検証し、ハイブリッドmRNAスイッチによって臓器間での発現制御ができることを示しました。
1)ON型およびOFF型スイッチのハイブリッド化による発現選択性の向上
5ʹ非翻訳領域(5ʹUTR)注3)に存在する既存のOFF型スイッチの機能モジュールであるmiRNA結合部位(図1A中:黄色)と、ポリA配列に隣接するON型スイッチの機能モジュールであるmiRNA結合部位および余剰配列カセット(図1A中:青色)を1本のmRNA分子に統合した「ハイブリッドmRNAスイッチ」(以下、ハイブリッドスイッチ)を設計しました(図1A)。
ハイブリッドスイッチは、2箇所のmiRNA結合部位でそれぞれ異なるmiRNAを検出することができます。非標的細胞で高発現するmiRNA(miRNAOFF)を5ʹ非翻訳領域にあるOFF型スイッチのmiRNA結合部位で検出し、標的細胞で高発現するmiRNA(miRNAON)をポリA配列に隣接するmiRNA結合部位で検出するように設計しました。これにより、非標的細胞ではOFF型とON型の機能モジュールの相乗効果により、翻訳漏洩を抑える効果が期待できます(図1B)。
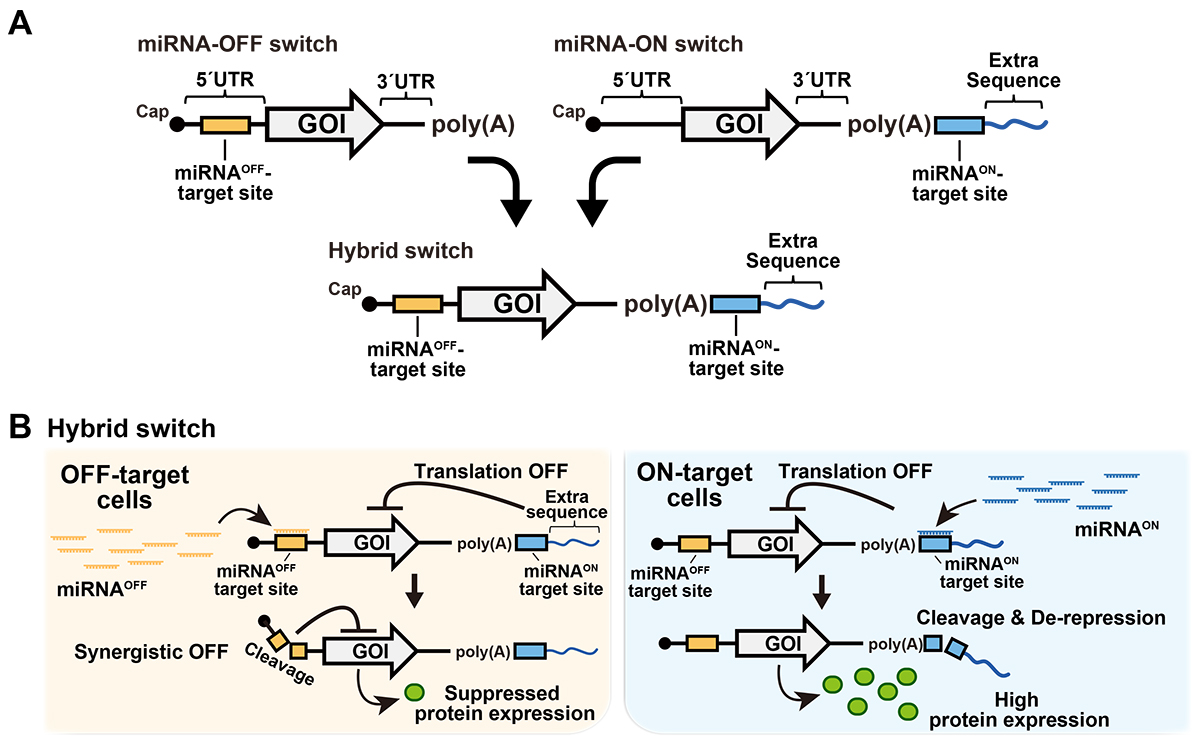
図1. ハイブリッドスイッチの概略図
A:OFF型とON型スイッチの両方の機能モジュール(OFF型:黄色、ON型:青色)を1本のmRNA配列に組み込んだハイブリッドスイッチの設計。
B:非標的細胞(左:miRNAOFF高発現)と標的細胞(右:miRNAON高発現)におけるハイブリッドスイッチからのタンパク質合成の制御。非標的細胞では、高発現するmiRNAOFFによるmRNAの5ʹ非翻訳領域の切断と、余剰配列(Extra sequence)による翻訳抑制の二重の抑制機構が作動する。標的細胞では、miRNAONによってmRNAのポリA配列付近が切断され、余剰配列による翻訳抑制が解除されることで、タンパク質合成が誘導される。
次に、HeLa細胞を非標的細胞、iPS細胞を標的細胞として、ハイブリッドスイッチの性能を評価しました。HeLa細胞で高発現しているmiRNA(let-7b-5p, miRNA-27a-3p, miR-98-5p)の結合部位をもつOFF型スイッチ(単独型)、およびiPS細胞で高発現しているmiRNA(miRNA-302a-5p)の結合部位をもつON型スイッチ(単独型)、両方の機能モジュールをもつハイブリッドスイッチを設計しました。各mRNAスイッチを2種類の細胞に導入して、スイッチ上に組み込んだ緑色蛍光タンパク質(EGFP)の発現レベルを比較しました。
その結果、OFF型およびON型のスイッチは非標的細胞(HeLa)でEGFP発現(翻訳漏洩)がみられた一方で、ハイブリッド型では、非標的細胞での翻訳漏洩を大きく抑制できることがわかりました(図2A-C)。これらの結果から、ハイブリット型により標的細胞と非標的細胞のEGFP発現比で表される発現選択性(図中:ON/OFF Ratio(iPSC/HeLa))を大幅に向上させたことを示しました(図2A下)。
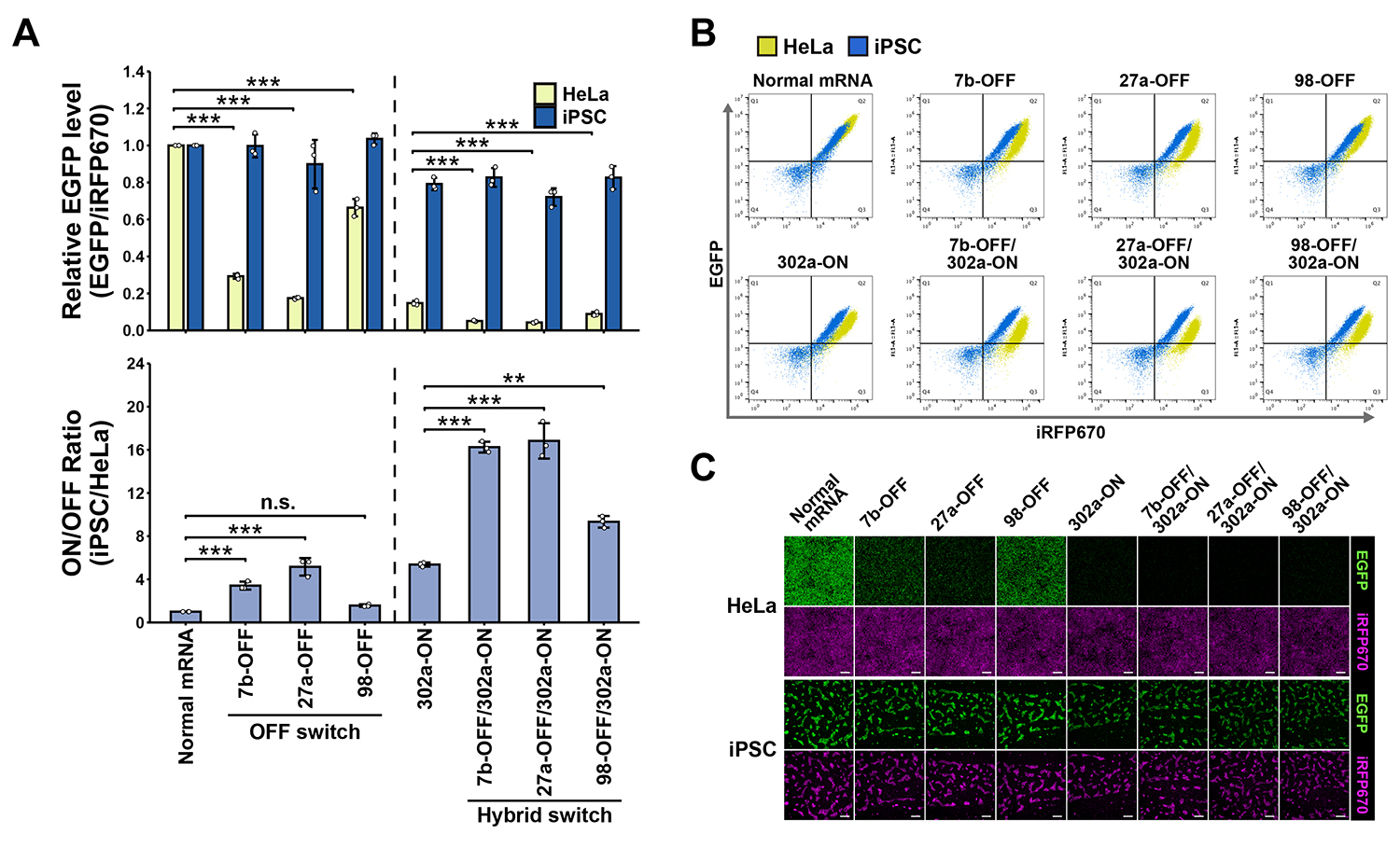
図2. 培養細胞における各種スイッチのタンパク質発現制御性能の評価
A:HeLa細胞およびiPS細胞におけるタンパク質(EGFP)発現レベル(上)とON状態 (iPS細胞) とOFF状態 (HeLa) の発現比(下)。
B:図2Aで示す実験のフローサイトメトリー解析におけるプロット図。各点が一つの細胞のタンパク質発現レベルを示す。
C:図2Aで示す実験の蛍光画像。
2)マウス個体における組織選択的なタンパク質発現の制御
次に、マウス体内で特定の臓器を標的とした発現制御が可能かを検証しました。脂質ナノ粒子注4)に封入したmRNAを尾静脈投与したところ、肝臓および脾臓でタンパク質の合成が誘導されました。そこで、肝臓を標的臓器、脾臓を非標的臓器として各種スイッチの発現選択性を評価しました。肝臓で高発現しているmiRNA-122-5pあるいは、脾臓構成細胞で高発現しているmiRNA-142-3pの結合部位をもち、発光タンパク質の遺伝子Flucの配列をもつON型、OFF型、そしてそれらを統合したハイブリッド型のスイッチを設計しました(図3A)。
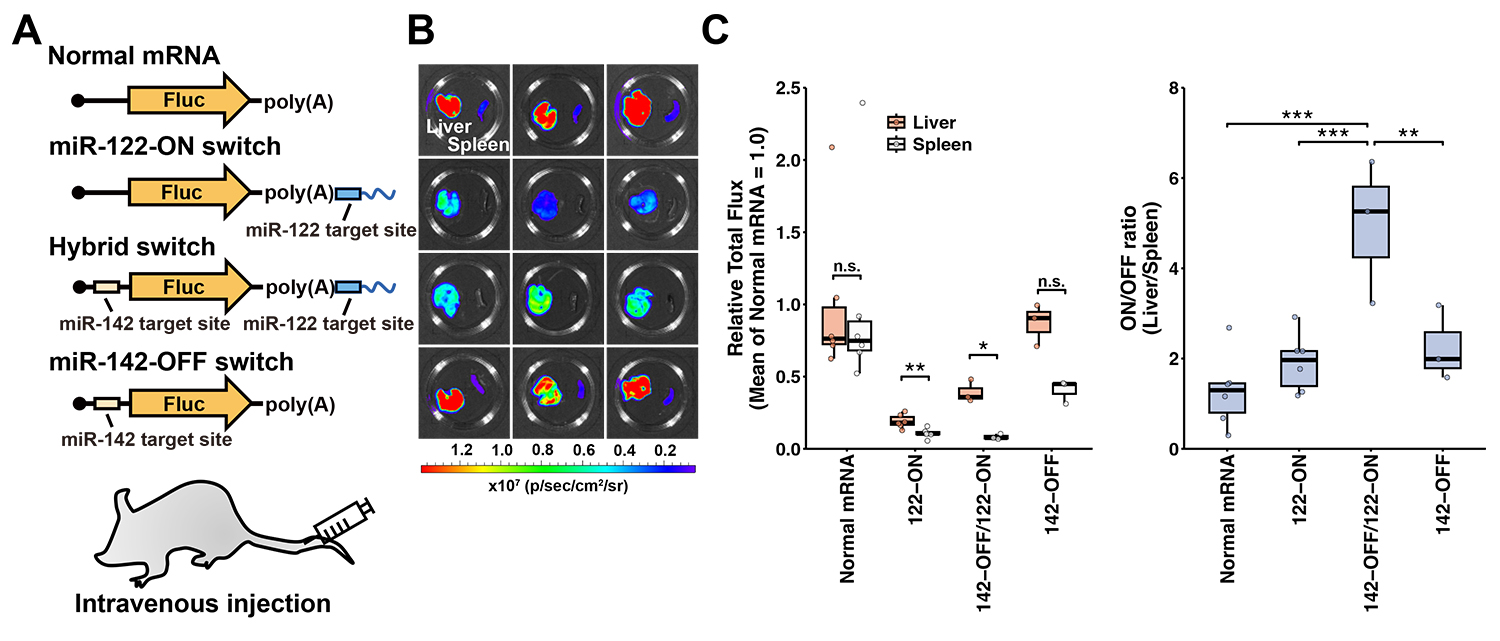
図3. 肝臓と脾臓での発現制御性能の評価
A:設計したmRNAスイッチとマウスへの投与の概略図。Fluc遺伝子配列をもつ各種スイッチをマウスの尾静脈から投与した。
B:投与して6時間後の肝臓と脾臓でのFluc活性シグナル。
C:図3Bで示す実験のnormal mRNAで標準化したシグナル平均値(左)と標的臓器(肝臓)と非標的臓器(脾臓)の活性比(右)。
これらのmRNAスイッチをマウスに投与した結果、ON型、OFF型のどちらも、非標的の脾臓と比べて、標的である肝臓で高いタンパク質発現を示すことがわかりました。この結果から、これまでに開発してきた従来のmiRNA応答性スイッチが生体内でも適切に標的miRNAに応答し、発現制御が可能であることを初めて確認することができました(図3B, 3C)。
さらに、ハイブリッドスイッチが最も高い発現選択性を示したことから、個体を用いた臓器間の評価においてもハイブリッド化により発現制御の精度を高めることができることがわかりました(図3C右)。このことは、単独型のスイッチで標的の選択性が不十分な場合に、ハイブリッド化が有用な戦略であることを示しています。
ON型およびOFF型のmRNAスイッチの要素を単一のmRNAに統合し、2種の異なるmiRNAの検出が可能なハイブリッドmRNAスイッチを開発しました。ハイブリッドスイッチは、従来型のスイッチと比較して培養細胞だけでなく、マウス生体内でも高い発現選択性をもつことを示しました。
ハイブリッドスイッチは単一分子のmRNAであるため、低い設計コストで精密な発現制御を可能とするRNA技術であり、安全性と製造性を兼ね備えたRNA医薬開発のための有力な設計戦略となることが考えられます。
- 論文名
MicroRNA-Responsive ON-OFF Hybrid mRNA Switch for Precise Protein Expression Control - ジャーナル名
Molecular Therapy Nucleic Acids - 著者
Kaito Masaki1,2, Yoshihiko Fujita1, Hirohide Saito1,3*
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 東京大学定量生命科学研究所
本研究は、下記機関より支援を受けて実施されました。
-
日本学術振興会(JSPS)
- 科研費(22KJ1892, JP20H05626 )
-
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」
「次世代mRNAテクノロジーを活用した細胞・遺伝子治療技術の開発」 -
科学技術振興機構(JST)
- 戦略的創造研究推進事業(JPMJCR23B3)
- iPS細胞研究基金
注1)メッセンジャーRNA(mRNA)
細胞内でタンパク質が合成される際にアミノ酸配列を指定する役割をもつ。DNA上の遺伝子情報はメッセンジャーRNAに転写された後メッセンジャーRNAからタンパク質へと翻訳され、細胞内で機能する。
注2)マイクロRNA(miRNA)
20〜30塩基長の短鎖ノンコーディング(タンパク質をコードしていない)RNA。細胞内タンパク質と協調することで、相補的な配列をもつmRNAと結合し、そのmRNAからのタンパク質発現を抑制する。
注3)5' 非翻訳領域(5'UTR)
タンパク質コード領域の上流にあるmRNAの非翻訳部分。そのmRNAの翻訳活性に重要な影響を与える。
注4)脂質ナノ粒子
イオン化脂質、コレステロール、リン脂質、PEG化脂質で構成されたナノスケールのキャリアで、mRNAを保護しつつ細胞内へ効率的に輸送する。






















