
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年7月14日
iPS細胞から成人型に近い「成熟心外膜」を効率的に創出する新技術の開発
〜心臓再生医療の新たな可能性を拓く〜
ポイント
- ヒトiPS細胞から機能的な成熟心外膜を効率的に生成する新手法を確立し、心臓再生医療に新たな可能性をもたらしました。
- mTORシグナル伝達の抑制が心外膜の成熟と休止期状態を誘導する鍵であることを解明し、心臓の発達と修復における重要なメカニズムを明らかにしました。
- 確立した成熟心外膜モデルを活用したスクリーニングにより、心臓再生を促す新たな薬剤候補を同定し、心臓病治療薬の開発を加速させます。
Yu Tian 研究員(CiRA増殖分化機構研究部門、京都大学医学研究科)、ルセナ-カカセ アントニオ 准教授(研究当時:CiRA同部門特命助教、現在:大阪大学)および吉田善紀 准教授(CiRA同部門)らの研究グループは、mTORシグナル伝達の抑制を介してヒトiPS細胞から機能的な成熟心外膜を効率的に生成する新たな手法を確立しました。
従来のin vitroで作られた心外膜細胞は胎児型の段階にとどまり、心外膜の成熟をコントロールする方法は知られていませんでした。また、心筋梗塞などの心臓傷害時に、ヒトの心外膜注1)を再活性化することができれば、心筋組織を再生できる可能性が期待されていますが、成人心外膜を再活性化する方法を研究する方法は限られていました。
そこで、研究グループは、胎児型心外膜においてmTORシグナル伝達注2)を抑制することで休止期状態を誘導し、多段階の心外膜成熟を促進することで機能的に成熟した心外膜をつくることに成功しました。成熟した心外膜細胞はパラクリン効果により心筋細胞の成熟化を誘導することを示しました。
この成熟した心外膜は、成人の心外膜を再活性化するためのモデルとして利用することが可能です。iPS細胞由来の成熟心外膜を用いてハイスループットスクリーニングを行い、成人の心外膜を再活性化する化合物の探索を行いました。このようなアプローチで心外膜細胞の活性を制御する方法を理解することは、効果的な心臓再生に不可欠です。
このように、心臓オルガノイドモデルは、心臓の発生と再生における複雑な心筋細胞-心外膜相互作用を解析するツールとなることが期待されます。
この研究成果は2025年7月1日に「Nature Communications」で公開されました。
心臓の最外層である心外膜は、その発生と再生において重要な役割を担っていますが、生後にはその再生能力が失われ、健康な成人状態では休止期組織となります。しかし、現在のヒトiPS細胞を用いた心外膜細胞の分化プロトコルでは、得られる細胞は胎児段階の増殖状態に留まり、成人心外膜の成熟した機能や再活性化メカニズムをin vitroでモデル化する上で大きな障壁となっていました。
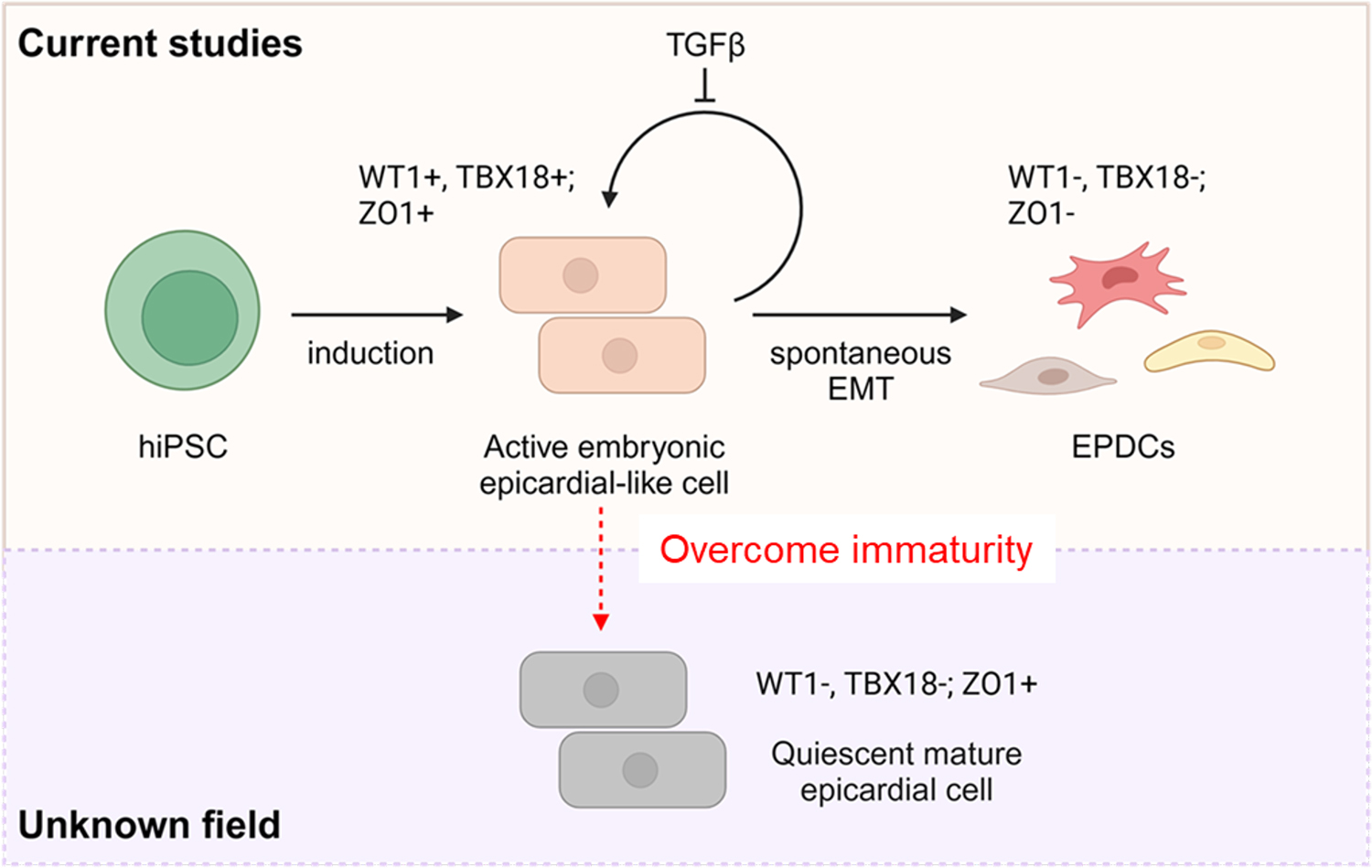
細胞の休止期導入は成人組織の恒常性維持に不可欠なメカニズムであり、mTORシグナル伝達経路がその制御に重要な役割を果たすことは他の細胞種で示唆されています。また、in vivoでの心臓発生過程においてmTORシグナルが低下することが知られており、これが心臓の機能的成熟と関連すると考えられていました 。しかし、ヒト心外膜の活性化および不活性化におけるmTORシグナル伝達の具体的な役割は十分に解明されていませんでした。本研究は、成人期における心外膜の休止期導入と再生能力喪失を制御する分子メカニズムを特定することに焦点を当て、この未解明な課題の解明を目指しました。
1)mTORシグナル抑制による機能的成熟心外膜の効率的な作製
iPS細胞から分化させた心外膜細胞(hiPSC-epi)を、mTOR経路の二重阻害剤であるTorin1で処理しました。処理後に胎児性心外膜のマーカーであるWT1の発現は低下しました。一方、上皮細胞で見られるタイトジャンクションのマーカーであるZO-1の発現は維持されていました。 これらのことから、mTORシグナルを抑制により、成熟した心外膜を作製できるということが確認されました。
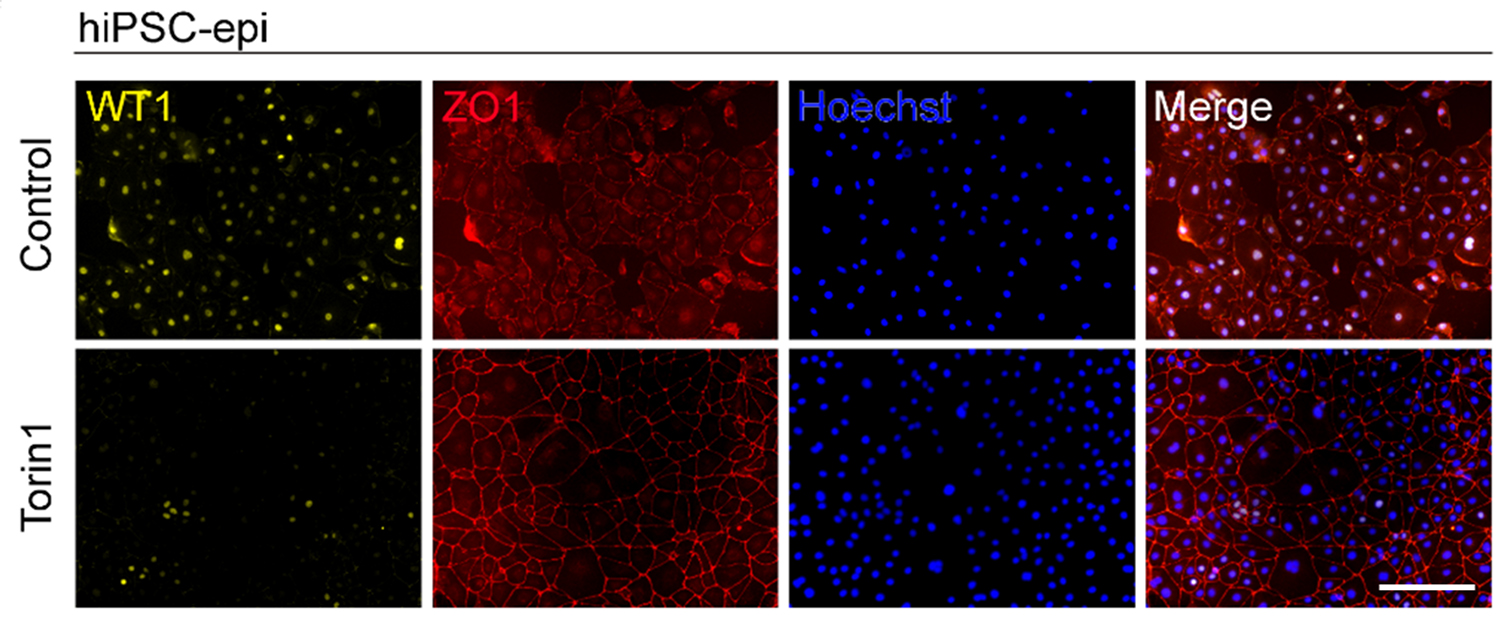
Fig.1 Torin1で処理したヒトiPS細胞由来心外膜細胞の免疫蛍光染色結果
黃:WT1(fetal epicardial marker)、赤:ZO1(細胞同士の接着:タイト結合)、青:Hoechst(核)
2)心外膜の休眠と成熟を制御する主要な分子メカニズムの解明
iPS細胞由来の心外膜細胞を、mTOR複合体1(mTORC1)のみを阻害するRapamycin、またはmTORC1とmTOR複合体2(mTORC2)の両方を阻害するTorin1で処理し、細胞の増殖(MKI67の発現)を調べました(Fig.2)。その結果、Rapamycinでは細胞の増殖を抑えることができませんでした。心外膜の休止期状態への移行とそれに続く成熟プロセスには、mTOR複合体2(mTORC2)が重要な役割を果たすことが明らかになりました。さらに、トランスクリプトーム解析などにより、Torin1処理により発現が変動する転写因子のうち、特にMAFFとYBX3という二つの転写因子が、mTORC2依存的に心外膜の休止期導入と成熟を促進する上で不可欠であることを特定しました。
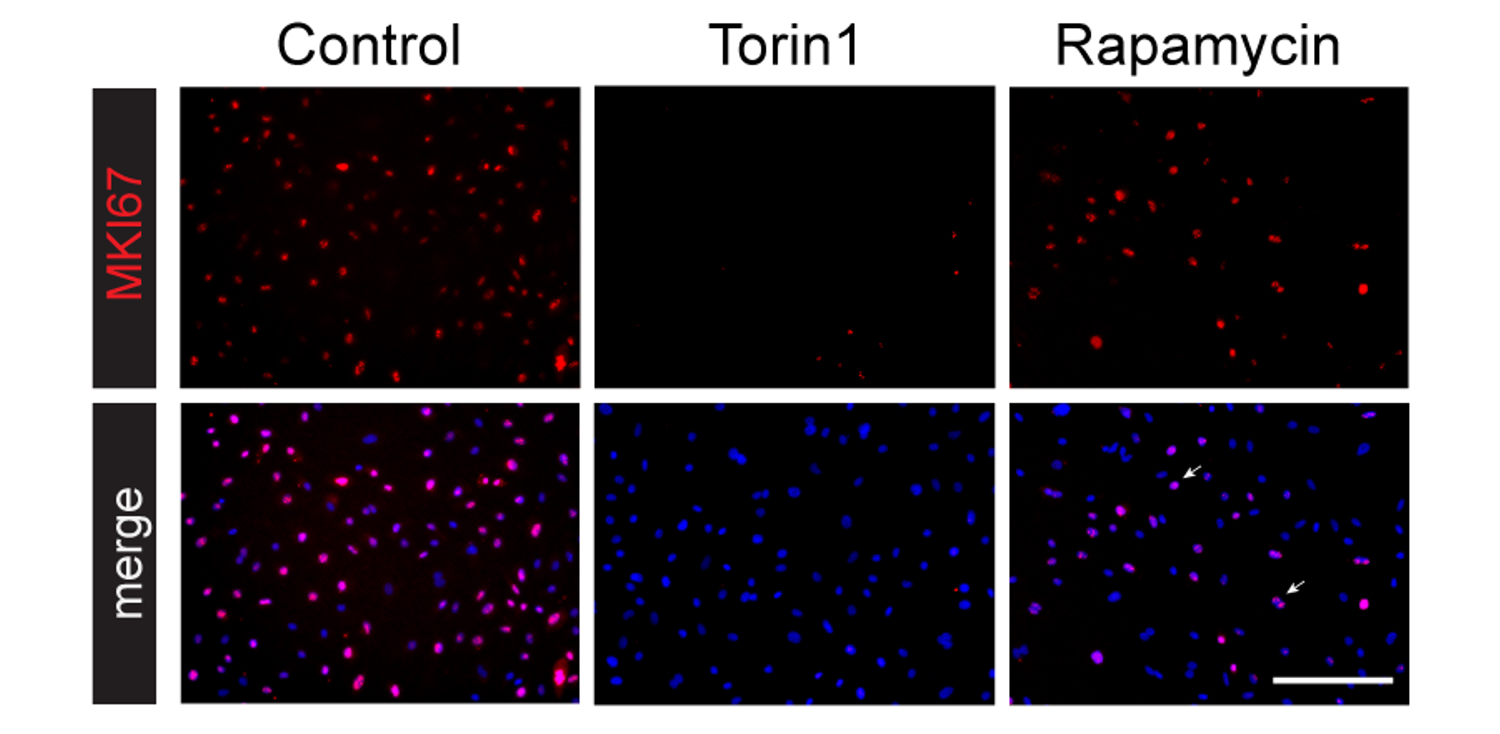
Fig.2 Torin1およびRapamycin処理によるiPS細胞由来心外膜細胞の免疫染色
赤:MKI67(細胞の増殖)、青:Hoechst(核)
3)休止期の心外膜と成熟した心筋細胞を持つ成熟心臓オルガノイドの作製
iPSC 由来の多細胞からなる心臓オルガノイドをTorin1で処理したところ、胎児型心外膜マーカーである WT1の発現を低下させ、成体型心筋トロポニンタンパク質(TNNI3)の発現を増加させるとともに、上皮間葉転換(EMT)活性マーカーのSNAI1を抑制しました(Fig.3)。一方、シングルセルシーケンス解析では、Torin1処理した心臓オルガノイドにおいては、内皮細胞クラスターの出現が確認され、さらに立体構造内において成熟した心外膜細胞および心筋細胞が存在することが裏付けられました。これらの結果から、Torin1処理は、より成体に近い血管構造を有する心臓オルガノイドの形成を促進する効果があることが示されました。
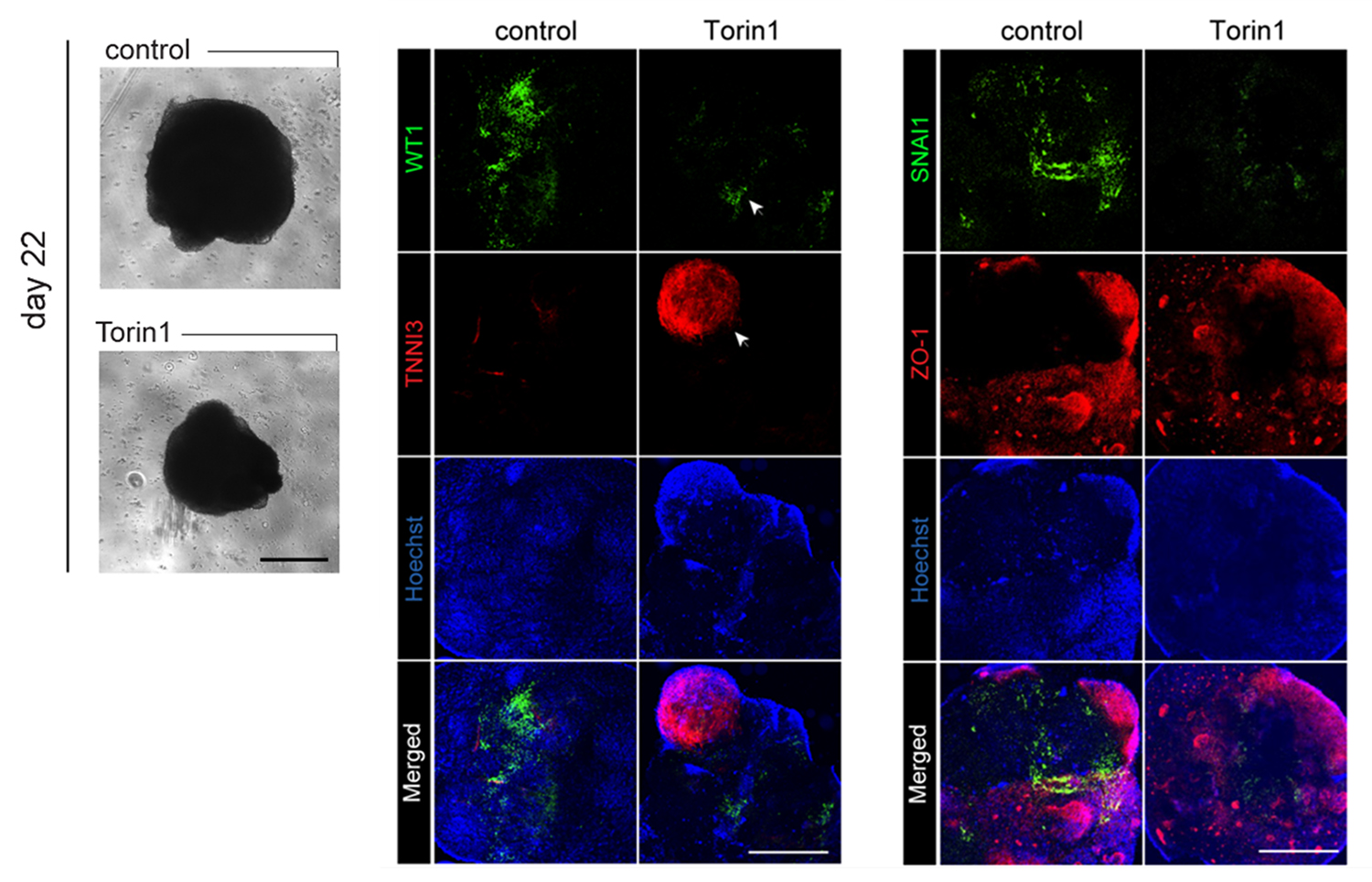
Fig.3 Torin 1で処理した心臓オルガノイド
(左) 緑:WT1(胎児型心外膜細胞); 赤:TNNI3 (成熟心筋細胞); 青:Hoechst (核)
(右) 緑:SNAI1 (EMTマーカー); 赤:ZO-1(タイトジャンクション); 青:Hoechst (核)
4)薬剤スクリーニングへの応用
Torin1誘導によって得られた成熟した心外膜モデルは、心外膜の再活性化を促進する化合物を同定するための創薬スクリーニングプラットフォームとして活用することが期待できます。それを検証するために1,600種類の化合物ライブラリーを用いたハイスループットスクリーニング注3)を行いました。それぞれの再活性化効果はMKI67(増殖マーカー)の発現レベルにより評価を行いました。ヒット化合物に対するパスウェイ濃縮解析により、GSK3α/β阻害剤が主要なパスウェイの一つとして同定されました。
これらの結果は、成熟したiPS細胞由来心外膜モデルの前臨床応用の可能性を支持するとともに、再生医療を目的とした臨床応用に向けたハイスループット創薬に応用可能な細胞プラットフォームを確立するものです。
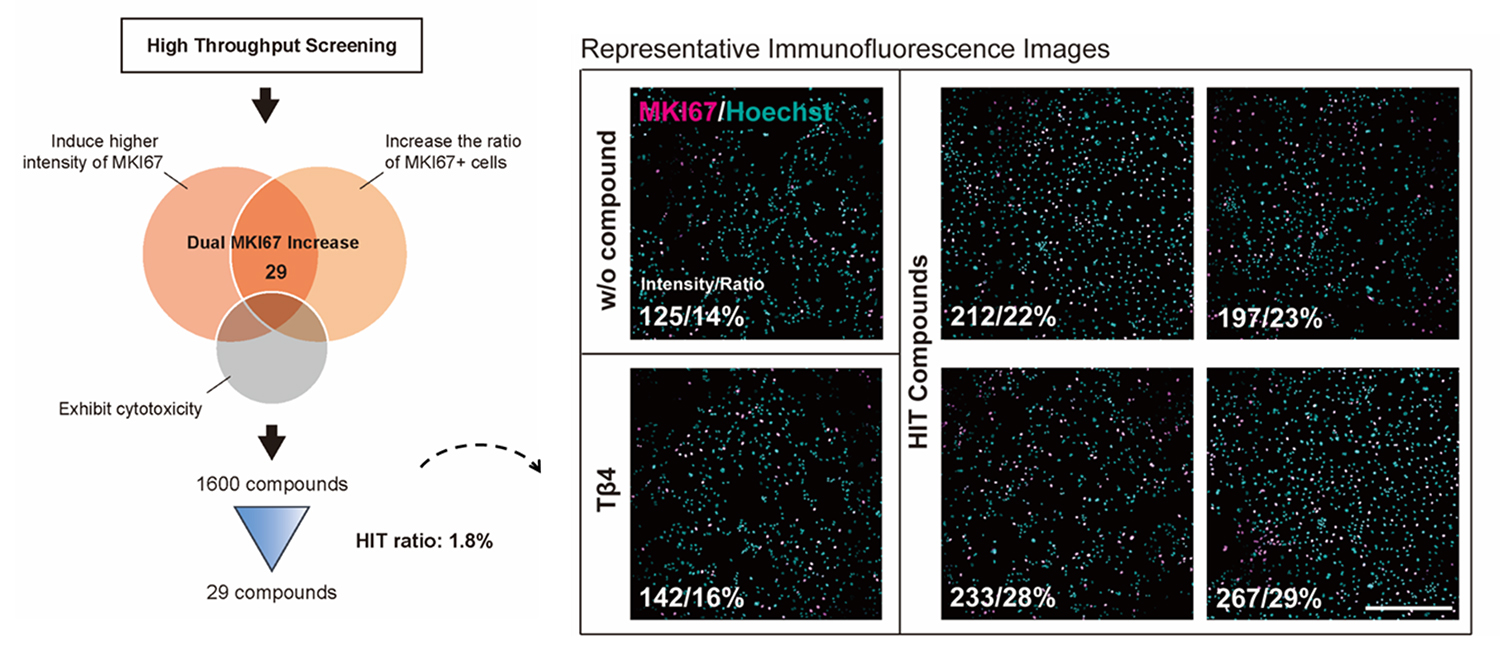
Fig.4 ハイスループットスクリーニングの流れと
免疫染色画像
赤:MKI67(細胞増殖マーカー)
青:Hoechst(核)
w/o compound:化合物なし(陰性コントロール)
Tβ4:Thymosin beta 4(positive control)
今回の研究は、mTORシグナル伝達の抑制を介してヒトiPS細胞から機能的な成人型心外膜を効率的に生成する画期的な手法を確立しました。この手法により、成人心外膜の休止期状態と成熟を制御するmTOR複合体2(mTORC2)や転写因子MAFF、YBX3といった重要な分子メカニズムが解明されました。さらに、この成熟心外膜が心筋細胞の成熟を促進するパラクリン効果を持つこと、また心外膜の増殖を再活性化するGSK3α/β阻害剤を同定できる薬剤スクリーニングプラットフォームとしても有用であることが示されました。これらの結果は、心臓再生医療を目指した研究を前進させるものであり、心臓病の新たな治療戦略開発や再生医療に貢献すると考えられます。
- 論文名
Generation of mature epicardium derived from human-induced pluripotent stem cells via inhibition of mTOR signaling - ジャーナル名
Nature Communications - 著者
Yu Tian1,2†, Antonio Lucena-Cacace1,3*†, Kanae Tani1,2, Amanda Putri Elvandari1, Rodolfo S. Allendes Osorio3, Megumi Narita1, Yasuko Matsumura1, Ian Costa Paixao1, Yutaro Miyoshi1,2,
Azusa Inagaki1,
Julia Junghof1,2, Yoshinori Yoshida1* - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 大阪大学 ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)
本研究は、下記機関より支援を受けて実施されました。
- 文部科学省(MEXT)奨学金
- Leducq Foundation(18CVD05)
- 日本学術振興会(JSPS)科学研究費助成事業(22K16137、24K11267、21H02912)
-
日本医療研究開発機構(AMED)
- 再生医療実現拠点ネットワークプログラム
「再生医療用iPS細胞ストック開発拠点」
「iPS細胞を用いたサブタイプ別心筋組織構築による心疾患研究」- 再生・細胞医療・遺伝子治療実現加速化プログラム
「心臓の病理を統合的に再現する領域特異的心筋組織モデルの構築」
「次世代医療を目指した再生・細胞医療・遺伝子治療研究開発拠点」
「心筋細胞と心外膜細胞を用いた心臓オルガノイドによる心筋組織再建治療の開発」- 医薬品等規制調和・評価研究事業
「重篤副作用患者由来iPS細胞バンクの構築に向けたフィージビリティ研究」
「ヒトiPS細胞技術とAI・機械学習を用いた統合的な抗がん剤心毒性評価法の開発と国際標準化」- 橋渡し研究プログラム
「iPS細胞由来心筋細胞を用いた心筋再建治療法の創出」 - 科学技術振興機構(JST)
ディープテック・スタートアップ国際展開プログラム(D-Global)(JPMJSF2323) - iPS細胞研究基金
注1)心外膜
心臓の最も外側を覆う膜。心臓の発生や、損傷後の修復(再生)に重要な役割を果たす細胞が含まれること。成人期には休止状態にあり、通常はその再生能力は限定的だが、損傷時にはその潜在的な再生能力の活性化が期待されている。
注2)mTORシグナル伝達
細胞の成長、増殖、代謝、生存などを調節する細胞内の重要な情報伝達経路の一つ。
注3)ハイスループットスクリーニング(HTS)
多数の化合物や遺伝子などを、自動化されたシステムを用いて高速かつ効率的に評価(スクリーニング)する技術のこと。新しい薬剤候補の探索などに用いられる。






















