
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2018年1月11日
iPS細胞から分化誘導された、心筋細胞へと特化して分化する心筋前駆細胞(心筋指向性前駆細胞)の目印となる分子を同定
ポイント
- ヒトiPS細胞から分化誘導された心筋細胞へと特化して分化する心筋前駆細胞細胞に特異的な細胞表面マーカーとして、CD82注1を同定した。
- CD82がWntシグナル注2を阻害することで、心筋細胞への分化誘導を促すことが分かった。
武田匡史特定病院助教(京都大学CiRA増殖機構分化機構研究部門)、山下潤教授(京都大学CiRA同部門)らの研究グループは、ヒトiPS細胞から心筋細胞への分化過程において、心筋細胞へ特化して分化していく細胞集団のマーカー分子として、CD82を同定することに成功しました。
まず、ヒトiPS細胞から分化誘導3~5日目の各段階の心血管前駆細胞注3から、心筋特異的分化培養条件(無血清培地)または非心筋特異的分化培養条件(血清培地)にて心筋細胞への分化誘導を検討したところ、分化誘導5日目の段階で、非心筋特異的な分化誘導条件(無血清培地)でも大部分が心筋細胞へ分化するという、
すなわち分化誘導4~5日目にかけて心筋への運命決定がなされることが分かりました。そこで各段階での遺伝子発現を調べたところ、CD82という細胞表面マーカーが一時的に発現しており、CD82陽性心血管前駆細胞は心筋細胞に特化して分化することが確認されました。さらに、心血管前駆細胞においてCD82を過剰発現させることで、Wntシグナルが阻害され、その結果、心筋細胞への運命決定が促され、結果、心筋への分化誘導が促進されるというメカニズムが明らかとなりました。本研究成果は、心筋細胞の分化メカニズムについてのさらなる理解や心臓の再生医療への応用に貢献することが期待されます。
この研究成果は2018年1月10日午前2時 (日本時間)に米国科学誌「Cell Reports」でオンライン公開されました。
心臓は、心筋細胞や内皮細胞注4、血管平滑筋細胞などの中胚葉注5由来の細胞系列から構成されます。iPS細胞を含む多能性幹細胞から心筋細胞を分化誘導する際には、まず中胚葉に、そして心血管前駆細胞からなる心臓中胚葉に分化し、心血管前駆細胞から心筋細胞へと分化することが分かっています。しかしながら、心血管前駆細胞から心筋細胞への分化過程において、いつ、どのように心血管前駆細胞の運命が心筋細胞へと決定されるのかはまだ明らかとなっておらず、心筋分化メカニズムを理解する上での課題となっています。
また、in vitro注6で最適化された心筋特異的分化培養条件(無血清培地)では、心血管前駆細胞から高効率に心筋細胞を分化誘導することが可能でありますが、
それ以外の非心筋特異的分化培養条件(無血清培地)や生体内に移植した場合、心血管前駆細胞は心筋細胞とは別の血管細胞系列や間質細胞注7系列へと分化していく傾向を認めました。
そこで、心臓の再生医療への応用に向けて、安定して心筋細胞を供給するためには、in vitro、in vivo注6のいずれの条件でも、心筋細胞に特化して分化していく細胞集団(ここでは、心筋指向性前駆細胞と呼びます)を選別できる技術の開発が必要であると考えられました。
そこで、本研究グループは、ヒトiPS細胞から分化した心筋指向性前駆細胞を同定する手法の開発を目指して研究に取り組みました。
1. 心筋指向性前駆細胞に特異的な細胞表面マーカーの候補としてCD82を同定した
グループはまず、ヒトiPS細胞から心筋細胞を分化誘導する過程において、細胞が心筋細胞となる運命決定がどのタイミングでなされるかを調べました。
心筋細胞への分化誘導過程の途中における心血管前駆細胞の代表的な細胞表面マーカーであるKDR注8とPDGFRα注9に着目し、iPS細胞から分化誘導3,4,5日目の、
両マーカーを発現している心血管前駆細胞をフローサイトメトリー注10にて精製し、それぞれを心筋特異的な分化誘導条件(無血清培地)または非心筋特異的な分化誘導条件(血清培地)にて14日間培養し心筋細胞への分化誘導を検討しました。
すると、iPS細胞から分化誘導5日目の段階で、非心筋特異的な分化誘導条件(血清培地)にても心筋細胞へ分化するという、すなわち分化誘導4~5日目にかけて心筋への運命決定がなされることが分かりました。
次に、ヒトiPS細胞、分化誘導3,4,5日目の心血管前駆細胞と、分化誘導5日後の心血管前駆細胞からさらに分化した心筋細胞において、全遺伝子の発現を調べました。
すると、KDRとPDGFRαを含む6つの遺伝子が心血管前駆細胞にて高く発現していましたが、中でもCD82のみが分化誘導の日数(3日、4日、5日)に従って発現が高くなり、
かつ分化4日目から5日目にかけて有意に発現を高くしていることが分かりました。
さらに、心筋細胞への分化誘導におけるCD82の発現の経時変化をフローサイトメトリーで調べたところ、
iPS細胞から分化誘導4日目からCD82陽性の細胞群が出現し始め、日数が経つにつれその割合は大きくなり7日後に最大65%の細胞がCD82陽性心血管前駆細胞となりました。
それ以降は、CD82陽性細胞は減少していきました。とりわけ、分化誘導5日目の時点でCD82陽性細胞の割合が増加していることから、
CD82は心筋指向性前駆細胞に特異的な細胞表面マーカーの候補分子であると考えられました。
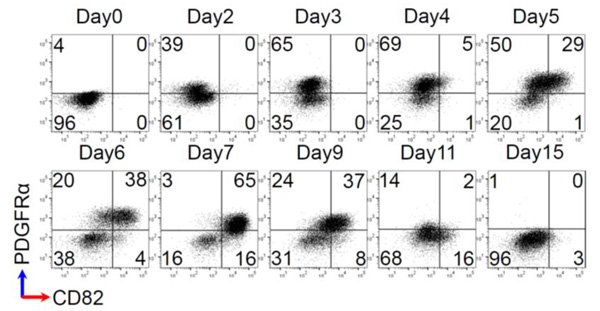
図1. ヒトiPS細胞から心筋細胞への分化誘導過程におけるCD82発現の経時変化
各4区画内の数値は、細胞数の割合(%)を示す。
横軸はCD82の発現量を見ており、右に行くほどCD82の発現量が高い。
縦軸は心血管前駆細胞の細胞表面マーカーであるPDGFRαの発現量を見ており、上に行くほどPDGFRαの発現量が高い。
2. CD82は心筋指向性前駆細胞のマーカー分子として妥当である
実際にCD82が心筋指向性前駆細胞に特異的な細胞表面マーカーとして妥当かどうかを検証するため、CD82陽性(CD82を発現している)心血管前駆細胞が非心筋特異的な分化誘導条件(血清培地)においても心筋細胞へと分化するかを調べました。
具体的には、分化誘導3,4日目の心血管前駆細胞からCD82陰性(CD82を発現していない)細胞群を、5日目の心血管前駆細胞からCD82陽性、陰性それぞれの細胞群を、そして6,7日目の心血管前駆細胞からCD82陽性細胞をそれぞれ精製し、
非心筋特異的な分化誘導条件(血清培地)あるいは心筋特異的な分化誘導条件(無血清培地)で14日間培養し、心筋細胞への分化誘導を検討しました。すると、CD82陰性心血管前駆細胞からは、
心筋特異的な分化誘導条件(無血清培地)では50~75%が心筋細胞に分化し心筋分化能を有していることが示されたものの、非心筋特異的分化誘導条件(血清培地)ではほとんど心筋細胞に分化されず、
他の種類の細胞である周皮細胞注11あるいは間葉系細胞注12となっていました。それに対し、CD82陽性心血管前駆細胞からは、いずれの培養条件において、
特に非心筋特異的な分化誘導条件(血清培地)でにおいてもほとんどが心筋細胞へ分化しており、これらの結果より、CD82が心筋指向性前駆細胞のマーカー分子として妥当であることを示しました。
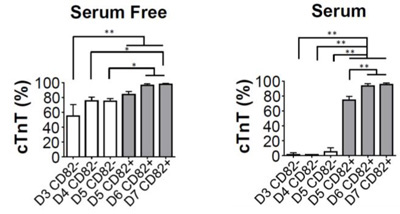
図2. CD82陽性細胞からは高効率で
心筋細胞が分化誘導される
縦軸のcTnT(心筋トロポニン)は心筋細胞のマーカー
タンパク質で、縦軸は心筋細胞の割合を示す。
左:心筋特異的分化誘導条件(無血清培地)下で
分化誘導した場合
右:非心筋特異的分化誘導条件(血清培地)下で
分化誘導した場合
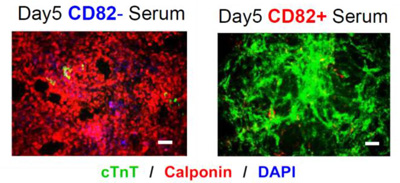
図3.非心筋特異的分化誘導条件(血清培地)下で分化誘導した細胞像
CD82陰性細胞(左)からは主に非拍動性の周皮細胞や間葉系細胞(赤)が生じたが、CD82陽性細胞(右)からは拍動性の心筋細胞(緑)が分化誘導された。
3. CD82陽性心筋指向性前駆細胞は生体内で生着し、高率に心筋細胞へと変化した
次にグループは、CD82陽性心筋指向性前駆細胞を心筋梗塞モデルマウスの梗塞部位に移植し、1~3ヶ月間観察しました。すると、移植細胞の約95%が心筋細胞へと分化し梗塞部位に生着している様子が分かりました。
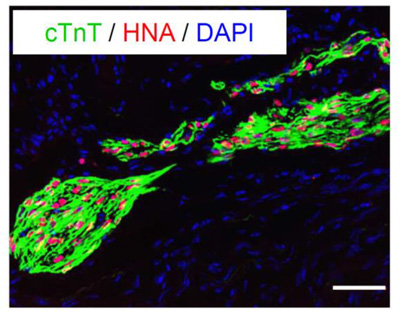
図4. 移植3ヶ月後の細胞像
CD82陽性心筋指向性前駆細胞を心臓梗塞部位に移植して3ヶ月後に観察した。
CD82陽性心筋指向性前駆細胞由来の細胞であることを示すヒト由来の核(赤)
陽性のほぼすべての細胞が心筋細胞を示す心筋トロポニンT(緑)陽性であることが観察された。
青色:細胞核、スケールバー:50µm
さらに、移植3ヶ月後には移植されたCD82陽性心筋指向性前駆細胞由来の心筋細胞の中にサルコメア注13構造が観察され、生着した心筋細胞が構造的に成熟していることが分かりました。
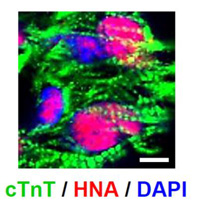
図5.移植3ヶ月後の細胞像(高倍率)
移植したCD82陽性心筋指向性前駆細胞(赤)から分化した心筋細胞(緑)の中に、
サルコメア構造が観察される。
青色:細胞核、スケールバー:5µm
これらの結果から、ヒトiPS細胞由来CD82陽性心筋指向性前駆細胞が、心臓梗塞部位に移植後生着し、高効率に心筋細胞に分化できることが示されました。
4. 心筋細胞への分化におけるCD82の生物学的機能を明らかにした。
本研究で心筋指向性前駆細胞の細胞表面マーカー分子として同定したCD82は、細胞内のβ-カテニン注14がエクソソーム注15に含まれて排出されることで、Wntシグナルの活性化を阻害することが知られています。また、Wntシグナルの阻害により心血管前駆細胞から心筋細胞への分化が促進されることも知られていることから、グループは、心血管前駆細胞から心筋細胞への運命決定は、CD82がβ-カテニンを含むエクソソームの細胞外への排出に関与して、Wntシグナルが阻害されることにより制御されているのではないかと考えました。
この仮説を検証するため、分化誘導5日目の心血管前駆細胞において、CD82を過剰発現させ、非心筋特異的分化培養条件(血清培地)で2日間培養しました。すると、培養液の上ずみ液の中のエクソソームが増加しており、さらには個々のエクソソーム内のβ-カテニンの増加を認め、そのため細胞の核内のβ-カテニンは減少し、結果、Wntシグナルが抑制されることがわかりました。さらに、CD82を過剰発現した心血管前駆細胞では心筋細胞への分化誘導効率が高くなっていました。これらの結果から、CD82が心血管前駆細胞において、核内のβ-カテニンがエクソソームにて排出されることにより、Wntシグナルを抑制することで、心筋細胞への運命決定を促していることが分かりました。
これまで、心臓の再生医療に向け心筋分化能を有する心血管前駆細胞について研究されてきましたが、生体内への移植における心筋分化能は必ずしも高いわけではありませんでした。 そのため、本研究で、心血管前駆細胞からさらに一歩先に進んだ心筋細胞へ分化することが運命決定され、心筋細胞に特化して分化する細胞集団(心筋指向性前駆細胞)の目印として、 細胞表面マーカーであるCD82を同定することに成功しました。CD82を発現している心筋指向性前駆細胞は、移植において、生体内でも生着し高効率に心筋細胞へと分化・成熟したことから、 今後の心臓再生において有用となると考えられます。併せて、CD82の心筋分化における機能の一端も本研究では明らかとなり、これらの研究成果が、 心筋細胞の分化メカニズムについてのさらなる理解や心臓の再生医療への応用に貢献することが期待されます。
- 論文名
"Identification of cardiomyocyte-fated progenitors from human induced pluripotent stem cells marked with CD82" - ジャーナル名
Cell Reports - 著者
Masafumi Takeda1, Yasuharu Kanki2, Hidetoshi Masumoto1,3, Shunsuke Funakoshi1, Takeshi Hatani1, Hiroyuki Fukushima1, Akashi Izumi-Taguchi2, Yusuke Matsui4, Teppei Shimamura4, Yoshinori Yoshida1, Jun K. Yamashita1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 東京大学アイソトープ総合センター
- 京都大学大学院医学研究科
- 名古屋大学大学院医学系研究科
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点
- 日本学術振興会(JSPS)・文部科学省 科学研究費補助金
- 公益財団法人 上原記念生命科学財団
注1) CD82
細胞表面糖タンパク質の一つ。細胞接着や細胞遊走・浸潤、がん細胞の老化、エクソソーム産生・分泌などに関わることが知られている。
注2) Wntシグナル
標的遺伝子の転写を促進するシグナル伝達機構。心筋分化以外にも、胚発生時の形態形成や組織の再生、がんの発生など様々な現象に関わる。
注3) 心血管前駆細胞
心臓発生の初期段階にある細胞で、この細胞から心筋細胞や内皮細胞、血管平滑筋細胞といったそれぞれの細胞系列へと分化していく。
注4) 内皮細胞
血管やリンパ管の内皮を構成する細胞。
注5) 中胚葉
受精後の胚からできる細胞の塊は、内胚葉、中胚葉、外胚葉に分けられる。中胚葉は骨、心筋、赤血球などに分化する。
注6) in vitro, in vivo
in vitro(イン・ビトロ)は、実験条件をあらかじめ決めた試験管内のような環境条件で行う実験を示す用語で、in vivo(イン・ビボ)は、マウスのような実験動物の体の中の条件での実験ということを示す用語。
注7) 間質細胞
結合組織の細胞。生体組織の支持構造を構成し、実質細胞を支える。
注8) KDR (Kinase Insert Domain Receptor)
血管内皮細胞増殖因子(VEGF)の受容体。血管内皮細胞の増殖と分化に重要な役割を果たし、血管新生に関与する。
注9) PDGFRα (Platelet-derived growth factor receptor alpha)
血小板由来増殖因子(PDGF)の受容体。胚発生や細胞増殖等に関与する。
注10) フローサイトメトリー
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。
注11) 周皮細胞
毛細血管において、内皮細胞の外側で血管壁を取り巻くように存在している細胞。
注12) 間葉系細胞
組織どうしの間を埋めて結合させるはたらきをもつ細胞。
注13) サルコメア
心筋は多数の筋原線維が束になった筋線維により形成される。筋原線維はZ膜でしきられており、この仕切られた単位をサルコメアと呼ぶ。
注14) β-カテニン
Wntシグナルのシグナル伝達因子。核内で転写因子と結合し、細胞の増殖や発生運命の決定に関わる遺伝子の転写を活性化する。
注15) エクソソーム
ほぼ全ての細胞で分泌される膜小胞。培養細胞からも分泌される。なお、体内では血液や尿などの体液中に観察される。様々なタンパク質や脂質などが含まれ、他の細胞に運搬されることにより、機能的変化を引き起こす。






















