
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2019年3月8日
ゲノム編集技術を用いて拒絶反応のリスクが少ないiPS細胞を作製
ポイント
- 細胞移植の際、レシピエントとドナー注1)のHLA注2)型が一致しないと、移植したドナー細胞はレシピエントのキラーT細胞注3)からの攻撃を受ける。また、ドナー細胞のHLAが消失していると、ドナー細胞はレシピエントのNK細胞注4)からの攻撃を受ける。
- CRISPR-Cas9ゲノム編集技術注5)を用い、キラーT細胞とNK細胞両方からの拒絶反応リスクが少ないiPS細胞の作製法を開発した。
- 本手法を用いると、7種類のiPS細胞株注6)によって、日本人の95%以上をカバーできると試算される。また、12種類のiPS細胞株によって世界的なカバー率の向上が可能と考えられる。
病気の患者さん自身の細胞ではなく、他人の細胞を使った他家移植注7)による再生医療は、移植する細胞と移植される側の細胞のHLA型が異なる場合、免疫拒絶反応が起こるリスクが避けられません。京都大学iPS細胞研究所(CiRA)は、免疫拒絶反応を低減するために、HLAホモ接合体注8)を有する健康な方(ホモドナー)から提供された細胞からiPS細胞を作製する、「再生医療用iPS細胞ストックプロジェクト注9)」を進めています。
HLAホモ接合体ドナーは非常に稀であり、日本人の約9割をカバーすることができるとされる140株注9)を集めるには、多くの時間と費用が必要となっています。
これまでの研究では、ゲノム編集技術を用いて、HLA分子の存在に重要なβ2ミクログロブリン(B2M)遺伝子やCIITA遺伝子をノックアウト注10)させるという方法が開発されてきました。しかし、HLA分子を失ったドナー細胞は抗原を提示する注11)能力が無くなってしまうことがわかっています。さらに、HLA分子が消失したドナー細胞は、レシピエントのNK細胞を抑制することができなくなり、攻撃されてしまうという問題があります。
徐 淮耕(ジョ・カイコウ)大学院生(京都大学CiRA)、王 博(オウ・ハク)研究員(京都大学CiRA)および金子 新 准教授(京都大学CiRA、T-CiRA)、堀田 秋津 講師(京都大学CiRA、T-CiRA)らの研究グループは、CRISPR-Cas9ゲノム編集技術を用いて、他家移植の際に免疫拒絶のリスクが少ないiPS細胞を作る2つの方法を開発しました。
一つ目の方法は、一般的なHLAヘテロ接合体ドナー由来iPS細胞において、染色体注12)の片側のHLA遺伝子部分を選択的に除去して、HLA擬似ホモ接合体を作るという方法です(方法1)。二つ目の方法は、NK細胞の反応を抑えるために、染色体片側のHLA-Cを残し、HLA-AとHLA-B遺伝子を壊すという方法です(方法2)。これらの手法で作製したiPS細胞由来細胞は、仮想レシピエントのキラーT細胞とNK細胞の攻撃を受けにくくなることが確認されました。
また、方法2を用いると、わずか7種類のiPS細胞株によって、日本人の95%以上をカバーできると試算され、12種類のiPS細胞株によって世界的なカバー率の向上が可能と考えられます。この研究成果はiPS細胞を使った再生医療の普及に大きく貢献できる可能性を示しています。
この研究成果は2019年3月8日午前1時(日本時間)に米国科学誌「Cell Stem Cell」でオンライン公開されました。
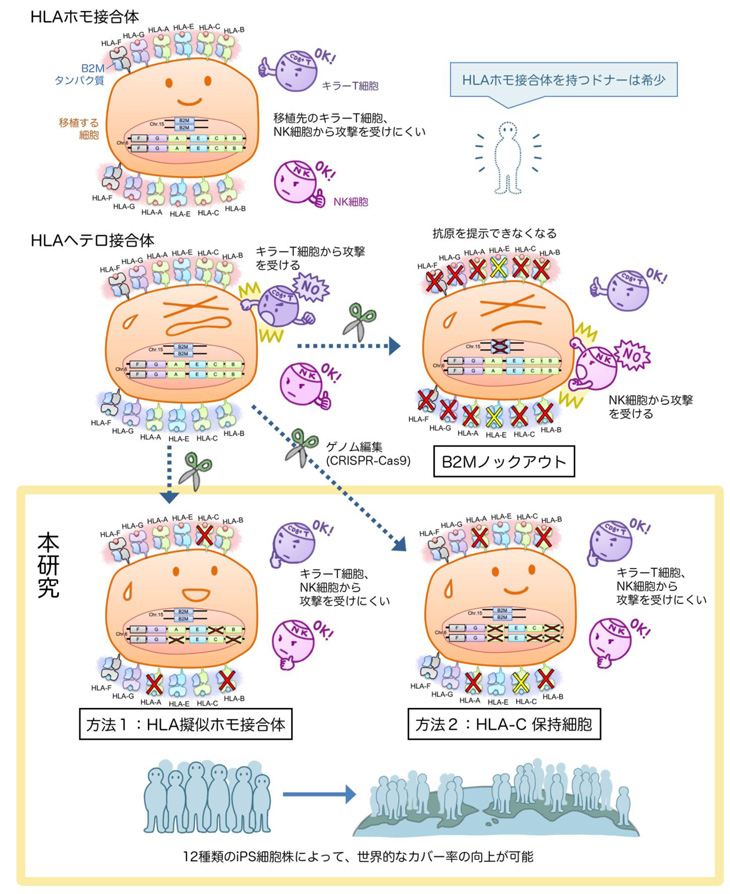
論文の概要図
他家移植時の免疫拒絶反応を考えると、iPS細胞を使った再生医療の理想の型は自家移植注7)です。現状ではiPS細胞を作製するのに時間と費用がかかることから、CiRAでは他家移植が可能な再生医療用iPS細胞ストックとして、HLAホモドナーからiPS細胞を作製しています。しかし、ほとんどの方はHLA型がヘテロであるため、90%以上の日本人をカバーできるHLA型を140株以上揃えるには、15万人以上のHLA型を調べる必要があると試算されており、日本よりもゲノム多様性に富む国際社会ではそれ以上の人数を調べる必要があると考えられています。
最近の研究では、HLAホモ接合体を有するiPS細胞に代わるものとして、ゲノム編集技術等を用いてB2M遺伝子やCIITA遺伝子をノックアウトする方法が報告されています。B2MはHLA-A、HLA-B、HLA-C遺伝子などで構成されるHLAクラス1分子注8)を構成(細胞表面に提示)するのに重要なタンパク質で、CIITAはHLA-DP、HLA-DQ、HLA-DR遺伝子などで構成されるHLAクラス2分子の発現に必要です。B2M遺伝子をノックアウトすると、全てのHLAクラス1タンパク質が細胞表面から消失します。HLAクラス1分子はキラーT細胞に抗原を提示することで外来の細菌やウイルスを認識し、提示された抗原を含めたHLAクラス1の"型"が非自己と認識された場合のみ免疫反応を開始することから、ドナー細胞のHLAクラス1分子を消失させることでドナー細胞はレシピエントのキラーT細胞からの攻撃を回避することができます。しかし、逆にHLAクラス1分子によって攻撃を抑制されていたレシピエントのNK細胞が活性化され、ドナー細胞を攻撃するようになります。また、ドナー細胞のHLA クラス1の抗原提示能がなくなることによって、病原体に感染した移植細胞や、がん原性を得たりした移植細胞をレシピエントのキラーT細胞が排除できなくなるリスクが想定されます。
そこで、本研究グループは、CRISPR-Cas9ゲノム編集技術を用いて、HLAヘテロ接合体の細胞から、他家移植の際に免疫拒絶のリスクの少ないiPS細胞を作る2つの方法を開発しました。
1)片側のHLA遺伝子をゲノム編集した"HLA擬似ホモ接合体"の作製(方法1)。
これまでの研究で、他家移植の場合、HLAクラス1のうちHLA-A、HLA-B、そしてHLA-Cを合わせることが重要だということが分かっていました。そこで、HLAヘテロ接合体のiPS細胞を用い、片側のHLA-A、HLA-B、HLA-Cをゲノム編集によって取り除くことによって、HLA擬似ホモ接合体iPS細胞を作製しました。このiPS細胞を血液細胞へと分化させ、キラーT細胞の免疫反応を調べました。すると、ゲノム編集されていないHLAヘテロ接合体のiPS細胞(604B1-WT)から分化させた血液細胞と比べて、HLA擬似ホモ接合体の血液細胞は仮想レシピエントのキラーT細胞からの攻撃を受けにくいことが分かりました(図1)。
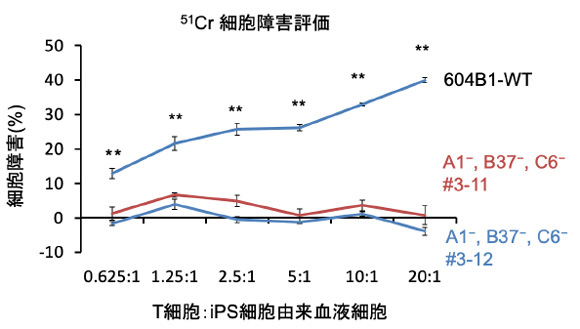
図1:HLA擬似ホモ接合体(方法1で作製したiPS細胞由来の血液細胞)に対する
キラーT細胞の活性
ゲノム編集されていないHLAヘテロ接合体iPS細胞(604B1-WT)とHLA擬似ホモ接合体iPS細胞(A1-, B37-, C6-#3-11および#3-12)をそれぞれ血液細胞に分化させ、細胞内にクロム元素(51Cr)を取り込ませた。そこにキラーT細胞を添加すると、攻撃を受けたiPS細胞由来血液細胞は融解して培地中にクロム元素を放出するので、培養液中のクロム元素の濃度によってキラーT細胞の攻撃(細胞障害)を定量化できる。右に行くほど添加したキラーT細胞の割合が増えている。WTでは培養液中のクロム元素の濃度がHLA擬似ホモiPS細胞由来細胞と比較して高く、キラーT細胞の攻撃を受けたことを示す。
2)HLA-Cを保持したままHLA-AとHLA-Bを壊した "HLA-C保持細胞"の作製(方法2)。
方法1によって、さまざまなHLA型において疑似ホモ接合体を作製することができますが、多様なHLA型それぞれに適合する細胞をストックする場合、さまざまな型のHLA-A/B/Cの組合せを揃える必要があります。
そこで、本研究では、HLA-A,-B,-Cのうち、基本1種類のHLA-Cだけを保持し、HLA-AおよびHLA-Bの遺伝子を完全に壊すという方法でiPS細胞を複数作製しました(方法2)。方法2で作製した細胞をドナー細胞として用いる場合、拒絶反応のリスクを少なくするにはHLA-Cの型のみを合わせればよいので、方法1よりもさらに少ない数のドナーで人口の多くをカバーできると考えられます。また、HLA-CはNK細胞の働きを抑制するのに大切であることが知られています。
方法2で作製したiPS細胞を血液細胞へと分化させ、クロム元素を用いて(HLA型ミスマッチ注2)の)キラーT細胞から攻撃を受ける度合いを調べると、方法1の場合やB2Mノックアウトの細胞と同等にキラーT細胞の攻撃を回避できることが分かりました(図2a)。さらに、NK細胞の活性を測定すると、HLA-A、HLA-B、HLA-Cの遺伝子を全てノックアウトした細胞やB2Mノックアウトした細胞は、NK細胞の攻撃を受けていることが示されましたが、方法2で作製したHLA-Cを1種類残した細胞は比較的攻撃を受けにくいことが分かりました(図2b)。
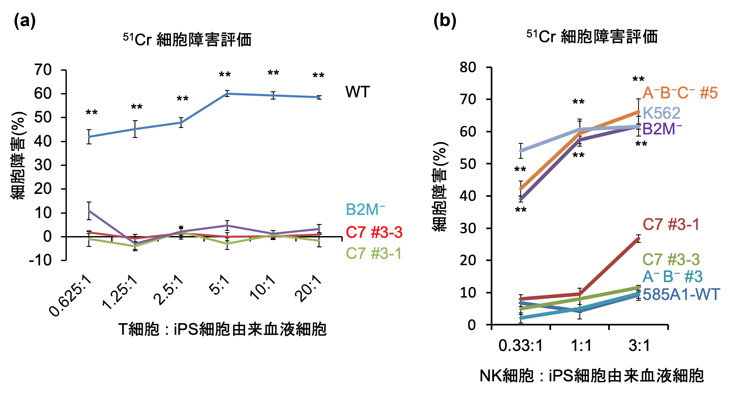
図2:HLA-C保持細胞(方法2で作製したiPS細胞由来の血液細胞)に対する
キラーT細胞とNK細胞の活性
(a)キラーT細胞の活性。WT:ゲノム編集しないHLAヘテロ接合体、B2M-:B2Mノックアウトした
細胞、C7:方法2によって作製したHLA-C保持細胞
(b)NK細胞の活性。A-B-C-:HLA-A、HLA-B、HLA-Cを全て除去したもの(HLA-Eは残存)、K562:陽性対照群(白血病細胞株)、B2M-:B2Mノックアウトした細胞、C7:方法2によって作製したHLA-C保持細胞、A-B-:HLA-C両アレルを残存し、HLA-A、HLA-Bを除去したもの、585A1-WT:ゲノム編集しないHLAヘテロ接合体
また、本研究で作製した細胞の生体内での生存率を調べるため、方法2で作製したiPS細胞由来の血液細胞と、ミスマッチHLA型に反応するヒトキラーT細胞を免疫不全マウス注13)に移植して1週間観察し、移植した細胞の生存率を調べました。すると、方法2で作製した細胞は、ゲノム編集していない細胞に比べて生存率が高く、キラーT細胞に攻撃されにくいことが確認されました(図3)。
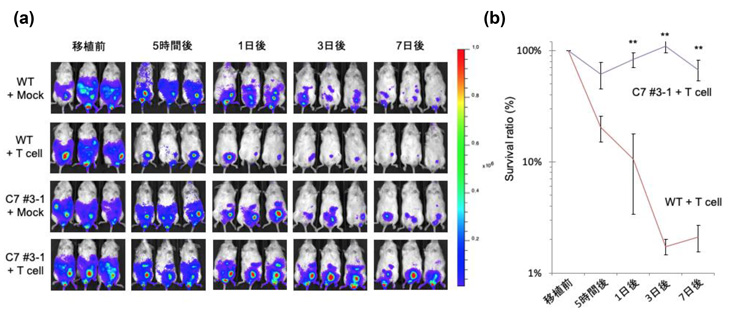
図3:HLA-C保持細胞(方法2で作製されたiPS細胞由来の血液細胞)とキラーT細胞を
免疫不全マウスに移植したときのHLA-C保持細胞の生存率
(a)移植後の各時点で、マウス体内で生存している移植細胞。WT:ゲノム編集していない細胞、
C7:方法2で作製した細胞。色のついている部分が生きている移植細胞を示す。
(b)移植後の各時点における移植細胞の生存率。C7はWTに比べ、移植細胞の生存率が高いことが確認された。
最後に、方法1や方法2によって作製したiPS細胞を使い、HLAクラス1のみを考慮した場合、人口をカバーするのにどれほどの細胞株が必要になるかを、HLA型が入手可能なエスニックグループ別に試算しました。その結果、方法1(片側HLA-A/B/Cを取り除いた擬似ホモ接合体iPS細胞)の場合、日本人の95%以上をカバーするのに73株が必要であると試算されました。一方、方法2(HLA-Cを保持したiPS細胞)の場合、HLA-Cの型の種類が比較的少ないため、日本人の95%以上をカバーするのに7株が必要ということが試算されました(図4)。
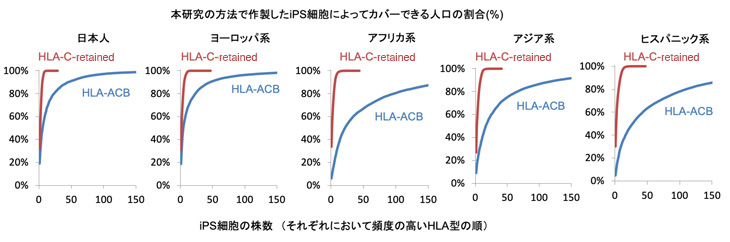
図4:本研究の手法で作製したiPS細胞によってカバーできる各地域の人口の割合
HLA-ACB(方法1):人口の95%をカバーするのに、日本人では73株、ヨーロッパ系で82株、アフリカ系で282株、アジア系で213株、ヒスパニック系で308株が必要と試算される。
HLA-C-retained(方法2):人口の95%をカバーするのに、日本人では7株、ヨーロッパ系で8株、アフリカ系で9株、アジア系で10株、ヒスパニック系で11株が必要と試算される。
※ヨーロッパ系、アフリカ系、アジア系、ヒスパニック系の米国のサンプルを用いて試算した。
本研究で開発したHLAゲノム編集細胞は、他家移植の際にレシピエントのキラーT細胞とNK細胞の両方からの攻撃を回避し免疫拒絶反応を抑制することができます。
特に、方法2を用いた場合、日本人をカバーするのに必要なiPS細胞の種類を大幅に減らすことができ、次世代iPS細胞ストックの構築に向けた重要な技術になると期待されます。
本手法だけでは全てのNK細胞の活性を抑制できない場合(C1/C2ヘテロやBw4の場合)もあるため、今後さらに研究を進める必要があります。
国内ではCRISPR-Cas9ゲノム編集技術を用いた臨床応用例はまだないため、オフターゲット変異リスク注14)を厳密に調べる必要もあります。
また、ゲノム編集で作成されたiPS細胞が、確実に目的の治療用細胞へと分化できるかどうかも確認する必要があります。
さらに、再生医療用のiPS細胞ストックでは、ゲノム編集を起因としたものに限らず、発がんの可能性のあるゲノム変異を持った細胞を取り除かなければなりません。
より安全性の高いiPS細胞の医療応用に貢献すべく、引き続き慎重に研究を進めていきます。
- 論文名
"Targeted Disruption of HLA genes via CRISPR-Cas9 generates iPSCs with Enhanced Immune Compatibility" - ジャーナル名
Cell Stem Cell - 著者
Huaigeng Xu1*, Bo Wang1*, Miyuki Ono1,2, Akihiro Kagita1, Kaho Fujii1, Noriko Sasakawa1,2, Tatsuki Ueda1, Peter Gee1,2, Misato Nishikawa1, Masaki Nomura1, Fumiyo Kitaoka1, Tomoko Takahashi1, Keisuke Okita1, Yoshinori Yoshida1, Shin Kaneko1**, and Akitsu Hotta1,2**
*:共著者、**:責任共著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 日本医療研究開発機構 再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点
本研究は、下記機関より資金的支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点 [JP18bm0104001] - 日本学術振興会(JSPS)科研費[15H05581]
※今回作製されたiPS細胞の染色体解析部分については株式会社chromocenterの協力を得ています。
注1)レシピエントとドナー
組織や細胞の移植において、受け入れる側をレシピエント、移植する組織や細胞を提供する側をドナーという。
注2)HLA
ヒトの主要組織適合遺伝子複合体(MHC)であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する型。ヒトの免疫に関わる重要な分子として働く。自身の持っている型と異なる(ミスマッチという)HLA型の人から細胞や臓器の移植を受けると、T細胞が「異物」と認識し、免疫拒絶反応が起こる。そのため、細胞や臓器を移植する際にはHLA型をできるだけ合わせて行われている。
HLAの型は非常に多様で、A座(HLA-A)、B座(HLA-B)、C座(HLA-C)などと呼ばれる抗原注11)の組み合わせで構成されており、各抗原に数十種類の型があるため、あわせて数万通りの組み合わせがある。そのため、自分と完全に一致するHLA型の人は、数百~数万人に1人の確率でしか存在しないといわれる。
注3)キラーT細胞
免疫においてはたらく細胞の一種。主にHLAクラス1分子に提示された抗原ペプチドや、非自己のHLA型を認識すると活性化して増殖し、異物及び病的な細胞を傷害して排除する。
注4)NK細胞(ナチュラルキラー細胞)
免疫においてはたらく細胞の一種。NK細胞は抗原特異的な免疫反応を示さず、非特異的に細胞を障害するといった免疫反応(自然免疫)。ただし、主に自己HLAのC座(HLA-C)、E座(HLA-E)、G座(HLA-G)の存在によって、活動が抑制されることが分かっている。
注5)CRISPR-Cas9 ゲノム編集技術
ゲノム編集技術とは、ゲノムの特定標的部位にDNA損傷を誘導することでDNA配列を編集する技術の一つ。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)-Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。切断されたDNAが修復する際にゲノムDNAの一部が欠失するため、遺伝子の機能(タンパク質発現)をノックアウトすることができる。
注6)株
1つの細胞から分裂して増えた、遺伝子が同じ細胞集団をクローンという。そのクローンを半永久的に継代培養することが可能になった状態の細胞を株という。
注7)他家移植と自家移植
ある個体から取り出した組織や細胞を別の同種の個体に移植することを他家移植(同種移植)という。一方、ある個体から取り出した組織や細胞を同じ個体に移植することを自家移植という。
注8) HLAホモ接合体
父親と母親から同じHLA型を受け継いだ子の細胞を「HLAホモ接合体」と言う。例えばA座について、A1、A2、A3......と数十種類の型があるが、両親それぞれから2つの同じ型を受け継ぎ、A1A1、A2A2、A3A3のような組み合わせをもつ細胞を「HLAホモ接合体」と言い、細胞移植においては、A1A1の細胞であればA1A2やA1A3組み合わせをもつ人(「HLAヘテロ接合体」の人)に移植しても拒絶反応が起こりにくいと考えられる。
また、HLAが持つタンパク質は、タンパク質の構造および機能の違いから、クラス1(HLA-A、-B、-C、-E、-F、-G)、とクラス2(HLA-DR、-DQ、-DP など )に分類される。クラス1はキラーT細胞に抗原を提示し、クラス2はヘルパーT細胞に抗原を提示する。クラス2は主にマクロファージやB細胞などの免疫担当細胞だけで発現しているのに対し、クラス1は体中のほぼ全ての細胞で発現している。一般的な臓器移植医療では、HLA-A, -B, -C, -DRのHLA型を調べて、なるべく型の一致するドナーを見つけて移植を行っている。
注9)再生医療用iPS細胞ストックプロジェクト
HLAホモ接合体の細胞を有する健康なドナーからiPS細胞を作製し、あらかじめ様々な品質評価を行った上で、再生医療に使用可能なiPS細胞株を保存するプロジェクト。平成25年に開始し、10年間で日本人の大部分をカバーできる医療用iPS細胞の製造を目標としており、本研究成果を取り入れたHLAゲノム編集iPS細胞の製造についても検討を開始している。
CiRAでは、3座ホモ接合型(HLA-A、HLA-B、HLA-DRの3座で父方由来と母方由来の遺伝子が同一)のHLAを持つ人からiPS細胞を樹立しており、HLA3座ホモ接合型のiPS細胞が140株あれば、日本人の約9割への細胞移植が可能という試算している。
注10)ノックアウト
ゲノム編集技術において、標的の遺伝子を破壊する(タンパク質が発現しないようにする)ことをノックアウトという。これに対し、標的ゲノム部位に外来遺伝子を挿入することをノックインという。
注11)抗原提示
細胞内部のタンパク質は、細かいペプチド断片(ペプチド)へと分解され、いずれかのHLAタンパク質と結合して細胞表面に提示される。この細かい断片(ペプチド)のことを抗原と呼び、HLAを介して細胞表面に提示することを抗原提示と呼ぶ。自己由来の抗原とHLA型に結合するT細胞は胸腺で排除されるが、非自己の抗原(ウイルスや細菌由来の抗原、及びがん細胞由来の抗原を含む)や非自己のHLA型を認識するT細胞は絶えず体内を監視しており、抗原やHLA型の不一致が認識されると、免疫拒絶反応が起こる。
注12)染色体
長い鎖状のDNAがヒストンに巻き付いた構造体。父方と母方から1組ずつ、合計2組が細胞内に存在する。HLA遺伝子群は6番染色体に搭載されている。
注13)免疫不全動物
免疫機能が低下している動物。このような動物は異種の細胞を移植しても拒絶反応を起こさず体内に生着するため、動物実験に用いられる。ヒトの細胞を免疫不全動物に移植し、動物の体内でヒト由来細胞の機能などを研究することを可能にしている。
注14)オフターゲット変異リスク
ゲノム編集において、標的遺伝子以外への部位へ意図しない変異が起きるリスクのこと。






















