
ニュース・イベント
News & Events
ニュース・イベント
News & Events
ニュース
News
2025年1月10日
CiRAメディア勉強会 開催報告:豊田講師がiPS細胞から膵島細胞を作る技術開発について解説
2024年10月21日(月)午後、1型糖尿病に対するiPS細胞由来膵島細胞シートによる治療法の開発をテーマに、メディア関係の方を対象とした勉強会を対面とオンラインを組み合わせたハイブリッド形式で開催し、17名の方にご参加いただきました。
今回の勉強会では、2025年1月に開始される1型糖尿病の治験に関わる技術開発について、研究に携わった豊田太郎講師(CiRA未来生命科学開拓部門)より解説しました。この記事では、勉強会の内容を紹介します。

メディア勉強会で説明をしている豊田講師
2024年10月2日(火)、京都大学医学部附属病院は、1型糖尿病患者さんを対象としたiPS細胞由来膵島細胞シートの安全性を確認するための医師主導治験を開始すると発表しました。
この治験で使用されるiPS細胞由来膵島細胞(iPIC)は、CiRAと武田薬品工業株式会社の共同研究により、CiRAの豊田太郎講師が主任研究者を務めたプロジェクトの一環として開発されました。現在、この技術はオリヅルセラピューティクス株式会社により引き継がれ、臨床応用に向けたさらなる開発が進められています。
1型糖尿病と膵島
糖尿病には、発症の原因により1型と2型、それ以外に大きくわけられます。遺伝的要因に食べ過ぎ、運動不足などの生活習慣が重なって発症する2型糖尿病がよく知られていますが、1型糖尿病は、免疫の異常などが原因とされ、10代に発症することが多い病気です。1型糖尿病の患者さんの人数は国内に10万人〜14万人ほどと推定されています。1型糖尿病では、血液中の糖(グルコース)の濃度(血糖値)を下げるインスリンというホルモンがほとんど、あるいは全く分泌されません。
インスリンは、通常、膵臓のなかの「膵島(ランゲルハンス島)」と呼ばれる組織に存在するβ細胞から分泌されます。膵島には、β細胞のほかにも、グルカゴンというホルモンを分泌するα細胞や、他のホルモンを分泌するδ(デルタ)細胞、PP細胞などが存在します。ホルモンを作り、分泌する細胞のことを内分泌細胞といい、特に膵島に存在する内分泌細胞をここでは膵島細胞と呼びます。

膵臓と膵島の細胞
血糖値は高くても低くてもからだに不具合をもたらすので、健康な人は、体内で常に正常な血糖値となるようにコントロールされています。
1型糖尿病の患者さんは血糖値を調節するために、注射や特殊なポンプなどによりインスリンを補充する対処療法を行います。インスリンを注射するときには血糖値を測って、必要な量のインスリンを計算する必要があり、間違えて多く投与すると低血糖になるリスクもあります。
注射によるインスリンの補充は食事や生活に合わせた細かいコントロールが難しく、特に血糖値の変動が激しい全体の1割程度の患者さんには、膵臓や膵島の移植治療が検討されます。これは、体内で血糖値が高くなると、膵臓や膵島に存在するβ細胞がそれを検知して、必要量のインスリンを分泌し、血糖値が落ち着くと分泌を止めるようになっているからです。しかし、膵臓や膵島を提供するドナーとなる方が少ないことが課題となっています。
iPS細胞から膵島の細胞を作る
豊田講師は、血糖値に応じてインスリンを分泌する医療用の膵島の細胞をiPS細胞から作る研究を2010年からはじめました。
ヒトのからだの細胞は、受精卵が分裂を繰り返しながら胎児の体が作られていく「発生」の過程で細胞が段階的に変化(分化)して作られていきます。受精後まもない時期に胚盤胞とよばれる、からだのすべての細胞になれる状態から分化が始まります。膵島の細胞は、まず内胚葉というグループの細胞になり、その後、前腸とよばれる部位の細胞へ、さらに、膵内胚葉の細胞へと分化します。膵内胚葉は、膵臓を構成する細胞の大元となりますが、そのうち、内分泌前駆細胞へと分化した細胞から、ホルモンを分泌する膵島の細胞が作られます。
豊田講師と長船健二教授(CiRA増殖分化機構研究部門)の研究グループは、この胚盤胞からの発生の流れを参考に、まずヒトの多能性幹細胞(ES細胞とiPS細胞)から膵内胚葉を効率よく作る方法を開発しました。実際に新しく開発した方法で分化させた細胞をマウスに移植したところ、膵臓の内部にみられる構造が作られ、一部がインスリンやグルカゴンを分泌する細胞へと分化しました。この実験から、分化させた細胞が確かに膵内胚葉の細胞としての能力をもつことが確認されました。
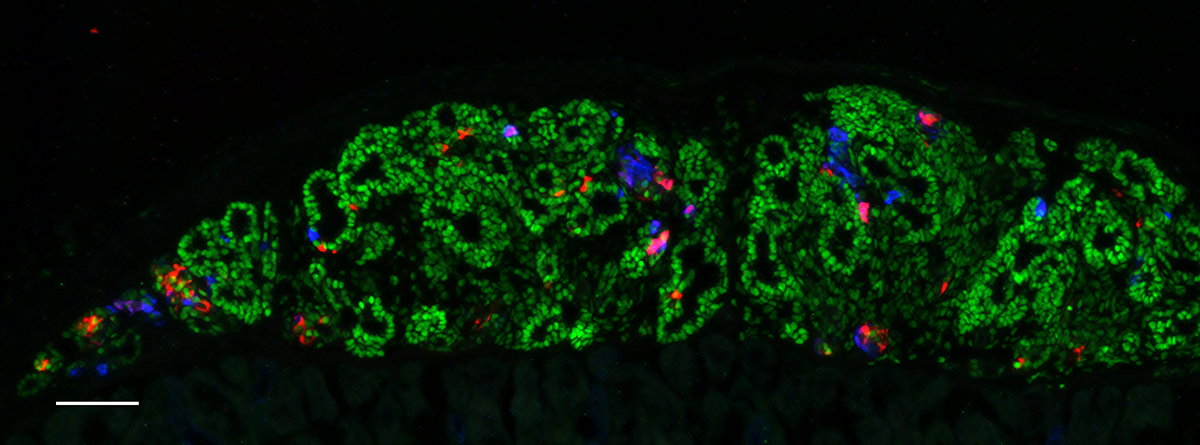
ヒトiPS細胞由来の膵内胚葉細胞を
マウスに移植して形成された膵組織
赤色:インスリン産生細胞、青色:グルカゴン産生細胞、緑色:膵前駆細胞。
スケールバー:100μm
糖の代謝は、膵島のα細胞、β細胞、δ細胞、PP細胞などが協調してはたらくことで細やかに調節されていると考えられています。特に、インスリンと対をなすホルモンのグルカゴンを分泌するα細胞は、低血糖時に必要です。そのため、移植するときも、こうしたホルモンを分泌する膵島の細胞が適切な割合で作られるようにしたいと考えました。研究グループは、こうした課題を踏まえて、この後、iPS細胞からβ細胞単体ではなく膵島の細胞を分化させる方法の開発を進めていきました。
医療につなげる膵島細胞を開発するために
これまでの基礎の研究成果から、実際の医療にも利用できる膵島細胞を作るために、豊田講師の研究グループは武田薬品工業との共同研究(T-CiRAプログラム)を行いました。臨床試験につなげるためには、病気を治療するための「薬効」の研究だけでなく、「安全性」を高めて、きちんと評価し、そして、安定した品質で実用に耐えうる製造方法であるかという「製造性」を満たす必要があります。
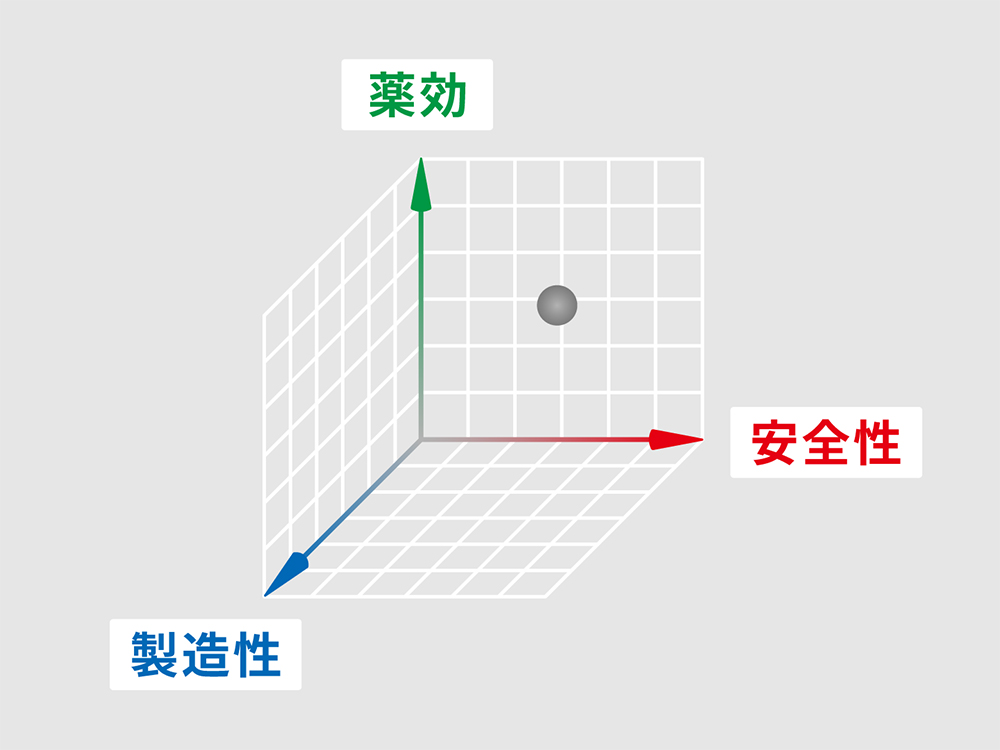
医療応用に必要な3つの要素
豊田講師の研究グループは、iPS細胞から膵島細胞を作り1型糖尿病のための「再生医療等製品」として実用化することを目指します。製品といっても、従来の低分子化合物やタンパク質などと異なり、作るのは生きた細胞です。そのため、製造工程の途中で細菌やウイルスを不活性化したり除去したりすることができません。厳密な検査を経た材料を使用し、製造プロセス全体を細菌などがいない清潔な無菌環境で完結させる必要がありした。
さらに、これまでマウスでは数百万個ほどの細胞を移植していましたが、実際の患者さんに移植するには、数億個程度が必要となると考えられました。これまでにない規模で細胞を大量に製造するためのシステムが必要となります。
このような無菌環境や大量培養など「製造性」を高めるために、研究グループは複数のメーカーと医療用の細胞製造システムの共同開発を行いました。結果として、細胞を育てるために必要となる培養液を無菌環境で定期的に交換できるフィルターや、一度に大量かつ均等な膵島細胞を製造、回収できる大型の培養バッグ(袋)を開発しました。
安全性を追求し、改良を重ねていく
安全性の点で、マウスに移植した細胞から、膵島細胞ではない、ホルモンを作らない細胞や増殖性の細胞が生じる可能性があるとわかりました。この課題を克服するため、研究グループは、分化させた細胞集団に含まれる目的外の細胞(ホルモンを作らない細胞や増殖性のある細胞)を詳しく調べました。その結果、単一細胞の特定の遺伝子の発現を解析する技術を利用して、大量の細胞のなかからごく少量の目的外の細胞を高感度で検出できる方法を開発しました。
さらに、解析で明らかになった目的外細胞の特徴から、特定の分子のはたらきを阻害することで目的外の細胞を除去することのできる方法を開発しました。実際に、iPS細胞から作った膵島細胞をマウスに移植したところ、目的外細胞はほとんど見られず、β細胞やα細胞などからなる正常な膵島組織が観察されました。また、糖尿病のマウスに移植し2ヶ月後には正常な血糖値になり、1年近くその効果が維持されることを確認しました。
安全性には、細胞を作るときに使う材料の管理も重要です。特に、細胞を製造する過程で、分化誘導のために必要な物質がDNAに結合すると、遺伝子の変異につながり、腫瘍化のリスクを高めてしまうと考えられます。研究グループがこれまで分化誘導に使っていた物質に遺伝子を変異させてしまう性質がないかを解析していった結果、β細胞への分化のために使用していた物質にそのリスクがあることが明らかになりました。これを受けて、この物質が分化を促す仕組みを改めて詳細に解析し、より安全と考えられる代替方法を見つけることができました。
こうして構築した方法で作られた膵島細胞をヒトに対する移植の安全性を確認するため、非臨床試験の一環として、100匹以上のマウスに移植を行い、長期にわたる効果と安全性を評価しました。その結果、これまでの開発を経てもなお、13%のマウスでは、移植から半年後に内分泌細胞でも、周辺に存在する膵管細胞でもない、目的外の組織が形成されることがわかりました。
多数のマウスで長期間の検査を行うには、費用も時間もかかります。研究グループは、目的外組織が作られる課題に対する解決策を効率よく見つけるため、まずは、マウスではなく、培養皿のなかで4週間という短期間でこの現象を再現する方法を作り上げました。この培養系でいくつかの化合物が目的外組織の形成を防ぐ作用を持つことを見つけました。iPS細胞から分化させた細胞に対して、この化合物による処理を行い、マウスへ移植する実験を改めて大規模に行いました。半年後に移植した場所の組織を詳しく調べたところ、従来法でみられた目的外組織は形成されず、非常に純度の高い内分泌細胞の組織が観察されました。
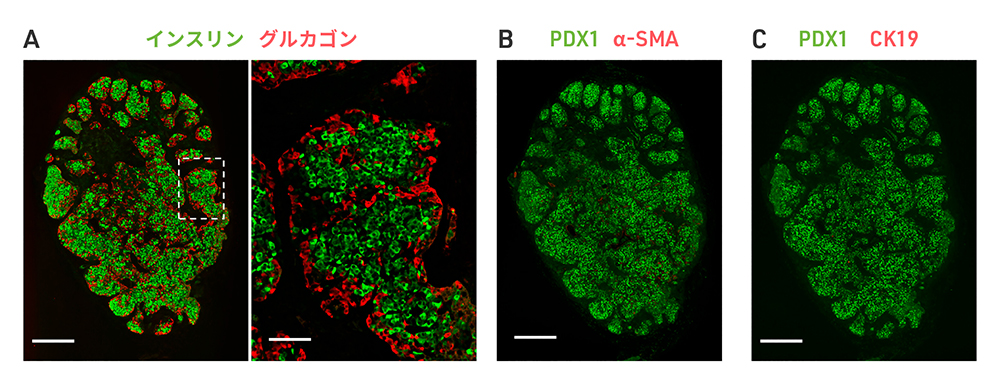
化合物による処理した場合の細胞を移植して
24週後の組織の様子
A:インスリン(緑色)を分泌する細胞とグルカゴン(赤色)を分泌する細胞が混在している。
右は、左の白色波線の囲み部分を拡大した像。
B,C:目的外細胞のマーカー(赤色)を発現する細胞はなく、膵島細胞(緑色)による純度の
高い組織が作られた。
スケールバー:500μm(A左, B, C)、
100μm(A右)
膵島細胞の移植をシミュレーションする
最後に、こうして作られた膵島細胞をどのように患者さんへ移植すればいいか、マウスよりもヒトに近い、サイズの大きな動物で安全かつ効果の期待できる方法を検証する必要があります。研究グループは、糖尿病を再現した実験用のミニブタを新たに開発し、ヒトiPS細胞から作製した膵島細胞の移植試験を複数の条件で行いました。
その結果、移植後、ミニブタの血中で、インスリン分泌の指標となる物質(ヒトCペプチド)が約1か月にわたって検出されました。この結果から、ミニブタの中で、ヒトiPS細胞から分化させた膵島細胞が生着して、インスリンを分泌していると考えられます。特に、ゲル状の物質に包んだ状態で膵島細胞を腹膜前腔、腹部皮下に移植したところ、移植した膵島細胞が組織中に確かに生着していることを確認することができました。
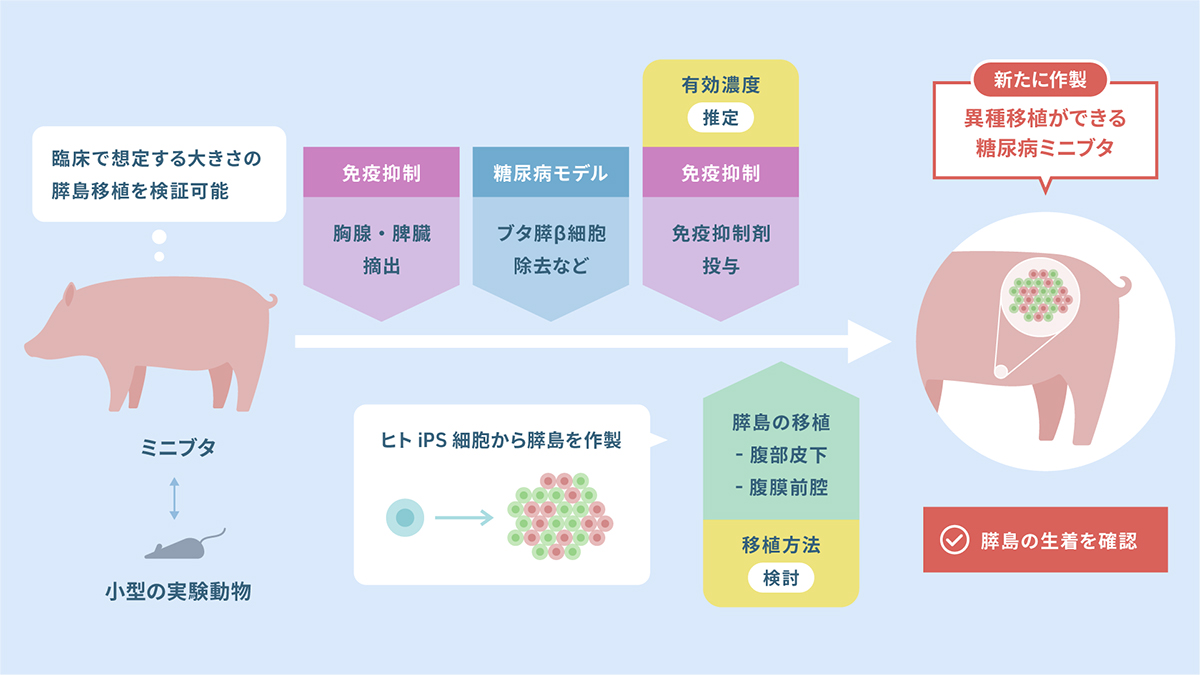
糖尿病ミニブタの作製と膵島の移植
再生医療の実現を目指して
医療に使うことのできるレベルの安全性や製造性を実現するために開発した一連の技術は、オリヅルセラピューティクス社に引き継がれており、さらに最適化が行われました。
豊田講師は最後にこれまでの開発を振り返り、基礎研究と医療応用のための研究開発の違いについて整理しました。
まず、医療用の製品の開発のためには、できるだけシンプルな製造工程を作ることが求められ、「シンプル・イズ・ベスト」という考えがあります。複雑な工程はコスト・リスクの観点から回避したほうがいいからです。
一方で、研究者はというと、いい方法があったらいいものに乗り換えていきたくてどんどん良くしていきたいと考えます。学術研究の世界であれば、数匹〜数十匹のマウスで試験して、その結果をいち早く報告することで評価されますが、医療用の製品開発には大規模な実験を時間と費用をかけて積み重ねる必要があります。開発という観点で、新しい方法に改良すると、データを1から全て取り直しとなります。
豊田講師はこのように、研究者として最先端の研究を進めていくことや、安全で有効な治療法を開発することのギャップがあることなど、医療応用を目指す研究開発の大変さを強調しました。今回は、共同研究相手の武田薬品工業から長期の安定した研究支援をいただいたほか、多くの人のサポートのおかげで、研究開発を治験へと導出することができたと続けました。

再生医療等製品の開発について解説する豊田講師
今回のメディア勉強会では、iPS細胞から再生医療のための細胞を作る研究開発とは、具体的にどのようなプロセスで進められ、どのような課題を克服する必要があるのかについて、その一例を紹介しました。
iPS細胞を用いた新しい医療の実現には、一つひとつの課題に一から対処することも多く、時間がかかります。CiRAではこれからも、新しい治療の選択肢を実現させるため、研究を続けて参ります。






















